热力学第一定律课后习题
一、是非题
下列各题中的叙述是否正确?正确的在题后括号内画“Ö”,错误的画“´”。
1. 在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。 ( )
2. dU = nCV,mdT这个公式对一定量的理想气体的任何pVT过程均适用。( )
3. 一个系统从始态到终态,只有进行可逆过程才有熵变。 ( )
4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。( )
5. 稳定态单质的DfH (800 K) = 0。 ( )
(800 K) = 0。 ( )
二、选择题
选择正确答案的编号,填在各题后的括号内:
1. 理想气体定温自由膨胀过程为:( )。
(A)Q > 0; (B)DU < 0; (C)W < 0; (D)DH = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q; ( B ) Q+W; (C ) W( Q = 0 ); ( D ) Q( W = 0 )。
3. pVg = 常数(g = Cp,m/CV,m)适用的条件是:( )
(A)绝热过程; ( B)理想气体绝热过程;
( C )理想气体绝热可逆过程; (D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒; ( B ) 热力学能不一定守恒,焓守恒;
(C ) 热力学能守恒,焓不一定守恒; ( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态; ( B )不可能到达同一终态;
( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变; (B )热力学能总是增加;
( C )焓总是增加; (D )热力学能总是减少。
7. 已知反应H2(g) +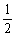 O2(g) ==== H2O(g)的标准摩尔反应焓为DrH
O2(g) ==== H2O(g)的标准摩尔反应焓为DrH (T),下列说法中不正确的是:( )。
(T),下列说法中不正确的是:( )。
(A)DrH (T)是H2O(g)的标准摩尔生成焓;
(T)是H2O(g)的标准摩尔生成焓;
(B)DrH (T)是H2O(g)的标准摩尔燃烧焓;
(T)是H2O(g)的标准摩尔燃烧焓;
(C)DrH (T)是负值;
(T)是负值;
(D)DrH (T)与反应的DrU
(T)与反应的DrU 数值不等。
数值不等。
三、计算题
习题1
10 mol理想气体由25℃,1.0 MPa膨胀到25℃,0.1 MPa,设过程为:
( 1 )自由膨胀;
( 2 )对抗恒外压力0.1 MPa膨胀;
( 3 )定温可逆膨胀。试计算三种膨胀过程中系统对环境作的功。
习题2
298 K时,将0.05 kg的N2由0.1 MPa定温可逆压缩到2 MPa,试计算此过程的功。如果被压缩了的气体在反抗外压力为0.1 MPa下做定温膨胀再回到原来状态,问此过程的功又是多少?
习题3
某理想气体,其CV,m = 20 J·K-1·mol-1,现有该气体10 mol处于283 K,采取下列不同途径升温至566 K。试计算各个过程的Q,W,DU,DH,并比较之。
( 1 )体积保持不变;
( 2 )系统与环境无热交换;
( 3 )压力保持不变。
习题4
试求下列过程的DU和DH:
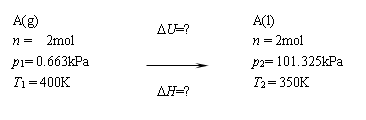
已知液体A的正常沸点为350 K,此时的汽化焓:DVapHm = 38 kJ·mol-1。A蒸气的平均定压摩尔热容Cp,m= 30 J·K-1·mol-1 。(蒸气视为理想气体)
习题5
根据下列数据,求乙烯C2H4(g)的标准摩尔生成焓与标准摩尔燃烧焓:
(1)C2H4(g) + H2(g) == C2H6(g) , DrH m y, l = -137 kJ·mol-1 ;
(2)C2H6(g) + (7/2)O2(g) == 2CO2(g) + 3H2O(l) ,DrH m y, 2 = -1560 kJ·mol-1 ;
(3)C(石墨) + O2(g) == CO2(g) , DrH m y, 3 = -393.5 kJ·mol-1 ;
(4)H2(g) + (1/2)O2(g) == H2O(l) , DrH m y, 4 = -285.8 kJ·mol-1 。
习题6
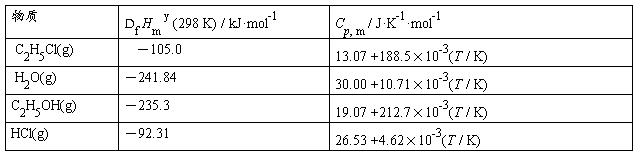
求下列反应在393 K 的反应的DrHm y (393 K) :
C2H5OH(g) + HCl(g) == C2H5Cl(g) + H2O(g)
已知:
习题7
已知反应CH3COOH(l)+C2H5OH(l)= CH3COOC2H5(l)+H2O(l)
DrH m y (298.15K)=-9.20kJ.mol-1
CH3COOH(l)的DcH m y (298.15K)= -874.54kJ.mol-1
C2H5OH(l)的DcH m y (298.15K)= -1366kJ.mol-1
CO2(g)的DfH m y (298.15K)= -393.51kJ.mol-1
H2O(l)的DfHmQ(298.15K)= -285.83kJ.mol-1
求算ΔfH m y (CH3COOC2H5,l,298.15K)=?
热力学第一定律课后习题答案
一、是非题
1. ´ 2 Ö 3. ´ 4 ´ 5Ö
二、选择题
1.(D) 2.(A) 3.(C) 4.(C) 5.(B) 6.(D) 7(B)
三、计算题
习题1
[题解] 体积功的计算公式 W= -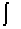 psudV
psudV
( 1 ) W = 0 (psu=0)
( 2 ) W = -psuDV = -psunRT (1/p1 -1/p2)
= -0.1 MPa×10 mol×8.314 J·mol-1·K-1×298.15 K×(1/0.1MPa-1/1.0MPa)
= -22.30 kJ
( 3 ) W = -nRTln( V2 / V1 ) = nRT ln(p2 / p1)= -57.05 kJ
[导引]由计算结果可知,虽然三个过程的初终态相同,但不同过程中的功不相等。这是因为W不是状态函数,其值与过程有关。
习题2
[题解]n = 50 g / 28 g·mol-1 = 1.79 mol
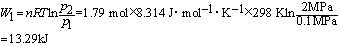 定温可逆压缩
定温可逆压缩
若反抗外压力0.1 Mpa,
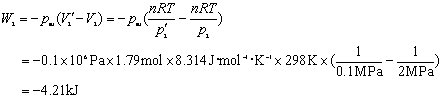
[导引]封闭系统由一个过程从始态(A)到达终态(B),再由另一个过程从终态(B)回到同一个始态(A),整个循环过程状态函数的改变量应为零;本题中,系统经历两个不同途径组成的循环过程由始态经过终态又回到同一个始态,功的加和不为零,说明功是过程量,其值与过程有关。
习题3
[题解] ( 1 )dV = 0,W = 0。
QV = DU = nCV,m ( T2-T1 )
= 10mol×20 J·K-1·mol-1×(566-283 ) K = 56.6 kJ
DH = nCp,m ( T2-T1 )
= 10mol×(20+8.314) J·K-1·mol-1×(566-283)K = 80.129 kJ
( 2 )Q = 0,
DU2 = DU1 = 56.6 kJ,
DH2 = DH1 = 80.129 kJ
W = DU2 = 56.6 kJ
( 3 )dp = 0,DU3 = DU1 = 56.6 kJ
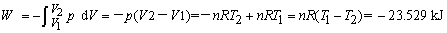 Qp = DH = 80.129 kJ
Qp = DH = 80.129 kJ
[导引]热力学能U和焓H是状态函数,只要系统变化前后的始、终态一定,则不论经历何种过程,其DU和DH一定。本题中虽然始终态不明确,但理想气体的U和H都只是温度的函数,即对理想气体只要始终态温度一定,则不同过程的DU和DH相同。而W和Q不是状态函数,其值与过程有关,所以上述三个不同过程的W和Q分别不同。
习题4
[题解] 设计变化途径如下:

DH1 = nCp,m( T2-T1 )
= 2 mol ´ 30 J·K-1·mol-1 ´ ( -50 ) K
=-3.00 kJ
DH2 = n ´ DVapHm =-2 mol ´ 38 kJ·mol-1 =-76 kJ
DH = DH1 + DH2 = (-76-3.0 ) kJ =-79 kJ
DU = DU1+DU2= nCV,m( T2-T1 )+DH2-D( pV )
= nCV,m( T2-T1 )+DH2+ nRT 2
» 2 mol ´ (30 -8.314)J·K-1·mol-1 ´ ( 350-400 ) K-76 ´103J +2 mol ´8.314J·K-1·mol-1 ´ 350 K=-72.35 kJ
或DU = DH-D( pV ) » DH-(-pVg,1 )
= DH + nRT1
=-79 kJ + 2 ´ 8.314 ´ 400 ´ 10-3 kJ
=-72.35 kJ
[导引]本题的变化过程既包括pVT变化又包括相变化,两种变化过程交织在一起,难以求出变化过程的DU和DH。为此将该变化过程分解为两步,一步为单纯的pVT变化,一步为单纯的定温定压下的可逆相变化,从而利用状态函数的改变量与过程无关的特性,求得DU = DU1(pVT变化)+DU2(相变化);DH = DH1(pVT变化)+DH2(相变化)。
习题5
[题解] (3)式×2+(4)式×3 -(1)式 -(2)式 得
2H2(g) +2C(石墨)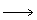 C2H4(g)
C2H4(g)
DfH m y = 2DrH m y,3+3DrH m y,4-DrH m y,1-DrH m y,2 = 52.6 kJ·mol-1;
(1)式+(2)式 -(4)式 得
C2H4(g) +3O2 (g) 2CO2 + 2H2O(l)
2CO2 + 2H2O(l)
DrH m y = DrH m y,1+DrH m y,2-DrH m y,4 = -1 411.2 kJ·mol-1;
[导引] 本题为利用盖斯定律,即方程式的线性组合,求得化学反应的标准摩尔反应焓。
习题6
[题解] Dr Hm y (298K)
= - Df Hm y (C2H5OH , g , 298K) + 4 Df Hm y (HCl , g , 298K) + Df Hm y (C2H5Cl , g , 298K) + Df Hm y (H2O , g , 298K)
= -19.23 kJ·mol-1
DrHm y (393 K) = DrH (298K) + 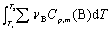
∑νBCp, m(B) =-2.53 J·K-1·mol-1-18.09×10-3 J·K-1·mol-1(T/K)
则DrH m y (393 K)
= -19.23 kJ ·mol-1 +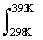 [-2.53 J·K-1·mol-1 -18.09×10-3 J·K-1·mol-1(T/K)]dT
[-2.53 J·K-1·mol-1 -18.09×10-3 J·K-1·mol-1(T/K)]dT
= -20.06 kJ·mol-1
[导引]本题为已知某一温度时参与反应各物质的DfH m y(或DcH m y),利用基希霍夫公式求算任意温度下化学反应的DrH m y。但需注意变温区间内参与反应各物质无相变化,当伴随有相变化时,还需把相变焓考虑进去。
习题7
[题解] 先由给定的反应及 CH3COOH(l),C2H5OH(l)的标准摩尔燃烧焓求出CH3COOC2H5(l)的标准摩尔燃烧焓ΔrH m y (CH3COOC2H5,l,298.15K),即
ΔcH m y (CH3COOC2H5,l,298.15K)
=DcH m y (CH3COOH,l,298.15K) +DcH m y (C2H5OH,l,298.15K) -DrH m y (298.15K)
=-874.54 kJ.mol-1-1366.91 kJ.mol-1 +9.20 kJ.mol-1
=-2232.22 kJ.mol-1
即 CH3COOC2H5(l)+5O2=4CO2(g)+4H2O(l) DrH m y (298.15K)=-2232.22 kJ.mol-1
再由该反应求得 DfH m y (CH3COOC2H5,l,298.15K) :
DrH m y (298.15K)
=4DfH m y (CO2, g, 298.15K)+4 DfH m y (H2O,l,298.15K) -DfH m y (CH3COOC2H5,l,298.15K)
得 DfH m y (CH3COOC2H5,l,298.15K)
= 4DfH m y (CO2,298.15K)+4 DfH m y (H2O,l,298.15K) -DrH m y (298.15K)
=[4×(-393.51)+4×(-285.91) -(-2232.22)] kJ.mol-1
=-485.46kJ.mol-1
[导引]注意掌握物质的DcH m y、DfH m y的定义,并能利用DcH m y及DfH m y求取反应的DrH m y。
第二篇:第二章 热力学第一定律 天津大学物理化学第五版 部分习题答案!
习题2.1
W=?p(V2?V1)=?nR¢T=?8:314J习题2.2
?p[V(l)?V(g)] pV(g) RT
8:314£(273:15+100)
3:102kJ W=?===
习题2.3
W=?[p2V2(H2;O2;g)?p1V1(H2O;l)]
?p2V2(g) X =nBRT
=(1+0:5)£8:314£(273:15+25)
; =3:718kJ
习题2.4
¢U=Qb+Wb=Qa+Wa=2:078?4:157=?2:079kJ
Wb=¢U?Qb=?2:079?(?0:692)=?1:387kJ

习题2.5
途径a
途径b
)
Wb
=?p¢V
3nRTnRT0′1
=?p?
p1p03TT0′1
=?nRp?
p1p0
3244:58298:25′
=?5£8:314£200£10£?
100£10200£10=?7:940kJ
3
¢U=Qb+Wb=Qa+Wa=25:42?5:57=19:85kJ)
Wb=¢U?Qb=19:85+7:940=27:79kJ
习题 2.6
H=U+pV)¢H?¢U=¢(pV)
)¢H?¢U=¢(pV)=¢(nRT)=nR¢T=4£8:314£20=665:1J
习题2.7
¢H=¢U+¢(pV)?¢(pV)=V¢p (1)
18:02£10?3
¢H?V¢p=£100£103=1:8J
997:04
(2)
18:02£10?3
¢H?V¢p=£(106?100£103)=16:3J
997:04
习题2.8
¢U=Q+W=nCV;m¢TW=0
)
¢U=Q=nCV;m¢T=5£1:5£8:314£50=3:118kJ
¢H=nCp;m¢T=n(CV;m+R)=5£2:5£8:314£50=5:196kJ
习题2.9
W=?p¢V=?nR¢T=?5£8:314£(?50)=2:079kJ
¢U=Q+W=nCV;m¢T=5£2:5£8:314£(?50)=?5:196kJ
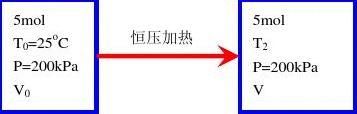
¢H=Q=¢U?W=?5:196?2:079=?7:275kJ
习题2.10
p0V0=p2V2)T0=T2
)¢U=0; ¢H=0
W=?pe¢V=?200£103£(25?50)£10?3=5:00kJ
¢U=Q+W=0)Q=?W=?5:00kJ
习题2.11
¢U=nCV;m¢T=1£20:92£(97?27)=1:464kJ
T300:15p1=p20=250:00£103£=202:7kPa T2370:15
3RT′RT20W=?p1¢V=?p1?=2:497kJ p2p0
¢U=Q+W)Q=¢U?W=?1:033kJ
¢H=nCp;m¢T=n(CV;m+R)¢T=1£29:23£(97?27)=2:046kJ 习题2.12
RT2R800 ?3T?14:25£10?6T2)dTCdTp;m(26:75+42:258£10T1 p;m==300
T2?T1800?300 ˉ800?3T2?114:25£10?6T3)ˉ(26:75T+142:258£10ˉ 300= 500
=45:38J¢mol?1¢K?1
103
¢H=p;m¢T=£45:38£500=515:6kJ 44:01
习题2.15 恒容绝热过程
¢U=QV=n(Ar;g)CV;m(Ar;g)¢T(Ar;g)+n(Cu;s)CV;m(Cu;s)¢T(Cu;s)=0
¢T(Ar;g)=T;
¢T(Cu;s)=T?150
;
CV;m(Cu;s)?Cp;m(Cu;s)
CV;m(Ar;g)=Cp;m(Ar;g)?R
)
n(Cu;s)CV;m(Cu;s)T(Cu;s)o
T==74:23C
n(Ar;g)CV;m(Ar;g)+n(Cu;s)CV;m(Cu;s)
¢H=n(Ar;g)Cp;m(Ar;g)¢T(Ar;g)+n(Cu;s)Cp;m(Cu;s)¢T(Cu;s)=2:47kJ
习题2.16
3300£10
n(CO)=n(H2)==9990mol
M(CO)+M(H2)
把水煤气和水看作一个系统,则此系统与环境的热交换Q=0
ZT2ZT2
Q=n(CO;g)Cp;m(CO;g)dT+n(H2;g)Cp;m(H2;g)dT
T1T1
+m(H2O;l)Cp(H2O;l)¢T(H2O;l)=0
n(CO;g)
m(H2O;l)=?
习题2.17 等压绝热过程
3519
¢U=¢UB=yBnCV;m(B)¢T=3£R¢T+2£R¢T=R(T2?T1)
222 p5
W=?p2¢V=?p2(V2?V1)=?nRT2+2nRT1=RT1?5RT2
p12
¢U=Q+W=W
24
)T2=T1=331:0K
29
RT2
T1
Cp;m(CO;g)dT+n(H2;g)
RT2
T1
Cp;m(H2;g)dT
Cp(H2O;l)¢T(H2O;l)
=2863:8kg
XX
¢H=
X
¢HB=
X
yBnCp;m(B)¢T=¢U+¢(pV)=¢U+nR¢T=
29
R¢T=?8:315kJ2
¢U=Q+W=W=
19
R¢T=?5:448kJ2
习题2.18
恒压绝热过程
Qp=¢H=¢HB=nBCp;m(B)¢T(B)=0
)nACp;m(A)¢T(A)+nBCp;m(B)¢T(B)=0
572£R[T?T1(A)]+5£R[T?T1(B)]=0 22
)T=350:9K XX
W=¢U=
习题2.20
可逆相变 X¢UB=XnBCV;m(B)¢T(B)=?369:2J
103
Qp=¢H=?n¢vapHm=?£40:668=?2257kJ 18:02
W??peV=nRT=172:2kJ
¢U=W+Q=?2085kJ
习题2.21
(1)
103
Qp=¢H=n¢vapHm=£40:668=2257kJ 18:02 W??peV=?nRT=?172:2kJ ¢U=W+Q=2085kJ
(2)
W=0
¢H=2257kJ
QV=¢U=¢H?¢(pV)=2085kJ
习题2.22
¢H¢H1¢H2
¢H=¢H1+¢H2=0
=?n¢vapHm+p;m(H2O;l)¢T(H2O;l)+p(M;s)¢T(M;s)
3:913:91=?£40:668£103+£75:32(97:6?100)+212£p(M;s)(97:6?15)18:0218:02
p(M;s)=506:2J¢kg?1¢K?1
习题2.23
(1)
T2=0oC
(2)
Qp=¢H=¢H1+¢H2=0 =mlp;l¢Tl?msp;s¢Ts?mx;s¢fush
¢T=T?T=0?(?50)=50oC l2l;1
¢Ts=T2?Ts;1=0?(?20)=20oC
mx;s=531:65g m2;s=ms?mx;s=800?531:65=268:35g
m2;l=mx;s+ml=531:65+1000=1531:65g
习题2.24
¢H
¢H1 ¢H2
¢vapH
看作恒压过程,始态(l,T=20oC,p=1.003MPa),末态(g,T=180oC,p=1.003MPa),H是只是温度的函数,有:
¢H=¢H1+¢vapH+¢H2 ZT3
=p;l¢Tl+n¢vapHm+nCp;m(H2O;g)dT
T2
=2:746MJ
习题2.25
¢H
¢H1¢H2
a¢fusHm
¢H=¢H1?¢fusHm+¢H2
a=Cp;m;l¢Tl?¢fusHm+Cp;m;s¢Tsa
=?5:621kJ¢mol?1
习题2.26
¢H
¢H1
a¢vapHm
¢H2
¢H===
a
¢H1+¢vapHm+¢H2
aCp;m(H2O;l)¢Tl?¢vapHm+Cp;m(H2O;g)¢Tg
43:82kJ¢mol?1
习题2.27
MC10H8=128:17
dnB10=128:17?===0:07802mol
oB1
Q?401:727 a
¢CUm=V==?5:149MJ¢mol?1
?0:07802
XX aa
¢CHm=Qp=QV+oBRT=¢CUm+oBRT=?5:154MJ¢mol?1
习题2.31
求HCOOCH3的标准摩尔生成焓 (7)=2?(5)?2?(4)?(6)
a¢rHm=
X
a
oB¢fHm(B)=?1:628kJ¢mol?1
习题2.33
Z
aa¢rHm(T)=¢rHm(T0)+
T
¢rCp;mdT
T0
¢rHm(T0)=¢rCp;m=
a
X
a
oB¢fHm=206:1kJ¢mol?1
oBCp;m=63:87£?69:26£10?3T+17:84£10?6T2
ZT
aa¢rHm(T)=¢rHm(T0)+¢rCp;mdT
T0
X
=190:0£103+63:87T?34:63£10?3T2+5:947£10?6T3
a¢rHm(T=1000K)=225:2kJ¢mol?1
习题

2.34
¢H=0
¢H1¢H2
a¢rHm
假定为绝热状态,有:
a
=¢H1+¢rHm+¢H1=0
¢H
=n(CH4;g)p;m(CH4;g)¢T1+n(O2;g)p;m(O2;g)¢T1
+3p;m(O2;g)¢T1+n(N2;g)p;m(N2;g)¢T1
a
+¢rHm
+n(CO2;g)p;m(CO2;g)¢T2+n(H2O;g)p;m(H2O;g)¢T2+p;m(O2;g)¢T2+n(N2;g)p;m(N2;g)¢T2
¢rHm=
a
X
a
oB¢fHm(B)=?802:34kJ¢mol?1
¢T1=T1?T;¢T2=T2?T1
T=8:8:54K=535:4oC
习题 2.38
(1)
RTRT V1==0:01455m3;V2==0:05820m3p1p2
VW1=?RTln2=?4:034kJ V1
(2)
W2=?p2£(V2?V1)=?2:182kJ
(3)
W3=0kJ
(4)绝热可逆压缩 μ?1?° p1T2=T1¤=235:5K p2
Cp;m7=2R°===1:4 CV;m5=2R
nR(T2?T1)W4==¢U=nCV;m(T2?T1)=?2:379kJ °?1
(5)
列出方程式
?p2£(V2?V1)=nCV;m(T2?T1)
μ? nRT2nRT1?p2£?=nCV;m(T2?T1) p2p1
T2=275:0K
W5=¢U=nCV;m(T2?T1)=?1:559kJ
习题2.40
绝热可逆:
pV°=Kμ?@ppp=KV?°)=?°KV?°?1=?°pV°V?°?1=?°@VSV
恒温可逆:
pV=K
μp=KV)@p
@V?=?KV?2=?pVV?2
Tp=?V
*°>1)ˉˉˉpˉˉˉˉpˉ ˉ?°ˉ>ˉ?ˉVV
