三十四、硅及其化合物
一、硅单质 1、组成:Si
2、结构:每个硅原子与四个硅原子以共价键相连形成正四面体,向空间发展形成网状结构,构成原子晶体。晶体类型:原子晶体 作用力:共价键 键角:109°28’ 3、物理性质:熔点高、硬度大、半导体 4、化学性质:具有一定的金属性、还原性。 (1)硅与氟气反应:Si+2F2===SiF4 (2)硅与氯气加热:Si+2Cl2(3)硅和氧气反应:Si+O2
△
SiCl4
△
SiO2
(4)硅和氢氟酸反应:Si+4HF===SiF4+2H2↑
(5)硅和氢氧化钠溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑ 5、制法:(6)工业上用二氧化硅与碳在高温下反应制备粗硅:SiO2+2C
高温
Si+2CO↑
(7)工业上利用SiCl4和氢气在加热条件下制备纯硅:SiCl4+2H2
△
Si+4HCl
6、用途:硅芯片、太阳能电池、半导体 二、二氧化硅
1、组成:化学式:SiO2 俗名:石英、硅石、水晶
2、结构:每个硅原子与四个氧原子以共价键相连形成正四面体,每个氧原子与两个硅原子 以共价键相连,向空间发展形成网状结构,构成原子晶体。 晶体类型:原子晶体 作用力:共价键 键角:109°28’ 3、物理性质:熔点高、硬度大,不溶于水 4、化学性质:酸性氧化物,有一定氧化性。
(1)二氧化硅与氢氟酸反应:SiO2+4HF===SiF4+2H2O
氢氟酸不能保存在玻璃容器中,原因氢氟酸能腐蚀玻璃。
(2)二氧化硅与氢氧化钠溶液反应:SiO2+2NaOH===Na2SiO3+H2O
氢氧化钠溶液不能用玻璃塞的玻璃瓶保存,原因是二氧化硅与氢氧化钠溶液反应会生
成硅酸钠粘结玻璃塞。 (3)二氧化硅在高温下与氧化钙反应:SiO2+CaO
高温
CaSiO3
Na2SiO3+CO2↑
(4)二氧化硅在高温下与碳酸钠反应:SiO2+Na2CO3
高温
(5)二氧化硅在高温下与碳酸钙反应:SiO2+CaCO3
高温
CaSiO3+CO2↑
高温
(6)二氧化硅在高温下与焦炭反反应制备粗硅:SiO2+2C(7)二氧化硅在高温下与碳反应制备碳化硅:SiO2+3C
Si+2CO↑
高温
SiC+2CO↑
5、制法:开发石英石
6、用途:建筑材料、耐火材料、生产玻璃、水泥、装饰品、光导纤维

三、硅酸
1、组成:化学式:H2SiO3
2、结构:晶体类型: 分子晶体 化学键:极性键 3、物理性质:白色胶状固体,不溶于水 4、化学性质:弱酸性,不稳定性
(1)硅酸与氢氧化钠溶液反应:H2SiO3+2NaOH===Na2SiO3+2H2O (2)加热硅酸:H2SiO3
△
SiO2+H2O
5、制法:(3)向硅酸钠溶液加入盐酸:Na2SiO3+2HCl===H2SiO3↓+2NaCl (4)向硅酸钠溶液通入足量的二氧化碳气体:
Na2SiO3+2CO2+2H2O===H2SiO3↓+2NaHCO3 6、用途:生产硅胶作吸附剂。 四、硅酸钠
1、组成:化学式:Na2SiO3 水溶液俗名:水玻璃
2、结构:晶体类型:离子晶体 化学键:离子键、极性键 3、物理性质:白色固体,易溶于水 4、化学性质:盐、水溶液呈碱性 (1)硅酸钠溶于水:Na2SiO3+2H2OH2SiO3+2NaOH
(2)硅酸钠溶液加入盐酸:Na2SiO3+2HCl===H2SiO3↓+2NaCl
(3)硅酸钠溶液通入少量的二氧化碳气体:Na2SiO3+CO2+H2O===H2SiO3↓+2Na2CO3 (4)硅酸钠溶液通入过量的二氧化碳气体:Na2SiO3+2CO2+2H2O===H2SiO3↓+2NaHCO3 (5)硅酸钠溶液与氯化铵溶液混合:Na2SiO3+NH4Cl===2NaCl+H2SiO3↓+NH3↑ 5、制法:(6)将二氧化硅与氢氧化钠共熔:SiO2+2NaOH
高温
Na2SiO3+H2O
6、用途:耐火材料,制备玻璃、黏合剂、生产硅胶
7、存在:硅在自然界主要以二氧化硅和硅酸盐形式存在。 五、硅酸盐工业的比较
1、半导体工业中,有一句行话:“从沙滩到用户”,即用SiO2制备Si。制取过程中不涉及的化学反应是( )
A、2C+SiO2高温 Si+2CO↑ B、SiO2+2NaOH===Na2SiO3+H2O
△
C、Si+2Cl2 △ 4 D、SiCl4+2H+4HCl
2、下列试剂中,能储存在带磨口塞的玻璃试剂瓶里的是( )
A、KOH溶液 B、液溴 C、Na2SiO3溶液 D、氢氟酸
3、下列说法正确的是( )
A、硅是人类将太阳能转变成电能的常用材料 B、工艺师利用盐酸刻蚀石英制作艺术品
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 D、硅酸盐都难溶于水
4、下列有关SiO2和CO2的叙述正确的是( )
A、两者都是酸性氧化物,故都不与酸反应 B、两者都可以与NaOH溶液反应
C、CO2的熔点、沸点比SiO2高 D、两者都能与水反应生成对应的酸
5、将足量的二氧化碳气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体是( )
A、Na2SiO3 B、Na2CO3、Na2SiO3 C、Na2CO3、SiO2、 D、SiO2
6、减缓温室气体排放是20xx年哥本哈根气候变化会议的议题,下列反应不产生温室气体的是( )
A、用纯碱制玻璃 B、用煤炭作燃料 C、用铁矿石炼铁 D、用氨制碳酸铵
7、诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A、二氧化硅是酸性氧化物,因此能和水反应生成硅酸
B、用二氧化硅制取单质硅时,当在标准状况下生成2.24L气体时,得到2.8g硅
C、6g二氧化硅中含有0.2mol的共价键
D、二氧化硅不能和碳酸钠溶液反应,但能和碳酸钠固体在高温时发生反应
8、绿柱石又称绿宝石,其主要成分是BenAl2Si6O18,则n为( )
A、1 B、2 C、3 D、4
9、下列有关碳和硅的叙述中,不正确的是( )
A、+4价的氧化物都能与氢氧化钠溶液反应 B、单质在加热的条件下都能和氧气反应
C、氧化物都能溶于水生成对应的酸 D、碳和硅两种元素都有能导电的单质
10、以下贮存物质的方法正确的是( )
A、少量白磷贮存在二硫化碳中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、少量钠贮存在酒精中 D、少量钠贮存在煤油中
11、以下说法正确的是( )
A、纳米材料是指一种称为“纳米”的新物质制成的材料
B、绿色食品是指不含任何化学物质的食品
C、生物固氮是指植物通过叶面直接吸收空气中的氮气
D、光导纤维是以二氧化硅为主要原料制成的
12、(1)二氧化碳是共价化合物,它的电子式可表示为
(2)实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,产
生的实验现象是
相应的反应方程式为 。
(3)在宇宙飞船和太空站上工作的宇航员,在密闭的工作舱内需要吸入氧气,呼出CO2,
飞船内可以使用一种物质,它能吸收CO2,并产生氧气,该物质是 , 其反应方程式为
13、某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒
温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体一定存在的是( )
A、HCl和CO B、HCl、H2和CO C、CH4和NH3 D、HCl、CO和CO2
14、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的
物质是( )
A、烧碱 B、纯碱 C、氢氟酸 D、盐酸
15、水泥工业与玻璃工业都要用到的原料是( )
A、纯碱 B、石灰石 C、石英 D、黏土
16、下列表述正确的是( )
①人造刚玉的熔点很高,可用作高级耐火材料,主要成分为二氧化硅
②化学家采用玛瑙研砵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 ③提前建成的三峡大坝使用了大量的水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛 ⑤太阳能电池可用硅材料制作,其应用有利于环保、节能
A、①②③ B、②④ C、③④⑤ D、③⑤
17、下列氧化物属于原子晶体的是( )
A、Al2O3 B、SiO2 C、P2O5 D、干冰
18、下列说法正确的是( )
A、二氧化硅材料广泛用于光纤通讯
B、工艺师利用盐酸刻蚀石英制作艺术品
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品;
D、粗硅制备单晶硅不涉及氧化还原反应
19、粗硅和金刚砂都是通过二氧化硅与焦炭在高温条件下反应制得,其反应的化学方程式如下:SiO2+2C
( )
A、两个反应中,二氧化硅都是氧化剂 B、两个反应中,焦炭都只是还原剂
C、硅和金刚砂都是原子晶体 D、两个反应都是置换反应
20、下列变化过程不能通过一步反应实现的是( )
A、SiO2→H2SiO3 B、SiO2→Na2SiO3 C、CO2→CO D、CO2→C 高温 Si+2CO↑ SiO2+3C高温 SiC+2CO↑,下列说法正确的是
第二篇:硅及其化合物练习
班级 座号 姓名
L12021 硅及其化合物
( )1.有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 B.自然界中存在大量的单质硅
C.硅燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
D.自然界的硅易开采,且可再生
( )2.下列表述正确的是
①人造刚玉的熔点很高,可用作高级耐火材料,主要成分是二氧化硅 ②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 ③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 ④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
高温( )3.对于化学方程式SiO2+3C=====SiC+2CO↑,有关叙述正确的是
A.反应中SiO2是氧化剂,C是还原剂 B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂 D.在反应中氧化剂与还原剂的物质的量之比为1∶1
( )4.下列离子方程式书写正确的是
--A.往NaOH中通入少量CO2:CO2+OH===HCO3B. Si与氢氟酸反应:Si+4HF===H2↑+SiF4↑
--C.石英砂与烧碱溶液反应制水玻璃:SiO2+2OH===SiO23+H2O
+-D.往水玻璃中通入二氧化碳:Na2SiO3+H2O+CO2===H2SiO3↓+2Na+CO23
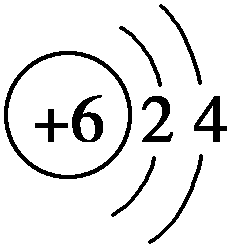
( )5.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是
A.用盐的形式表示:BaSiO3·CuSiO3 B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱 D.性质稳定,不易褪色
( )6.下列说法不正确的是
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成 ②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 ③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证
-明溶液中一定含有SO24 ④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,
在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.只有② B.①②③ C.①③④ D.①②③④
( ) 7. (2010·江苏,4)下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料 B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性 D.石油分馏可获得乙烯、丙烯和丁二烯
( )8.现有下列五个转化,其中不可能通过一步反应实现的是 ①SiO2―→Na2SiO3②CuSO4―→CuCl2③SiO2―→H2SiO3④CuO―→Cu(OH)2 ⑤Na2O2―→NaOH
A.①② B.③④ C.②③④ D.②③④⑤
( )9.金属镁在二氧化碳中燃烧生成MgO和C,将一定量金属镁在含二氧化碳、氧气的混合气体中燃烧后得到的固体,加入足量盐酸中,充分反应后,将溶液蒸干,然后隔绝空气灼烧,得到的固体成分可能是 A.MgO和Mg(OH)2 B.MgO C.MgCl2和C D.Mg(OH)2
( )10.下列关于无机非金属材料的说法中不正确的是
A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料
B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差
C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点
D.传统无机非金属材料和新型无机非金属材料的主要成分不同
11. (7分)根据锡、铅的主要化合价及其稳定性,完成下列填空:
(1)锡的+2价化合物应具有较强的________性,铅的+4价化合物应具有较强的________性。 2012届高三化学练习 1
(2)已知Sn2的还原性比Fe2的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
①氯气与锡共热:______________________;②氯气与铅共热:________________________; ③PbO2与浓盐酸共热:_______________________________________________。
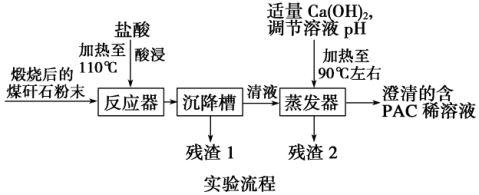
12. (9分)某实验室对煤矸石的综合利用课题展开如下探究:资料检索 ①煤矸石主要含Al2O3、SiO2及Fe2O3。②聚合氯化铝{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC}是一种新型、高效的絮凝剂和净水剂。探究思路 用煤矸石为原
料,采用铝盐水解絮凝法,可制得聚合氯化铝。
(1)用浓盐酸配20%的盐酸所需的玻璃仪器有:
_______________________________。
(2)加20%的盐酸酸浸,有关的离子方程式为
___________________________________。
(3)残渣2的主要成分是______________,设
计实验证明你的结论(填操作及现象):
__________________________________________________________________________。
(4)从澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是______________,得到PAC粗产品中可能含有的杂质离子是_____________________________________________。
(5)从不引入杂质去考虑,调节溶液的pH可改为________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
13. (11分)含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________________________________________________________,
A与B在原子的电子层结构上的相同点是_________________________________。
(2)易与C发生化学反应的酸是__________,反应的化学方程式是__________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学反应方程式:___________________ ______________。 ②要将纯碱高温熔化,下列坩埚中不可选用的是 ( )
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L, 100 g混合物中石灰石的质量分数是_______ ___。
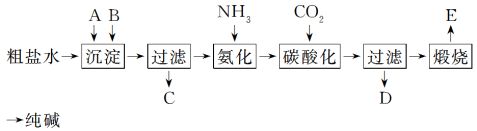
14. (13分)(2010·上海,27)工业生产纯碱的工艺流程示意图如下: (1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、
B的化学式:
A________,B__________。
(2)实验室提纯粗盐的实验操作依次为:
取样、________、沉淀、________、
________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________________________。 碳酸化时没有析出碳酸钠晶体,其原因是_____________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是______________________________________________________。
(5)氯碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为_________________________________________________。
滤液D加石灰水前先要加热,原因是__________________________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为____________________________________________。 ++
2012届高三化学练习
2
L1200.。。。。。。。。。。。参考答案
答案 1. B 2. D 3 C 4.C 5 C 6.C 7.D 8. B 9. B 10. B
11. (1)还原 氧化
(2)①Sn+2Cl2=====SnCl4
②Pb+Cl2=====PbCl2
③PbO2+4HCl(浓)=====PbCl2+Cl2↑+2H2O
12. (1)量筒、烧杯、玻璃棒
(2)Al2O3+6H===2Al3+3H2O、Fe2O3+6H===2Fe3+3H2O ++++△△△
(3)Fe(OH)3 取少量残渣2于小试管中,加入稀盐酸使其完全溶解,再加入KSCN溶液,溶液呈(血)红色
(4)蒸发浓缩,冷却结晶 Ca2 (5)BD +
13. (1)ⅣA 最外层均有4个电子
(2)氢氟酸 SiO2+4HF===SiF4↑+2H2O
(3)①SiO2+Na2CO3=====Na2SiO3+CO2↑,
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
②ABC (4)50%
14. (1)Ca(OH)2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤 (3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大 (4)NH4Cl 取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子 (5)NH4+OH=====NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀
84(m1-m2)(6)w(NaHCO3)=100%(m1为样品质量,m2为加热后剩余固体质量) 31m1
+-高温△
2012届高三化学练习 3
