一、硅及其化合物.
1、单质硅(Si):
(1)物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
(2)化学性质:
①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4 Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑ ②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
Si+O2高温 SiO2 Si+2Cl2高温 SiCl4
(3)用途:太阳能电池、计算机芯片以及半导体材料等。
(4)硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑ Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl
2、二氧化硅(SiO2):
(1)SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
(2)物理性质:熔点高,硬度大,不溶于水。
(3)化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:
①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
③高温下与碱性氧化物反应:SiO2+CaO高温
CaSiO3
(4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
3、硅酸(H2SiO3):
(1)物理性质:不溶于水的白色胶状物,能形成硅胶,吸附水分能力强。
(2)化学性质:H2SiO3是一种弱酸,酸性比碳酸还要弱,其酸酐为SiO2,但SiO2不溶于水,故不能直接由SiO2溶于水制得,而用可溶性硅酸盐与酸反应制取:(强酸制弱酸原理)
Na2SiO3+2HCl=2NaCl+H2SiO3↓
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(此方程式证明酸性:H2SiO3<H2CO3)
(3)用途:硅胶作干燥剂、催化剂的载体。
4、硅酸盐
硅酸盐:硅酸盐是由硅、氧、金属元素组成的化合物的总称。硅酸盐种类很多,大多数难溶于水,最常见的可溶性硅酸盐是Na2SiO3,Na2SiO3的水溶液俗称水玻璃,又称泡花碱,是一种无色粘稠的液体,可以作黏胶剂和木材防火剂。硅酸钠水溶液久置在空气中容易变质:
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓(有白色沉淀生成)
传统硅酸盐工业三大产品有:玻璃、陶瓷、水泥。
硅酸盐由于组成比较复杂,常用氧化物的形式表示:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:Na2SiO3 Na2O·SiO2 硅酸钙:CaSiO3 CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 Al2O3·2SiO2·2H2O
正长石:KAlSiO3不能写成 K2O· Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2.
第二篇:人教版化学必修1_第四章非金属及其化合物练习题
非金属及其化合物练习
可能用到的相对原子质量:H-1 N-14 Cu-64 O-16 S-32 C-12 Zn-65 Mg-24 一、选择题
1.常温下,下列溶液可以用铝槽车装运的是
A.氢氧化钠溶液 B.浓盐酸 C.浓硝酸 D.稀硝酸
2.物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1︰4 B.1︰5 C.2︰3 D.2︰5
3.(双选)某单质和足量浓硝酸反应时,每0.25 mol单质反应消耗1 mol HNO3,还原产物为
NO2,则单质氧化后的化合价可能是
A.+ 4
B.+ 3
C.+ 2
D.+ 1
4..现有下列试剂:①氯水 ②Br2水 ③碘水 ④O3 ⑤NO2 ⑥稀硝酸,其中能使淀粉碘化钾溶
液变蓝的是
A.①②⑥ B.④⑤ C.除③外 D.全部 5.下列关于硫的叙述中,正确的是
A.硫只以化合态存在于自然界中 B.硫是一种黄色、能溶于水的晶体 C.硫在空气中燃烧生成二氧化硫 D.硫在纯氧中燃烧生成三氧化硫 6.下列物质不能由单质之间的化合反应得到的是 ..
A. NO B.NO2 C.MgCl2 D.CuCl 2 7.为了除去镀在铝制品表面的铜镀层,可选用的试剂是
A.稀硝酸 B.浓硝酸 C.浓硫酸 8. 下列物质见光不会分解的是:
D.浓盐酸
A.NaHCO3 B.HNO3 C.AgI D.HClO 9. X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.ZY2的水溶液俗称“水玻璃” 10.有一种常见氮肥,加热可完全分解为气体,其中一种气体能使湿润的红色石蕊试纸变蓝, 另一种气体能使澄清石灰水变浑浊。取少量该氮肥溶于水,并加入少量CaCl2溶液,无 明显现象。由此可知该氮肥的主要成分是 A.NH4Cl B.NH4HCO3 C.NH4NO3 +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3- C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
12.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一 C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
13.0.03molCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
1
D.(NH4)2CO3
11.已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3-
A.504mL B.336mL C.224mL D.168mL
14.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
15.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
16.将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c 不可能是
A.1:1:1 B .2:1:1 C.3:7:4 D .1:5:2 17.在标准状况下,将O2与NO按3:4体积比充满一干燥烧瓶,将烧瓶倒置于水中,瓶中液面逐渐上升后,最终烧瓶内溶液的物质的量浓度最接近于
A.0.045 mol/L B.0.036 mol/L C.0.026 mol/L D.0.030 mol/L 18.某混合气体可能是CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水硫酸铜(变蓝)时,则可断定该混合气中一定有
A.HCl、CO2、H2 B.CO、H2、H2O C.CO、H2、NH3 D.HCl、CO、H2O 19.在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol/L和0.1 mol/L。向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )
A. 0.15 mol/L B. 0.225 mol/L C. 0.35 mol/L D. 0.45 mol/L 20. 向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
A.NaCl Na2SO4 B.NaCl NaBr Na2SO4 C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4 二、填空题
21. SO2气体具有 气味,密度比空气的________(填“大”或“小”), (填
“易”或“难”)溶于水。将SO2气体通入品红溶液,观察到的现象是 ,说明SO2具有 性。
22.资料显示:“氨气可在纯氧中安静燃烧??”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。

2
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 ; ②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因 (3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序 。 其理由是
②氨气燃烧的化学方程式是 。 23.有A、B、C三种无色纯净气体,可能分别是N2、NO、CO2、NH3、HCl中的一种。A气体能使湿润的红色石蕊试纸变蓝,将A气体和C气体混合后,产生白烟;B气体接触空气立即变为红棕色。
据此推断(写化学式):A是 、B是 、C是 。 24.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下图的反应(图中有些反应的产物和反应的条件没有全部标出)。
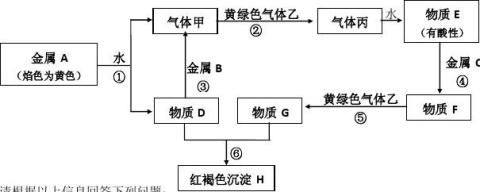
(1)写出下列物质化学式:A 、B 、C 、F 、H 、乙 。 (2)写出下列反应的化学方程式
反应① ; 反应⑤ 。 25. X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气), Y+Z→B(气)。 请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;②生成固体C的化学方程式是 。 (2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则: ①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ; ③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
3
26.实验室中常用加热氯化铵和氢氧化钙的混合物的方法制取氨气。
(1)请写出该反应的化学方程式 。
(2)请指出右图所示制取氨气装置的错误之处,并改正。
① ;
② ;
③ 。
(3)实验室制备下列气体的实验装置可与制氨气的装置相同的是 (填选项的字母)。
A.O2 B.CO2 C.H2
27.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中加入的物质是 ,
发生反应的化学方程式是 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(4)实验时在D中观察到得现象是 ,D中收集到的物质是 ,检验该物质的
方法和现象是 。
四、计算题
28. 浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况)。计算:
(1)反应后生成硫酸铜的物质的量。
(2)若将反应后的溶液稀释至500mL,计算该溶液中硫酸铜的物质的量浓度。
29. 在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经硫酸酸化的KI溶液,发生如下反
应:
溶液滴定,、,反应完全后,用0.1 mol/L的Na2S2O3,消耗了40 mL Na2S2O3溶液,计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的密度为1.0 g/cm3,室温时Cu(IO3)2的溶解度是多少?
4
