20##-2012学年上学期高一化学必修1
第三章金属及其化合物的单元总结
一. 教学内容:
第三章金属及其化合物的单元总结
二. 重点、难点
1. 对几种常见金属的化学性质进行归纳总结,掌握金属的化学性质的共性和特殊性。
2. 把本章元素化合物的知识和前两章的知识有机的结合。
三. 具体内容
第三章讲述了关于金属元素的相关知识,主要有Na、Al、Fe、Cu四种元素。
本章涉及的知识点主要涉及六点:
(一)钠单质及其化合物
1. 钠的单质
钠与氧气的反应:常温和加热两种情况
钠与水反应:现象、反应、说明的问题
钠和氯气、硫的反应
2. 钠的化合物
氧化钠和过氧化钠的性质比较
碳酸钠和碳酸氢钠的性质比较
(二)铝单质及其化合物
1. 铝单质
铝和氧气反应
铝和酸反应
铝和碱反应
2. 铝的化合物
氧化铝和氢氧化铝的两性
(三)铁单质及其化合物
1. 铁单质
铁和水的反应
2. 铁的化合物
几种铁的氧化物的比较
几种铁盐的比较
(四)焰色反应
(五)金属材料
常见金属材料的性质和应用
(六)有关物质的量的运算
【典型例题】
[例1] 等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A. 第一块钠失去电子多 B. 两块钠失去电子一样多
C. 第二块钠的反应产物质量最大 D. 两块钠的反应产物质量一样大
答案:B
解析:掌握钠在不同条件下反应的不同和氧化还原反应的判断。
[例2] 通常采用将钠与亚硝酸钠(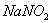 )在空气中共热的方法制取氧化钠,反应的另一产物为
)在空气中共热的方法制取氧化钠,反应的另一产物为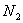 ,则该反应的化学方程式为_______________,该反应的氧化剂是________,被氧化的元素是____。试说明为什么不采用钠在氧气中燃烧的方法而采用此法制取氧化钠的原因_________________。
,则该反应的化学方程式为_______________,该反应的氧化剂是________,被氧化的元素是____。试说明为什么不采用钠在氧气中燃烧的方法而采用此法制取氧化钠的原因_________________。
答案: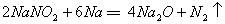 ;亚硝酸钠;钠元素;钠在氧气中燃烧会生成过氧化钠,不能得到氧化钠。采用亚硝酸钠与钠在空气中共热制取氧化钠时,由于反应产物中有了氮气,隔绝了生成的氧化钠与空气中氧气的接触,氧化钠不能被氧气进一步氧化,故可得到较纯的氧化钠。
;亚硝酸钠;钠元素;钠在氧气中燃烧会生成过氧化钠,不能得到氧化钠。采用亚硝酸钠与钠在空气中共热制取氧化钠时,由于反应产物中有了氮气,隔绝了生成的氧化钠与空气中氧气的接触,氧化钠不能被氧气进一步氧化,故可得到较纯的氧化钠。
解析:学会根据信息和所学知识结合来解题。
[例3] 钠在高温条件下能与氢气化合成白色NaH,反应的化学方程式为_____________,其中氧化剂为______________。NaH有较强的还原性,因此可用氢化钠在高温下将四氯化钛 还原成钛,写出该反应的化学方程式____________;NaH能与水剧烈反应:
还原成钛,写出该反应的化学方程式____________;NaH能与水剧烈反应: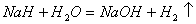 ,NaH与液氨
,NaH与液氨 也有类似反应,写出反应的化学方程式______________。
也有类似反应,写出反应的化学方程式______________。
答案: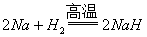 ,氢气
,氢气
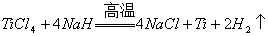 (
(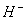 被氧化成单质
被氧化成单质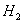 )
)
 (NaH中的
(NaH中的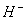 结合一个+1价的氢原子形成一个
结合一个+1价的氢原子形成一个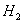 分子)
分子)
解析:利用题中所给生成物写反应,并注意对比反应的相似性。
[例4] 现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水)。

请填写下列空白:
(1)写出在实验中Na2O2和Na2O分别发生反应的化学方程式_______,____。
(2)应选用的装置是(只要求写出图中装置的标号)____。
(3)所选用装置的连接顺序应是(填各接口的字母,连接胶管省略)______。
答案:(1)2Na2O2 +2 CO2 =2Na2 CO3 + O2 Na2O + CO2 == Na2 CO3 (2)⑤⑥⑦①④(3)GHIJKABF
解析:对比钠的两种氧化物与二氧化碳反应的不同点。
[例5] 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”,请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”,实验中必须使用普通铁粉、6mol·L-1盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
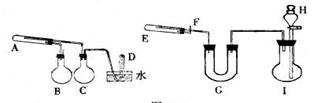
填写下列空白:
(1)实验进行时试管A中应加入的试剂是 ,烧瓶B的作用是 ;烧瓶C的作用是 ,在试管D中收集得到的是 。
(2)实验时,U型管G中应加入的试剂是 , 分液漏斗H中应加入 。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应字母) 。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是 。
(5)试管E中发生反应的化学方程式是 。
(6)为了安全,在E管中的反应发生前,在F出口处必须 ;E管中反应开始后,在F出口处应 。
答案:
(1)普通铁粉;作为水蒸气发生器;防止水倒吸;氢气。
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂);6mol·L-1HCl
(3)A、B、E
(4)加快氢气产生的速度
(5)
(6)检验氢气的纯度;点燃氢气
解析:从该实验的正反两个方面来探究铁的性质。
[例6] 用下面两种方法可以制得白色的 沉淀。
沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色 沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
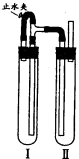
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的 沉淀能较长时间保持白色,其理由是 。
沉淀能较长时间保持白色,其理由是 。
答案:
方法一:
(1)稀H2SO4、铁屑
(2)煮沸
(3)避免生成的 沉淀接触O2
沉淀接触O2
方法二:
(1)稀H2SO4;铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,避免了 的迅速氧化。
的迅速氧化。
解析:在实验中应用氧化还原的原理和思路。
[例7] 相同质量的钠在下列情况中,产生氢气最多的是( )
A. 放在足量水中 B. 放在足量盐酸中
C. 放在足量硫酸铜溶液中 D. 用刺有小孔的铝包好放入足量水中
答案:D
解析:从得失电子守恒的角度判断,同时注意实验中所使用的用品。
[例8] 下列物质之间能够发生如图所示的化学反应,合金由两种金属组成,取C溶液进行焰色反应则火焰呈黄色。在反应中产生的水均未在图中标出。
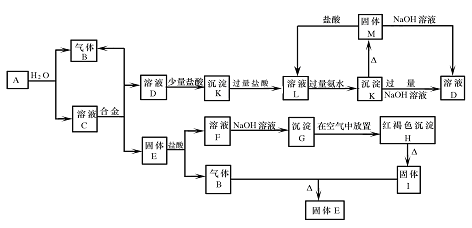
(1)写出下列物质的化学式:A: M: H:
(2)写出下列反应的化学方程式,并标出电子转移情况:
GH:
(3)写出下列反应的离子方程式:
AB+C:
KD:
答案:(1)A:Na M:Al2O3 H:Fe(OH)3
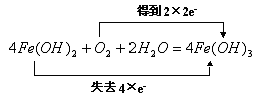
(2)
(3)A B+C:2Na+2H2O=2Na++2OH-+H2↑
KD: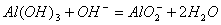
解析:会各种元素化合物知识的综合运用。
【模拟试题】(答题时间:30分钟)
1. 铝在空气中能够稳定存在的原因是( )
A. 铝的活泼性差 B. 铝的还原性差
C. 铝与氧气不反应 D. 铝表面有致密的氧化膜
2. 只用下列试剂中的一种就能将FeCl3、FeCl2、AlCl3和NaCl四种溶液区别开的是( )
A. KSCN溶液 B. BaCl2溶液 C. NaOH溶液 D. AgNO3溶液
3. 除去FeCl2溶液中少量的FeCl3,最好的办法是( )
A. 加入氢氧化钠溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
4. 下列关于钠的叙述中,正确的是( )
A. 钠在自然界中存在游离态 B. 钠是一种灰色的固体
C. 钠可以保存在煤油或CCl4中 D. 钠着火时可以用沙土扑灭
5. 钠用在电光源上做高压钠灯,这是因为( )
A. 钠的还原性强 B. 钠燃烧时发出黄色火焰
C. 高压钠灯发出的黄光射程远,透雾力强 D. 金属钠的导电性良好
6.“神州号”载人航天器内,宇航员乘坐的轨道舱和返回舱都是密封的,为了保证宇航员在呼吸过程中氧气的适当比例, 需要在航天舱内放入( )
A. Na2O2 B. Na2CO3 C. NaOH D. 氧气瓶
7. 少量的金属钠长期暴露在空气中,它的最终产物是( )
A. NaOH B. Na2CO3?10H2O C. Na2CO3 D. NaHCO3
8. 有关铁与水反应的说法中,正确的是( )
A. 在任何条件下,铁与水均不发生反应。
B. 在高温时,铁与水蒸气反应生成氢氧化铁和氢气。
C. 在高温时,铁与水蒸气反应生成氧化铁和氢气。
D. 在高温时,铁与水蒸气反应生成四氧化三铁和氢气
9. 请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
 10. 关于反应:2Na+Cl2点燃 2NaCl的说法正确的是( )
10. 关于反应:2Na+Cl2点燃 2NaCl的说法正确的是( )
A. Na是还原剂,Cl2是氧化剂,NaCl只是氧化产物。
B. 通过加热可由NaCl制备Na和Cl2。
C. 反应中Cl2失去电子
D. 该反应过程中放热
11. 分别向下列物质的水溶液中加入少量的过氧化钠固体,不会出现浑浊的是( )
A. 氯化镁溶液 B. 碳酸氢钙溶液
C. 饱和氢氧化钙溶液 D. 饱和碳酸氢钠溶液
12. 把碳酸氢钠溶液滴入下列溶液中,能反应并放出气体的是( )
A. NaOH溶液 B. 澄清石灰水 C. NaHSO4溶液 D. HNO3溶液
【试题答案】
1. D 2. C 3. D 4. D 5. C 6. A 7. C 8. D
9. 方法一:可以使用NaOH溶液洗涤混合物,铁与NaOH溶液不发生反应,而Al可溶于NaOH溶液。2Al+2NaOH+2H2O 2NaAlO2+3H2↑,经过滤、洗涤可以得到铁。
2NaAlO2+3H2↑,经过滤、洗涤可以得到铁。
方法二:可以使用磁铁将混合物中的铁吸引出来而留下杂质铝。
方法三:向混合物中加FeCl2溶液,Al与FeCl2反应:2A1+3FeCl2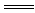 3Fe+2AlCl3,用水洗涤并干燥。
3Fe+2AlCl3,用水洗涤并干燥。
10. D 11. D 12. CD
【试题解析】
2. 分别出现红褐色沉淀、白色沉淀再转化为红褐色沉淀、白色沉淀、无现象。
3. A的方法影响主要物质;B把主要物质除去了;C引入了新杂质。
4. A因为钠的化学性质活泼,所以没有以游离态存在的;B颜色是银白色;C因为钠的密度小于CCl4的密度,所以浮在其上面,仍然能和氧气反应,所以不能保存在其中。
6. 利用过氧化钠和二氧化碳的反应。
7. 考虑钠氧化生成氧化钠,再和水反应生成氢氧化钠,再和二氧化碳反应生成碳酸钠晶体;晶体再风化。
10. NaCl既是氧化产物,又是还原产物;应是电解的方法;Cl2是氧化剂,得到电子。
11. 过氧化钠与水反应生成氢氧化钠,氢氧根离子遇镁离子生成氢氧化镁沉淀;遇碳酸氢根生成碳酸根离子,和钙离子沉淀;饱和溶液被过氧化钠消耗了水,溶质析出。
12. 碳酸氢根离子遇氢离子生成二氧化碳气体。
第二篇:超详细必修一化学第三章金属及其化合物化学方程式总结
第三章 金属及其化合物方程式总结
----------加粗的是对应的离子方程式
1.金属钠的化学性质:
钠露置空气中变暗:4Na+O2=2Na2O(白色)
钠的燃烧:2Na+O2Na2O2(淡黄色)
钠投入水中:2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH–+H2↑
(现象:浮、融、游、响、红)
钠与盐酸(先酸后水):2Na+ 2HCl===2NaCl+H2↑ 2Na+ 2H+===2Na++H2↑
钠与硫酸铜溶液(先水后盐):2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(总式)
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2.氧化钠的化学性质:
氧化钠与水:Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH–
氧化钠与二氧化碳:Na2O+CO2=Na2CO3
氧化钠与盐酸:Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O
3.过氧化钠的化学性质(漂白性、强氧化性):
过氧化钠与水:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH–+O2
过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2
4.碳酸钠与碳酸氢钠的化学性质:
溶解性的的比较:Na2CO3>NaHCO3
碱性的比较:Na2CO3> NaHCO3
热稳定性的比较:Na2CO3>NaHCO3
Na2CO3+H2O+CO2↑ 碳酸氢钠受热分解:2NaHCO3
碳酸钠与酸的反应:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-
Na2CO3+2HCl =2NaCl+H2O+CO2↑ CO32–+ 2H+=CO2↑+H2O
碳酸氢钠与酸的反应:NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=CO2↑+H2O 碳酸钠转换成碳酸氢钠(Na2CO3→NaHCO3):
通入CO2:Na2CO3+H2O+CO2=2NaHCO3 CO32–+H2O+CO2=2HCO3-
加入适量稀盐酸:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-
碳酸氢钠转换成碳酸钠(NaHCO3→Na2CO3):
碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)
加入适量氢氧化钠:NaHCO3+NaOH= Na2CO3 + H2O HCO3-+OH-=CO32–+H2O
5.金属铝的化学性质:
铝在空气中常温或加热条件下都生成致密的氧化膜: 4Al+3O2=2Al2O3
铝与稀盐酸的反应:2Al+6HCl===2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
铝与氢氧化钠的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH–+2H2O=2AlO2–+3H2↑
注意:1.等质量的或等物质的量的铝与足量稀盐酸或氢氧化钠反应产生的氢气的量是相等的
2.反应刚开始比较慢,是因为铝表面致密的氧化膜(Al2O3)
3.因为铝既可与盐酸反应又可与氢氧化钠反应生成盐和氢气,所以我们说Al是两性金属。
6.氧化铝的化学性质:(物理性质:难溶于水,熔点高,硬度大)
氧化铝与稀盐酸的反应: Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O 氧化铝与氢氧化钠的反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH–=2AlO2―+H2O
注意:因为氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以我
们说Al2O3是两性氧化物。
7.氢氧化铝的化学性质:
氢氧化铝的制取:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4 )2SO4 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 氢氧化铝与稀盐酸的反应:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O 氢氧化铝与氢氧化钠的反应:Al(OH)3+ NaOH =NaAlO2+2H2O Al(OH)3+ OH– =AlO2–+2H2O
注意:因为氢氧化铝既可与盐酸反应生成盐和水,又可与氢氧化钠反应生成盐和水,所以
我们说Al(OH)3是两性氢氧化物。
氢氧化铝溶解性差,热稳定性也不好,受热易分解:2Al(OH)3
8.金属铁的化学性质:
铁与水蒸气在加热条件的反应:3Fe+4H2O(g)
铁在氧气中燃烧:3Fe+ 2O2Fe3O4 Fe3O4+4H2 Al2O3+3H2O
铁与酸的反应:Fe+2HCl = FeCl2+H2↑ Fe+2H+= Fe 2++H2↑
铁的还原:Fe2O3+3CO=2Fe+3CO2(条件是高温)
铁与盐的反应:Fe+CuSO4=FeSO4+Cu Fe+Cu2+=Fe2++Cu
9.铁的氧化物的化学性质:
常见的铁的氧化物有:氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4)
氧化亚铁与盐酸的反应:FeO+2HCl=FeCl2+H2O FeO+2H+=Fe2++H2O
氧化铁与盐酸的反应:Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O
四氧化三铁与盐酸的反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O Fe3O4+8H+=2Fe3++Fe2++4H2O
10.铁的氢氧化物的化学性质:
—氢氧化亚铁的制取:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 Fe2+ + 2OH = Fe(OH)2↓
现象:先有白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
Fe(OH)2沉淀变色的方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3
—氢氧化铁的制取:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe3+ + 3OH = Fe(OH)3↓
现象:迅速产生红褐色沉淀。
氢氧化亚铁与酸的反应:Fe(OH)2 + 2HCl = FeCl2 + 2H2O Fe(OH)2 + 2H+= Fe2+ + 2H2O 氢氧化铁与酸的反应: Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 + 3H+= Fe3+ + 3H2O
氢氧化铁溶解性差,热稳定性也不好,受热易分解:2Fe(OH)3Fe2O3+3H2O
11.Fe2+ 与Fe3+之间的相互转化与鉴定:
三价铁离子(Fe3+)的鉴定:往溶液中滴入几滴KSCN溶液,溶液迅速变成红色;而二价铁(Fe2+)
则无任何现象,所涉及的方程式(了解):Fe3+ + 3SCN- =Fe(SCN)3
三价铁转化为二价铁(Fe3 →+Fe2+):三价铁自身是强氧化剂,遇较强还原剂会被还原成二价铁。
氯化铁与铜的反应:FeCl3+Cu=2FeCl2+CuCl2 (用于溶解铜线路版) 2Fe3++Cu=2Fe2++Cu2+ 氯化铁与铁粉的反应: 2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+
二价铁转化为三价铁(Fe2+ →Fe3+):二价铁自身是强还原剂,遇较强氧化剂会被氧化成三价铁。
氯化亚铁溶液中通入氯气:2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl-
所以Fe2+ 、Fe3+在一定条件下是可以相互转化的。
12.重点:过量问题
二氧化碳与氢氧化钠的反应:
CO2+2NaOH(过量)=Na2CO3+H2O ① 2OH–+CO2=CO32–+H2O
Na2CO3+H2O+CO2=2NaHCO3 ②中间反应 CO32–+H2O+CO2=2HCO3 -
CO2(过量)+NaOH=NaHCO3 (①式+②式) OH–+CO2=HCO3–
二氧化碳与氢氧化钙的反应:先生成沉淀,后沉淀消失。
CO2+Ca(OH)2(过量)=CaCO3↓+H2O① Ca2++2 OH–+CO2=CaCO3↓+H2O
CaCO3+CO2+ H2O=Ca(HCO3)2②中间反应 CaCO3+CO2+ H2O=Ca2++2HCO3–
2CO2(过量)+ Ca(OH)2=Ca(HCO3)2(①式+②式) OH–+CO2=HCO3–
碳酸钠与酸的反应:
Na2CO3(过量)+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-
Na2CO3+2HCl(过量) =2NaCl+H2O+CO2↑ CO32–+ 2H+=CO2↑+H2O
氯化铝与氢氧化钠的反应:先生成沉淀,后沉淀消失。
3NaOH+AlCl3(过量) =Al(OH)3↓+3NaCl ① 3OH–+Al3+=Al(OH)3↓
NaOH+Al(OH)3=NaAlO2+2H2O ②中间反应 OH–+Al(OH)3=AlO2–+2H2O 4NaOH(过量)+AlCl3 =NaAlO2+2H2O+3NaCl(①式+②式) 4OH–+Al3+=AlO2–+2H2O
偏铝酸钠与盐酸的反应:先生成沉淀,后沉淀消失。
NaAlO2(过量)+HCl+H2O = Al(OH)3↓+NaCl ① AlO2–+H++H2O=Al(OH)3↓
Al(OH)3+3HCl=AlCl3+3H2O②中间反应 Al(OH)3+3H+=Al3++3H2O
NaAlO2+4HCl(过量) =AlCl3+NaCl +2H2O(①式+②式) AlO2–+4H+=Al3++2H2O
附1:(了解,额外的重点~~~)
二氧化碳与偏铝酸钠的反应:
CO2(不足)+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 CO2+3H2O+2AlO2–=2Al(OH)3↓+CO32– CO2(足量)+NaAlO2+2H2O=Al(OH)3↓+NaHCO3 CO2+2H2O+AlO2–=Al(OH)3↓+HCO3–
氯化铝与偏铝酸钠的双水解反应:
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl 3AlO2-+Al3++6H2O=4Al(OH)3↓
附2:金属及其化合物之间的相互转化:
1、钠及其重要化合物之间的转化关系,写出相应的化学反应方程式:
3 ④
2、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式:
3
3
、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式:
Fe3O3⑩
4、金属钠(Na)在空气中长时间放置的变质过程:
