
第二篇:高一化学之八 非金属化合物(3)知识点总结
7-20 非金属化合物(3)
一、氧族元素(硫)
①硫单质
⑴游离态的硫主要存在于火山喷口附近或地壳的岩层里。
⑵物理性质:俗称硫磺。淡黄色固体,难溶于水,可溶于______,易溶于___________。
⑶化学性质:氧化性:铁和硫共热:
还原性:硫燃烧:
 和碱反应:3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
和碱反应:3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
⑷应用:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药
水银打破了怎么处理?方程式:
②二氧化硫
⑴物理性质:无色,有刺激性气味的有毒气体,密度大于空气,容易液化,易溶于水
探究易溶于水?在一个充满二氧化硫的矿泉水瓶中充入五分之一体积的水,扭紧瓶盖震荡的现象是?
⑵化学性质(酸性氧化物):
⒈溶于水:(注意可逆) 亚硫酸是中强酸
⒉和碱反应:(NaOH)注意量的问题!
⒊还原性:①与卤素反应:(氯气)
和碘呢?
②使酸性高锰酸钾褪色
③被氧气氧化(注意条件):
⒋氧化性:和硫化氢反应(归中不交叉):
⒌漂白性(注意书本P90实验4-7):
①属于什么类型的漂白?化合生成无色物质,加热分解
②二氧化硫又可用于杀菌,消毒
⒍实验室制法:Na2SO3 (固)+ H2SO4(浓) == Na2SO3 + H2O +SO2↑
③三氧化硫
⑴物理性质:沸点40℃,常温下不为气体,标准状况是固体!
判断:标准状况下,22.4L的三氧化硫里面的分子数是NA
⑵化学性质:⒈和碱性氧化物反应(CaO):
⒉和碱反应(NaOH、Ca(OH)2):
⒊制备硫酸的方法:①
②
④硫化氢
⑴物理性质:无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
 ⑵化学性质:①燃烧(注意氧气量)2H2S+O2 点燃 2S+2H2O(H2S过量)
⑵化学性质:①燃烧(注意氧气量)2H2S+O2 点燃 2S+2H2O(H2S过量)
 2H2S+3O2 点燃 2SO2+2H2O(O2过量)
2H2S+3O2 点燃 2SO2+2H2O(O2过量)
⑶强还原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S氧化。
⑷H2S的水溶液叫氢硫酸,是二元弱酸
⑤硫酸
⑴物理性质:纯硫酸是一种无色无味油状液体。常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为1.84g·cm-3,其物质的量浓度为18.4mol·L-1。硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。浓硫酸溶解时放出大量的热,因此浓硫酸稀释时应该“酸入水,沿器壁,慢慢倒,不断搅。 巧记:浓硫酸跳水要自杀,快拿玻璃帮救救他~
⑵吸水性
将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。
⑶脱水性(注意P101的实验)
向蔗糖中加入浓硫酸的现象:
生成的气体中有?为什么?反应方程式:
设计一实验,证明浓硫酸与碳反应的生成物含有水、二氧化硫和二氧化碳:
备选材料:碱石灰,无水硫酸铜,高锰酸钾溶液,品红溶液,澄清石灰水
所谓脱水性是浓硫酸以水中氢氧原子的比例在有机物或含结晶水物质中脱去氢氧元素
⑷强酸性:和氯化钠固体(制备氯化氢):
和硝酸钠固体(制备硝酸):
⑸强氧化性:和铜反应:
和碳反应:
⑥硫酸根的鉴定
SO42—的鉴定(干扰离子可能有:CO32-、SO32-、SiO32-、Ag+等):
待测液 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子)
⑦氧族元素比较
原子半径 O<S<Se<Te
单质氧化性 O2>S>Se>Te
单质颜色 无色 淡黄色 灰色 银白色
单质状态 气体 固体 固体 固体
氢化物稳定性 H2O>H2S>H2Se>H2Te
最高价含氧酸酸性 H2SO4>H2SeO4>H2TeO4
二、氮族元素(氮)
①氮的固定
工业人工固氮:
天然固氮:
②一氧化氮和二氧化氮
⒈氮气和氧气反应:
⒉二氧化氮的物理性质:红棕色、与刺激性气味的有毒气体,密度大于空气,易液化,易溶于水
⒊NO和NO2分别与O2以一定比例溶于水:
③氨
⑴物理性质:无色,有刺激性气味,极易溶于水且溶解得很快
⑵氨气溶于水的反应:
一水合氨的不稳定性:
注意P97实验4-8喷泉实验:
生成氨水的物质的量浓度是(计算)?
氨水显碱性的原因(资料卡片):
⑶氨气和酸反应:
⑷铵盐的反应①氯化铵的分解:
②碳酸氢铵的分解:
③硝酸铵与碱反应:
硝铵结块不能用铁锤敲开:爆炸
性质:易溶于水,受热易分解,与碱反应放出氨气
⑸由氮气制备硝酸的一系列过程(P99)
①氮气的固定:
②氨气催化氧化:
③一氧化氮的氧化:
④二氧化氮溶于水:
⑹氨的实验室制法(注意P99的图):
方程式:
为什么不用氢氧化钠?
实验装置棉花的位置?
检验氨气?① ②
装置:固-固加热装置,向下排空气法
干燥氨气:碱石灰
⑥硝酸
⑴物理性质:纯硝酸无色,有刺激性气味,可溶于水,易挥发,密度比水大
⑵硝酸的化学性质 ①与金属反应
铜和浓硝酸:反应激烈,产生红棕色气体,溶液由无色变为蓝绿色。
方程式:
铜和稀硝酸:反应较缓慢,产生无色气体,逸至试管口变为红棕色, 溶液由无色变为蓝绿色。方程式:
了解:
酸雨的形成是一个十分复杂的大气化学和大气物理过程。酸雨中含有硫酸和硝酸等酸性物质,其中又以硫酸为主。从污染源排放出来的SO2、NOx(NO、NO2)是酸雨形成的主要起始物,因为大气中的SO2在光照、烟尘中的金属氧化物等的作用下,经氧化、溶于水等方式形成H2SO4,而NO被空气中氧气氧化为NO2,NO2直接溶于水形成HNO3,造成了雨水pH值降低,便形成了酸雨。
硫酸型酸雨的形成过程为:气相反应:2SO2+O2=2SO3、SO3+H2O=H2SO4;液相反应:SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。总反应: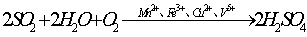
硝酸型酸雨的形成过程为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。
引起硫酸型酸雨的SO2人为排放主要是化石燃料的燃烧、工业尾气的排放、土法炼硫等。引起硝酸型酸雨的NOx人为排放主要是机动车尾气排放。
酸雨危害:①直接引起人的呼吸系统疾病;②使土壤酸化,损坏森林;③腐蚀建筑结构、工业装备,电信电缆等。
【化学实验基础知识总结4】高中化学实验中棉花和温度计的作用
棉花:
①用KMnO4分解制取O2:在加热的试管管口堵一团棉花,防止反应生成的O2把KMnO4粉末带出而堵塞导气管;
②实验室收集氨气:在收集氨气的试管口塞一团棉花,目的是减少对流,增大氨气的浓度;
温度计:
①实验室中制取乙烯:温度计水银球插入液面以下;
②石油的分馏和蒸馏实验:水银球与蒸馏烧瓶支管口相平;
③硝酸钾溶解度的测定:温度计插入硝酸钾溶液中;
④控制50℃~60℃的水浴制取硝基苯:温度计插入水浴中。
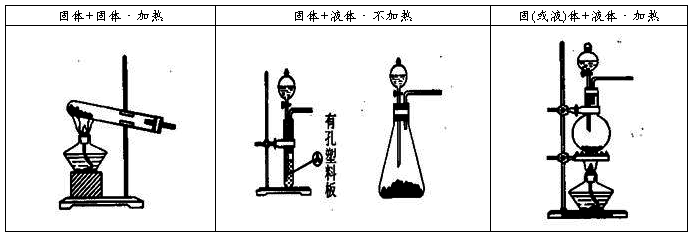
【化学实验基础知识总结5】常用气体发生装置
【化学实验基础知识总结6】高中常见干燥剂
干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。常用装置有干燥管(内装固体干燥剂)、洗气瓶(内装液体干燥剂)。
所选用的干燥剂不能与所要保留的气体发生反应。常用干燥剂及可被干燥的气体如下:
①浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2等(不可干燥还原性或碱性气体)。
②P2O5(酸性干燥剂):可干燥H2S、HBr、HI及浓硫酸能干燥的气体(不可干燥NH3等)。
③无水CaCl2:(中性干燥剂):可干燥除NH3以外的其他气体(NH3能与CaCl2反应生成络合物CaCl2·8NH3)。
④碱石灰(碱性干燥剂):可干燥。
⑤硅胶(酸性干燥剂):可干燥Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其他极性分子,只能干燥非极性分子气体)。
⑥其他:如生石灰、NaOH也可用于干燥NH3及中性气体(不可干燥有酸性或能与之作用的气体)。
