元素化合物知识总结
一、写出下列主族元素的元素符号和名称:
1、碱金属元素:
2、卤族元素:
3、氧族元素:
4、碳族元素:
5、氮族元素:
二、按要求填空
1、写出下列物质的电子式、结构式,并判断分子的极性 氯气 氮气
过氧化氢 甲烷
氨气 水
氟化氢 二氧化碳
2、写出下列物质的电子式
氯化钠 氯化镁
氧化钠 过氧化钠
氧化钙 氢氧化钠
氢氧化钙 氯化铵
3、用电子式表示下列物质的形成过程
溴化镁
硫化氢
四氯化碳
4、用氧化物的形式表示下列硅酸盐
Na2SiO3 CaSiO3
Mg2SiO4 KAlSi3O8
Al2(Si2O5)(OH)4 CaMg3(SiO3)4
三、 写出下列反应的化学方程式,是离子反应的写出离子方程式
(一)碱金属
1、 新切开的钠在空气中放置表面很快变暗
2、 钠在空气中燃烧
3、 钠与硫混合后爆炸
4、 钠在氯气中燃烧
5、 钠与水反应
6、 钠与硫酸铜溶液的反应
7、 钠与四氯化钛在700~~8000C条件下发生反应
8、 氧化钠溶于水
9、过氧化钠溶于水
…… …… 余下全文




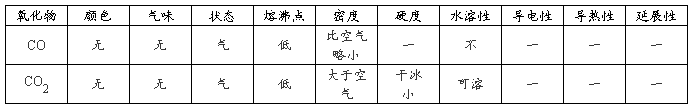
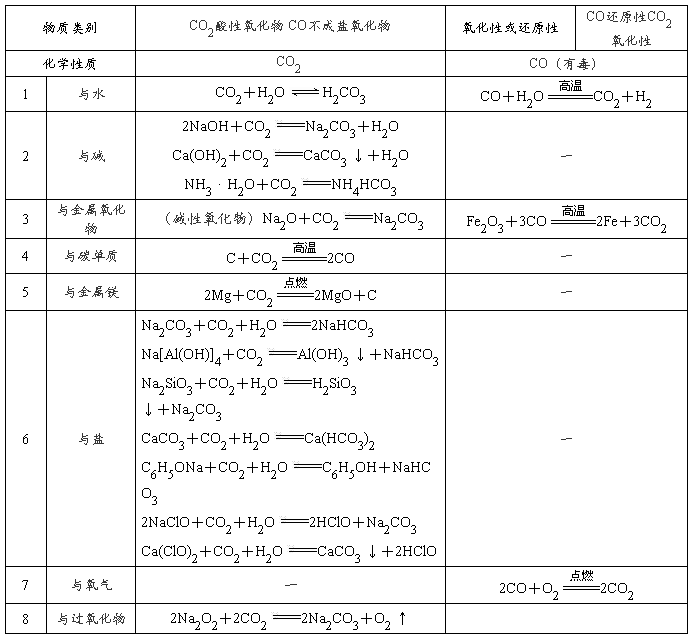
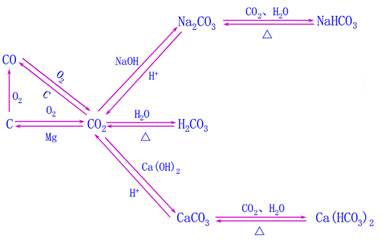
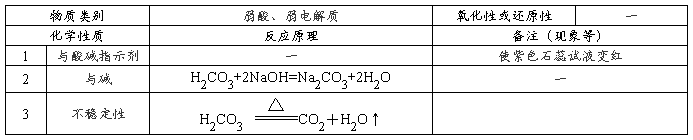
 CaO+CO2 ↑;CO:C+H2O
CaO+CO2 ↑;CO:C+H2O

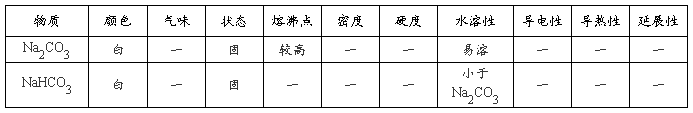

 NH4HCO3 NH4HCO3+NaCl(饱和)
NH4HCO3 NH4HCO3+NaCl(饱和)  Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑