元素周期律
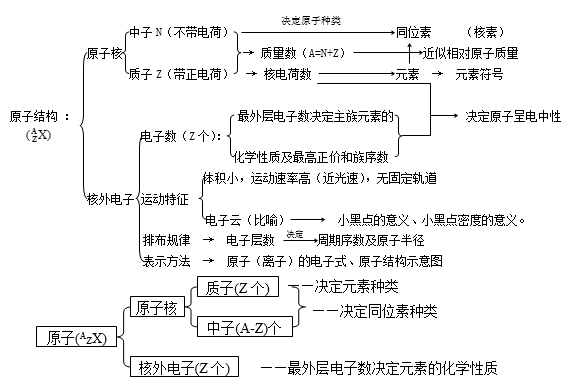
1.微粒间数目关系
质子数(Z)= 核电荷数 = 原子数序
原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。
质量数(A)= 质子数(Z)+ 中子数(N)
中性原子:质子数 = 核外电子数
阳 离 子:质子数 = 核外电子数 + 所带电荷数
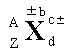 阴 离 子:质子数 = 核外电子数 - 所带电荷数
阴 离 子:质子数 = 核外电子数 - 所带电荷数
2.原子表达式及其含义
A 表示X原子的质量数;Z 表示元素X的质子数; d 表示微粒中X原子的个数;c± 表示微粒所带的电荷数;±b 表示微粒中X元素的化合价。
3.原子结构的特殊性(1~18号元素)
1.原子核中没有中子的原子:1 1H。
2.最外层电子数与次外层电子数的倍数关系。①最外层电子数与次外层电子数相等:4Be、18Ar; ②最外层电子数是次外层电子数2倍:6C;③最外层电子数是次外层电子数3倍:8O;④最外层电子数是次外层电子数4倍:10Ne;⑤最外层电子数是次外层电子数1/2倍:3Li、14Si。
3.电子层数与最外层电子数相等:1H、4Be、13Al。
4.电子总数为最外层电子数2倍:4Be。
5.次外层电子数为最外层电子数2倍:3Li、14Si
6.内层电子总数是最外层电子数2倍:3Li、15P。
4.1~20号元素组成的微粒的结构特点
(1).常见的等电子体
①2个电子的微粒。分子:He、H2;离子:Li+、H-、Be2+。
②10个电子的微粒。分子:Ne、HF、H2O、NH3、CH4;离子:Na+、 Mg2+、Al3+、
…… …… 余下全文



 元素周期表的结构
元素周期表的结构


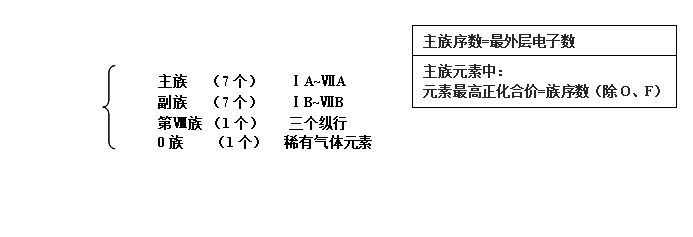
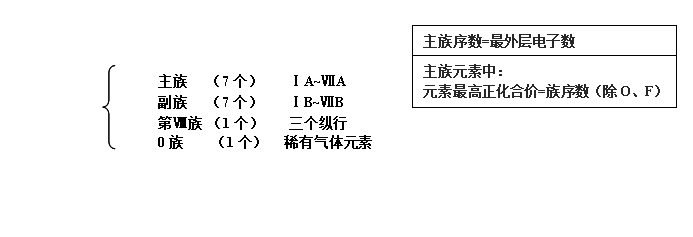
 族
族



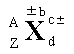 阴 离 子:质子数 = 核外电子数 - 所带电荷数
阴 离 子:质子数 = 核外电子数 - 所带电荷数

 元素周期表的结构
元素周期表的结构


 族
族
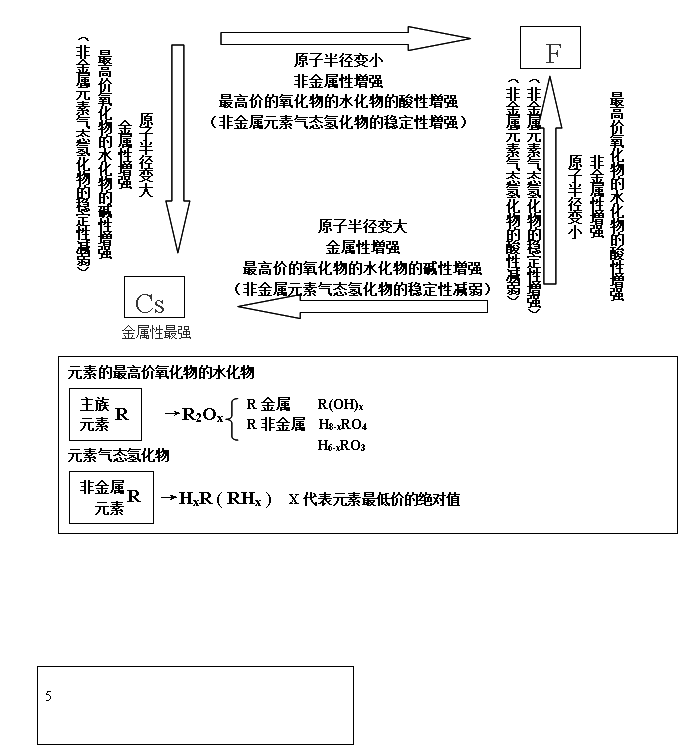
 元素性质的递变规律
元素性质的递变规律




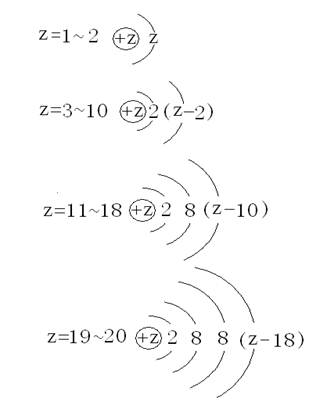 用Z表示原子序数,将前20号元素的原子结构示意图归纳成四种基本模型如下:
用Z表示原子序数,将前20号元素的原子结构示意图归纳成四种基本模型如下: