复习专题七 硅 无机非金属材料
【复习目标】
1. 了解硅在自然界的存在形式和性质。
2. 知道二氧化硅的物理性质和化学性质。
3. 知道硅酸盐的性质和用途。
4.了解硅酸盐工业。
【知识归纳】
一.硅的性质
1.硅的物理性质:
2.硅的化学性质:
① 常温下,只能与氟气、氢氟酸(HF)和烧碱反应
② 加热条件下,能和一些非金属单质反应
Si + O2 =
Si + Cl2 =
Si + C =
3.硅的制备:
【典型例题】
例1.在自然界里,硅存在于地壳的各种矿物和岩石中的形式是 (
A.晶体硅 B.二氧化硅 C.硅酸 D.硅酸盐
例2.关于硅的说法不正确的是 (
A.晶体硅是非金属元素,它的单质是灰黑色的有金属光泽的固体
B.晶体硅的导电性介于金属和绝缘体之间,是良好的半导体
C.硅的化学性质不活泼,常温下不与任何物质反应
D.加热到一定温度时,硅能与碳、氧气等非金属反应
二.二氧化硅的性质
1.物理性质
2.化学性质:二氧化硅的化学性质不活泼不与水反应也不与酸﹙HF除外﹚反应① 具有酸性氧化物的性质
SiO2 + H2O ≠
SiO2 + CaO =
SiO2 + NaOH =
[思考] 如何保存强碱溶液?
② 与盐反应
SiO2 + Na2CO3 =
SiO2 + CaCO3 =
③ 弱氧化性
④ 特性:
[思考] 如何保存氢氟酸?制取氢氟酸用什么容器?
90 ) )
【典型例题】
例3.下列说法正确的是
A.二氧化硅溶于水显酸性
B.光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息
C.因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸。
例4.下列物质不与二氧化硅反应的是 (
A.烧碱 B.氢氟酸 C.硝酸 D.石灰石 )
三.硅酸、硅酸钠
1.原硅酸﹙ ﹚和硅酸﹙ ﹚均溶于水,其酸性比碳酸弱(注意;不能
用水和二氧化硅直接反应制硅酸)原硅酸白色粘稠状物质,很不稳定,在空气中易
失去 生成 反应式是
硅酸是白的粉末状的物质,硅酸加热后发生 生成 和
2.硅酸钠
(1)物理性质
(2)化学性质:
(3)保存:
【典型例题】
例5.能贮存在带磨口塞的玻璃试剂瓶中的试剂是 ( )
A.KOH溶液 B.浓H2SO4 C.水玻璃 D.氢氟酸
四.硅酸盐工业
1.玻璃
(1)原料: 、 、
(2)原理: 、
普通玻璃的主要成分: CaSiO3 、Na2SiO3、SiO2
石英玻璃:纯SiO2 钢化玻璃:与普通玻璃成分一样
有色玻璃:在普通玻璃中加一些金属氧化物
+ CuO-红色;Co2O3-蓝色;MnO2—紫色;Fe2-绿色
2.水泥:原料:3.陶瓷
传统陶瓷是以 等为主要原料烧成的制品。陶器粗松多孔,
有吸水性;瓷器组织致密,几乎不吸水。随着科学技术的发展,一些具有特殊结构和功
能的新型无机非金属材料相继研制出来。如: 、 、 等。
【典型例题】
例6.在制玻璃、制水泥三种工业生产中,都需要的原料是 ( )
A.生石灰 B.石灰石 C.石英 D.纯碱
例7.与普通玻璃主要成分一样的是 ( )
A.钢化玻璃 B.玻璃纸 C.有机玻璃 D.水玻璃
91
【巩固练习】
1.下列有关硅及其化合物的叙述中,错误的是 ( )
A.单质硅是良好的半导体材料 B.硅常温时可以和强碱反应
C.硅酸是挥发性酸 D.二氧化硅广泛存在于自然界
2.近一个时期,一些无知的人挖断通讯光缆想卖其中的贵金属挣钱。结果是既没有挣到钱却破坏了通讯设施,违反了国家法律。制造通讯光缆芯的材料是 ( )
A.铜 B.铁 C.硅 D.二氧化硅
3.下列属于新型无机非金属材料特性的是 ( ) ①能承受高温、强度高 ②具有电学特性 ③具有光学特性 ④具有生物特性 ⑤可塑性好
A.① B.①② C.①②③⑤ D.①②③④
4 .磷酸钙陶瓷也是一种新型无机非金属材料,它可用于制成人造骨骼,这是利用了这类材料 ( )
A.耐高温的特性 B.电学特性 C.光学特性 D.生物功能
5.下列物质中在一定条件下能与SiO2起反应的是 ( ) ①浓H2SO4;②H2O;③浓硝酸;④氢氟酸;⑤KOH溶液;⑥氧化钙;⑦碳酸钠
A.①②⑥ B.②④ C.④⑤⑥⑦ D.③④⑤⑥
6.下列反应不能一步得到的是 ( )
A.SiO2―→Na2SiO3 B.SiO2―→H2SiO3
C.Na2SiO3―→SiO2 D.H2SiO3―→SiO2
7.下列工业生产中不会产生大量二氧化碳的是 ( )
A.用碳和二氧化硅制粗硅 B.制玻璃 C.制水泥 D.烧制生石灰
8.融化烧碱应选用的坩埚是 ( )
A.铁坩埚 B. 玻璃坩埚 C.石英坩埚 D.瓷坩埚
9.给下列溶液中通入CO2气体,不可能产生沉淀的是 ( )
A.氯化钙和硝酸钡的混合液 B.稀的水玻璃
C.四羟基合铝酸钠溶液 D.碳酸钠饱和溶液
10.应用带胶塞的玻璃试剂瓶保存的溶液是
A.纯碱 B.硫酸钠溶液 C.水玻璃 D.浓硫酸
11.根据水泥和玻璃的生产,总结出硅酸盐工业的一般特点是 ( )①生成物是硅酸盐;②反应条件是高温;③含有硅的物质作原料;④反应原理是一系列复杂的物理-化学变化
A.①③ B.①②③ C.①②③④ D.①③④
12.下列物质中,主要成分不是二氧化硅的是 ( )
A.金刚砂 B.玛瑙 C.水晶 D.石英
13.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是 ( )
A.纯碱溶液 B.盐酸 C.硫酸 D.苛性钠溶液
92 ( )
14.下列物质的主要成分不属于硅酸盐的是 ( )
A.水晶 B.陶瓷 C.水玻璃 D.普通玻璃
15.下列各组离子在水中能大量共存的是 ( )
+--A.K+、H、SiO32、S2 B.Na+、K+、H+、SiO32-
-- C.Na+、Cl-、OH、HCO3 D.Na+、H+、NO3-、SO42-
16.现有石灰石、二氧化硅、硅酸钠三种白色粉末,要用一种试剂鉴别,可选用( )
A.氢氧化钠溶液 B.盐酸 C.硝酸银溶液 D.氯化钙溶液
17.下列物质中,既不能与盐酸反应,又不能烧碱溶液反应的是 ( )
A.水玻璃 B.二氧化硅 C.一氧化碳 D.氧化铝
18.向下列物质的饱和溶液中通入CO2,不发生反应的是 ( )
A.Na[Al(OH)4] B.NaHSO4 C.Na2SiO3 D.Ca(ClO)2
19.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别为 ( )
A.7、2 B.5、4 C.6、3 D.3、6
20.有三种无色透明溶液:Ca(HCO3)2溶液、Na2SiO3溶液和澄清石灰水,在上述溶液中分别通入CO2气体。试根据实验现象判断:
(1)生成白色沉淀,此沉淀溶于盐酸而不溶于氢氧化钠溶液,则原溶液为 。
(2)生成白色沉淀,此沉淀不溶于盐酸而溶于氢氧化钠溶液,则原溶液为 。
(1)澄清石灰水; (2)Na2SiO3溶液
21.有A、B、C、D、E五种都含硅元素的物质,它们能发生如下变化:(1)C受热后失水生成D;(2)A溶液与钙盐溶液反应生成白色沉淀E;(3)D与烧碱反应生成A和水;
(4)B在空气中燃烧生成D;(5)D在高温下与碳酸钙反应生成E和一种气体;(6)A溶液与盐酸反应可生成白色胶状沉淀;(7)D在高温下与碳反应生成单质B。试推测A、
B、C、D、E各为何物?并写出(1)-(7)各个变化的化学方程式。
(1)_____________________________________________________________________;
(2)_____________________________________________________________________;
(3)_______________________________________________________________________;
(4)_____________________________________________________________________;
(5)_____________________________________________________________________;
(6)_______________________________________________________________________;
(7)_______________________________________________________________________。 93
第二篇:最简单的有机化合物——甲烷知识点总结及习题
最简单的有机化合物——甲烷
一、甲烷
1.分子组成与结构
(1)甲烷俗名沼气(存在于池沼中)、坑气(瓦斯,煤矿的坑道中)、天然气(地壳中)。
(2)分子式:CH4;电子式: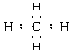 结构式:
结构式: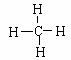 。
。
(3)甲烷空间结构的描述:甲烷是 结构,碳原子位于_____,顶点都是_____。
2.甲烷的物理性质
甲烷是__色__味__体,比空气__,__溶于水,但溶于CCl4。
3.甲烷的化学性质
(1)稳定性:一般情况下,性质很稳定,跟强酸、强碱或强氧化剂等不反应。
(2)可燃性:CH4+2O2 CO2+2H2O
CO2+2H2O
(3)取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。甲烷与氯气在光照条件下反应,黄绿色逐渐____,瓶壁出现____,说明产生了不溶于水的物质。瓶口有___,使湿石蕊试纸变__,推断有氯化氢生成。四个反应的方程式___________、______________、____________、____________。
二、烷烃
(1)烷烃:碳原子间以单键结合成链状,碳原子剩余价键全部跟氢原子结合的烃称为烷烃(也叫饱和链烃)
(2)烷烃的通式:
(3)烷烃物理通性:①状态:C1-C4的烷烃常温为气态,C5-C11液态,C数>11为固态②熔沸点:C原子数越多,熔沸点越高。C原子数相同时,支键越多,熔沸点越低。③水溶性:不溶于水,易溶于有机溶剂。
(4)烷烃的命名:碳原子数在10个以内,依次用“天干”(甲、乙、丙、丁、戊、已、庚、辛、壬、癸)代表碳原子数,其后加上“烷”字;碳原子数在10个以上,用汉字数字表示(如十二烷)。系统命名法的命名步骤:① ——C原子个数数最多;② ——支链最多的碳链,离最简单支链最近的一端编号,且支链位次之和最小;③写名称: — — 。
三、同系物和同分异构体
1.同系物及其判定
(1)同系物的定义:结构相似,在分子组成上相差一个或若干个“CH2”原子团的有机物称为同系物。
(2)判定依据:①分子组成符合同一 ,但彼此有若干个系差(CH2);②主碳链(或碳环)结构 (与环的大小无关);③所含官能团的种类和个数 ;④有机物所属类别 。
(3)同系物通式的归纳和应用:总结一系列具有相似结构的同系物的通式,应采用数学分析法。首先找出不同物质的分子式,确定系差,再根据起始碳数即可确定通式。然后利用通式和数学极限知识即可求同系物中碳的最大含量。
2.同分异构体的书写方法与判断
化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。如正丁烷和异丁烷。具有同分现象的化合物互称为同分异构体。
(1)同分异构体的种类:①碳架异构(指碳原子之间连接成不同的链状或环状结构而造成的异构);②位置异构(指官能团或取代基在碳架上的位置不同而造成的异构);③类别异构(指有机物分子中的官能团不同或有机物类别不同而造成的异构,也叫官能团异构)。
(2)同分异构体的书写方法:①判 :据有机物的分子组成判定其可能的类别异构(一般用通式判断)。②写 :据有机物的类别异构写出各类异构的可能的碳链异构。一般采用“减链法”,可概括为:写直链,一线串;取代基,挂中间;一边排,不到端;多碳时,整到散。③移 :一般是先写出不带官能团的烃的同分异构体,然后在各条碳链上依次移动官能团的位置,有两个或两个以上的官能团时,先上一个官能团,依次上第二个官能团,依次类推。④氢 :按“碳四键”的原理,碳原子剩余的价键用氢原子去饱和,就可得所有同分异构体的结构简式。
(3)同分异构体的判断依据:①分子式必须 。相对分子质量相同,结构不同的化合物不一定是同分异构体,如C8H18和C7H14O。②结构 。碳链骨架不同,或官能团在碳链上的位置不同,或官能团种类不同。
参考答案
一、1.正四面体,正四面体的中心,氢原子2.无、无、气,小,极难
3.褪去、油状小液滴,白雾产生,变红,推断有氯化氢生成,CH4+Cl2 CH3Cl+HCl(CH3Cl一氯甲烷,不溶于水的气体)、CH3Cl+Cl2
CH3Cl+HCl(CH3Cl一氯甲烷,不溶于水的气体)、CH3Cl+Cl2 CH2Cl2+HCl(CH2Cl2二氯甲烷,不溶于水)、CH2Cl2+Cl2
CH2Cl2+HCl(CH2Cl2二氯甲烷,不溶于水)、CH2Cl2+Cl2 CHCl3+HCl(CHCl3三氯甲烷,俗名氯仿,不溶于水,有机溶剂)、CHCl3+Cl2
CHCl3+HCl(CHCl3三氯甲烷,俗名氯仿,不溶于水,有机溶剂)、CHCl3+Cl2 CCl4+HCl(CCl4四氯甲烷,又叫四氯化碳,不溶于水,有机溶剂)
CCl4+HCl(CCl4四氯甲烷,又叫四氯化碳,不溶于水,有机溶剂)
二、CnH2n+2(n≥1) ,找主链,编号码,支链位次、支链数目、支链名称某烷。
三、通式,相似,相同,相同;类别、碳链、官位、饱和;相同、不同
同步练习题
一、选择题(本题包括15小题,每小题只有一个正确答案)
1.下列有关甲烷的说法中错误的是 (C )
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂
2.下列关于甲烷性质的说法中,错误的是 ( D)
A.甲烷是一种非极性分子
B.甲烷分子具有正四面体结构
C.甲烷分子具有极性键
D.甲烷分子中H-C—H的键角为90℃
3.下列物质在一定条件下可与CH4发生化学反应的是 (C )
A.氯水 B.溴水 C.氧气 D.酸性KMnO4溶液
4.将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是 ( D)
A.CH3Cl B.CH2Cl2 C.CCl4 D.HCl
5.下列气体在氧气中充分燃烧后 ,其产物既可使无水硫酸铜变蓝,又可使澄清石灰水变浑浊的是 (B )
A.SO2 B.CH4 C.H2 D.CO
6.下列有机物常温下呈液态的是 (C )
A.CH3(CH2)2CH3 B.CH3(CH2)15CH3
C.CHCl3 D.CH3Cl
7.正己烷的碳链是 (C )
A.直线形 B.正四面体形 C.锯齿形 D.有支链的直线形
8.下列数据是有机物的式量,其中可能互为同系物的一组是 ( A)
A.16、30、58、72 B.16、28、40、52
C.16、32、48、54 D.16、30、42、56
9.在同系物中所有同系物都是 (D )
A.有相同的分子量
B.有不同的通式
C.有相同的物理性质
D.有相似的化学性质
10.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是(D )
A.CH4 B.C2H6 C.C3H8 D.C4H10
11.下列物质的分子中,属于正四面体结构的是(A )
A.CCl4 B.CHCl3 C.CH2Cl2 D.CH3Cl
12.下列微粒中,与甲烷分子具有相同的质子数和相同的电子数的是(B )
A.HCl B.NH3 C.NH4+ D.OH-
13.光照对下列反应几乎没有影响的是(C )
A.氯气与氢气的反应
B.氯气与甲烷的反应
C.甲烷与氧气的反应
D.次氯酸的分解反应
14.下列性质中不属于烷烃具有性质的是(C )
A.燃烧产物只有CO2和H2O
B.与卤素单质发生取代反应
C.都溶于水
D.通常不与强酸、强碱、强氧化剂反应
15.将标准状况下的11.2L甲烷和22.4L氧气混合后点燃,恢复到原状况时,气体的总体积为(A )
A.11.2L B.22.4L C.33.6L D.44.8L
二、填空题(本题共5小题)
16.甲烷的电子式为________,结构式为________。1 g甲烷含___1/16NA____个甲烷分子,4 g 甲烷与____4.5________ g水分子数相等,与___17.5________g一氧化碳原子数相等。
17.甲烷和氯气发生的一系列反应都是__取代______反应,生成的有机物中常用作溶剂的是___CCl4________,可用作灭火剂的是____CCl4_________,氯仿的化学式是__CHCl3_________。参照此类反应,试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:
____________________________________________________________。
18.某元素原子的最外层电子数是次外层电子数的两倍,该元素是 碳,该元素在元素周期表中位于第二 周期第ⅣA 族;它和氢元素组成的最简单的化合物的化学式为 CH4 ,在这种化合物中氢元素的质量分数为 25% 。
19.C8Hm的烷烃,其中m值等于 18 ;Cn H22的烷烃,其n值等于 10 ;相对分子质量为212的烷烃的分子式为 C15H32 。
20.有下列几种物质:①石墨和金刚石 ②C2H6和C5H12 ③C2H4和C2H6 ④CH3CH2CH2CH3和 CH3CH(CH3)2 ⑤3517Cl和3717Cl,试用序号填写下列空白:属于同分异构体的是 4 ,同素异形体的是 1 ;属于同系物的是 2 ;属于同位素的是 5 。
三、计算题(本题共2小题)
21.室温时20 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了50 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。求该气态烃的分子式。 C2H6
22.取标准状况下甲烷和过量氧气的混合气体840mL,点燃并将燃烧后的气体用过量的碱石灰吸收,碱石灰增重0.600g。计算:碱石灰吸收后所剩气体的体积(标准状况下)。336mL
