《硅及其化合物 无机非金属材料》
【高考考点】1.硅和二氧化硅
2.无机非金属材料
3.硅的用途
【知识要点】
一.硅
1.晶体硅的结构
2.硅的存在和物理性质
⑴存在:只以 态存在,主要以 和 ,在地壳中含量居第 位。 ⑵物理性质:晶体硅是一种 色具有 光泽,硬而脆的固体,熔沸点较高,能导电,是良好的 材料。
3.化学性质:
⑴与单质(O2、F2)反应 ⑵与酸(HF)反应
⑶与强碱(如NaOH)溶液反应
4.用途
制造 、 、 、
5.工业制法
二.二氧化硅
1.晶体结构 2.物理性质 3.化学性质
4.用途
制造 , , , , 等。
三.硅酸
硅的常见含氧酸有原硅酸、硅酸。原硅酸是一种 色 溶于水的胶状物,易失
水变为白色粉末状的硅酸( 溶于水),硅酸在一定条件下继续失水可转变成 。
硅酸是一种 酸,酸性比碳酸还要 。实验室制取硅酸常用Na2SiO3(aq)与
稀HCl(aq)或向Na2SiO3(aq)中通入CO2(g)(首先生成原硅酸)。写出上述有关反应的化学方程式。
四.硅酸盐
硅酸钠 Na2SiO3 (Na2O·SiO2)
高岭石 Al2(Si2O5)(OH)4 (Al2O3·2SiO2·2H2O)
常见可溶性硅酸盐是硅酸钠,其水溶液俗名 ,是一种无色粘稠液体,是一
种矿物胶,用作黏合剂,还可用作 。
1
五.无机非金属材料
1.传统无机非金属材料——硅酸盐材料
硅酸盐工业是以 为原料,经 制成的。如制造 、 、 等产品的工业。
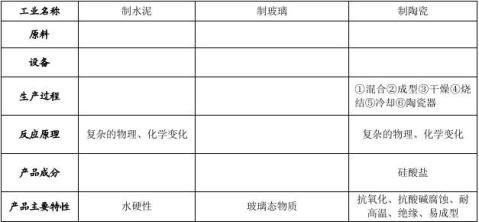
2.新型无机非金属材料
⑴新型无机非金属材料的特性主要有: ① 。②具有 特性 ③具有 特性 ④具有 ⑵重要的新型无机非金属材料——高温结构陶瓷和光导纤维
①高温结构陶瓷—— 、 、 ②光导纤维 【高考试题】
1.下列物质的晶体中,不存在分子的是
A.二氧化硅 B.二硫化碳 C.二氧化硫 D.二氧化碳 2.下列物质属于原子晶体的化合物是
A.金刚石 B.晶体硅 C.二氧化硅 D.干冰 3.光纤是一种很好的通讯材料,制造光导纤维的主要原料是
A.CaCO3 B.CaO C.SiO2 D.Na2CO3 4.固体熔化时必须破坏非极性共价键的是
A.冰 B.晶体硅 C.溴 D.二氧化硅 5.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是 A.WX4是沼气的主要成分 C.ZW是原子晶体
2
B.固态X2Y是分子晶体 D.ZY2的水溶液俗称“水玻璃”
6.晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl
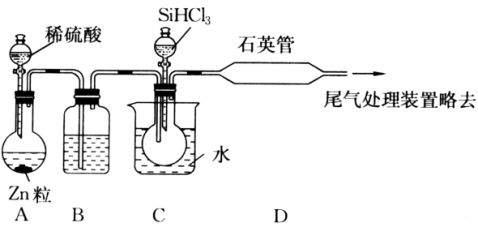
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
⑴第①步制备粗硅的化学反应方程式为 。 ⑵粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。 ⑶用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去): 300℃
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。 ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
【巩固练习】
1.下列材料属于传统无机非金属材料的是
A.玻璃 B.钢铁 C.超硬材料 D.半导体陶瓷
2.传统无机非金属材料和新型无机非金属材料的共同特点是
A.耐高温 B.具有电学特性 C.具有光学特性 D.具有生物功能
3.下列叙述中,不正确的是
A.碳族元素容易生成共价化合物
B.碳族元素的原子最外电子层上都是4个电子,所以碳族元素都是+4价的化合物最
稳定
C.碳族元素从上到下由非金属性向金属性递变
D.碳族元素的原子半径从上到下依次增大
4.普通玻璃是电的绝缘体,这种透明固体物质是
3
A.离子晶体 B.分子晶体 C.原子晶体 D.不属于晶体
5.最近科学家研制出一种新的分子,它具有空心的类似足球状结构,分子式为C60。下列说法正确的是
A.C60是一种新型化合物 B.C60和石墨是碳的同素异形体
C.C60中含有离子键 D.C60的相对分子质量为720
6.下列物质中,不能通过化合反应制取的是
A.H2SiO3 B.Fe(OH)3 C.Fe(NO3)2 D.CaSiO3
7.下列关于说法中,正确的是
A.1 mol SiO2晶体中,含有2 mol Si—O键
B.熔融烧碱可选择石英坩埚
C.二氧化硅分子由一个硅原子和两个氧原子构成
D.尽管二氧化硅既能与烧碱又能与氢氟酸反应,但它仍不是两性氧化物
8.有一种粗铝含金属铁和单质硅两种杂质。取等质量的样品分别投入足量的稀HCl(aq)和足量的稀NaOH(aq)中,放出等量的H2,则该粗铝中铁和硅的关系正确的是
①物质的量之比为2:1 ②物质的量之比为3:1 ③质量之比为2:1 ④质量之比为4:1
A.②④ B.②③ C.①④ D.只有④
9.在反应SiO2 + 2C ???? Si + 2CO中,还原剂和氧化剂的质量之比为
A.5:2 B.2:5 C.1:1 D.2:1
10.钢化玻璃的重要用途之一是制造汽车车窗。合成钢化玻璃的主要原料是
A.纯碱、石灰石、石英 B.纯碱、石灰石、石英、硼酸盐
C.碳酸钾、石灰石、石英 D.水玻璃、石灰石、石英、氧化铅
11.现代建筑的门窗框架常用电解加工成的古铜色硬铝制造,取硬铝样品进行如下实验(每一步试剂均过量): 高温
?气体????溶液 样品?稀盐酸 ??????气体?NaOH溶液??不溶物?浓????????溶液??不溶物???
由此可推知,硬铝的组成为
A.Al、Cu、Mg、Si、Mn B.Al、Mg、Si、Zn
C.Al、Fe、C、Cu D.Al、Si、Zn、Na
12.工业上由粗硅制取纯硅涉及以下反应:
℃????SiHCl3(g)+ H2(g)①Si(s)+ 3HCl(g)?300;△H=-381kJ
℃????Si(s)+ 3HCl(g) ②SiHCl3(g)+ H2(g)?950
对于上述反应的说法中正确的是
A.均为置换反应和氧化还原反应
4
B.反应①、②实际上互为可逆反应
C.由于反应①放热,则反应②一定吸热
D.欲提高SiHCl3产率,应采用加压、升温的办法
13.氮化硅是一种高温陶瓷材料,它的硬度大,熔点高,化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
⑴根据性质,推测氮化硅陶瓷的用途是
①制汽轮机叶片 ②制有机玻璃 ③制永久性模具 ④制造柴油机
⑵氮化硅晶体属于 晶体(填晶体类型)。
⑶下列物质融化时,所克服的微粒间作用力与氮化硅熔化时所克服的微粒间作用相同的是 。
①单质I2和金刚石 ②晶体硅和二氧化硅 ③冰和干冰 ④金刚石和碳化硅
⑷已知氮化硅晶体结构中,原子间都以单键相连,且N原子和N原子、Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式: ,1 mol 氮化硅晶体中含 mol N—Si键。
⑸现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅。反应的化学方程式为: 。
14.材料科学是近年来化学研究的热点之一。某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性,它是以中学化学中的常见物质为原料来生产的,下图虚线框外为其生产过程;虚线框内的其他转化是为探究C的组成而设,G、H均为难溶于水的白色固体;图中C、M、K均含A元素,C物质遇水强烈水解,能生成一种白色胶状物质F和E的酸雾,其余物质均为中学化学常见物质。请回答下列问题:
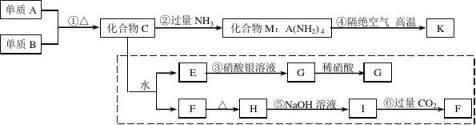
⑴指出K可能所属的晶体类型________________;
⑵写出化学式:单质B________________,化合物F________________;
⑶写出图中下列反应的离子方程式:
⑤____________________________________________________,
⑥____________________________________________________;
⑷写出反应④的化学反应方程式:_________________________________________。
5
15.某科研小组用含有少量的CaO和Fe2O3的高岭土(主要成分为Al2O3·2SiO2·2H2O)来研制新型净水剂,其实验方案如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤弃去残渣,滤液用盐酸酸化,将分离得到沉淀和溶液,溶液即为净水剂。 ⑴熔融时主要成分与纯碱反应的化学方程式为: 。 ⑵最后得到的沉淀物是 。
生成沉淀的离子方程式为 。
⑶用文字和离子方程式说明净水剂的净水原理: ⑷实验室中常备的坩埚由瓷坩埚和铁坩埚,此实验中熔融土样时应选用 坩埚。 16.第ⅣA族元素中碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的。锗(Ge)是一种良好的半导体材料,被广泛用于电子工业上,它可以从煤燃烧的
????锗的氯化物?水解???锗酸烟道灰中提取。其过程如下:烟道灰(含GeO2)?盐酸蒸馏
??????锗。写出以上各步反应的化学方程式。 ?加热???纯净的锗的氧化物?氢气流中加热
17.为了获得平整度高的平板玻璃,20世纪80年代发明了浮法玻璃生产流水线。该工艺的主要原理是让液态玻璃在极平的水平面上边流动边冷却成固体,控制液态玻璃的流动速度即可得到不同厚度的平板玻璃。能够承载液态玻璃的最好平面为与液态玻璃互不

⑴运用表中数据分析:作为承载液态玻璃的物质,其熔点要 ,沸点..
要 ,密度要 。符合上述条件的物质是 。 ⑵作为载体最好还要不易被氧化且无毒无公害。从无公害的角度出发应选择 做载体。
18.已知如下反应:NaH + H2O = NaOH + H2↑;Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ 现有氢化钠(NaH)晶体和单质硅的混合物9.0g与足量的水加热充分反应,共收集到H2 0.80g,求混合物中硅的质量。
6
《硅及其化合物》参考答案
【高考试题】
1.A 2.C 3.C 4.B 5.D
6.⑴ SiO2 + 2C =Si + 2CO↑
⑵分馏(或蒸馏)
⑶①浓硫酸 使滴入烧瓶中的SiHCl3气化 高温 ②有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl 3 + H 2 = Si+ 3HCl
③排尽装置中的空气
④bd
【巩固练习】
1.A 2.A 3.B 4.D 5.BD 6.A 7.D 8.C 9.B 10.A 11.AC
12.A
13.⑴①③④ ⑵原子 ⑶②④ ⑷Si3N4 12 ⑸ 3SiCl4 + 6H2 + 2N2 = Si3N4 +12HCl
14.⑴ 原子晶体
⑵ Cl2 H2SiO3或H4SiO4
⑶ ⑤SiO2 + 2OH = SiO32 + H2O;⑥SiO32 + 2H2O + 2CO2 = H2SiO3 + 2HCO3 ----高温 高温
⑷ 3Si(NH2)4 = Si3N4+8NH3↑
15.⑴ SiO2 + Na2CO3 =CO2↑+ Na2SiO3
+-高温 高温 Al2O3 + Na2CO3 =CO2↑+ 2NaAlO2 高温 ⑵H2SiO3 2H+ SiO32 = H2SiO3↓
⑶Al3 + 3H2O +Al(OH)3 (胶体) + 3H,氢氧化铝胶体可以吸附水中的悬浮杂质。
△ +⑷铁 16. GeO2 + 4HCl = GeCl4+ 2H2O GeCl4+ 4H2O = H4GeO4 + 4HCl
H4GeO4 = GeO2+ 2H2O △ △ GeO2+ 2H2 = Ge + 2H2O
-17.⑴低于400℃ 高于800℃ 大于2.8 g·cm3 ⑵锡、铅 锡
18.0.84g(Si完全反应)或4.2g(NaOH完全反应)
7
第二篇:高一化学必修一第三章金属及其化合物方程式总结
第三章 金属及其化合物
反应方程式总结
本章以Na、Al、Fe为例介绍金属及其化合物的性质和用途,以“单质—>氧化物—>氢氧化物—>盐类”的顺序介绍其相应性质,物质之间的化学反应多切杂,但是杂中有序,希望同学能熟练、灵活运用。对本章主要反应做出以下总结:【写出相应的化学方程式】
Na、Na2O、Na2O2的颜色,Na2CO3、NaHCO3的颜色状态、溶解性、俗称;Al、Al2O3、Al(OH)3的物理性质,重点掌握Al及其化合物的两性【既与酸反应又与强碱反应】;掌握Fe、FeO、Fe2O3的颜色,俗称,及Fe2+与Fe3+之间的转换关系。
1、 Na在空气中氧化
2、 Na在空气中加热
现象:
3、 Na与水反应
现象
4、 Na与硫酸反应
5、 Na与饱和氢氧化钙溶液反应方程式及现象
6、 Na与硫酸铜溶液反应方程式及现象
7、 Na与饱和硫酸铵反应方程式及现象
8、 Na与硫酸铁反应
9、 Na2O与水反应
10、 Na2O与CO2反应
11、 Na2O2与水反应
12、 Na2O2与CO2反应
13、 NaOH与适量CO2反应
14、 NaOH与过量CO2反应
15、 向饱和Na2CO3溶液中通入CO2
16、 向Na2CO3溶液中逐滴加入HCl溶液现象及反应方程式
17、 向Na2CO3溶液中加入CaCl2溶液
18、 向Na2CO3溶液中加入Ba(OH)2溶液
19、 向NaHCO3溶液中逐滴加入HCl溶液现象及反应方程式
20、 向NaHCO3溶液中逐滴加入CaCl2溶液,是否有现象?能否发生反应?
21、 向NaHCO3溶液中加入足量Ba(OH)2溶液
22、 向NaHCO3溶液中加入少量Ba(OH)2溶液
23、 向NaHCO3溶液中加入NaOH溶液
24、 加热NaHCO3固体,并将气体导入澄清石灰水,现象及相关反应方程式
25、 Al在空气中氧化
26、 Al与HCl溶液反应
27、 Al与NaOH溶液反应
28、 Al2O3与HCl溶液反应
29、 Al2O3与NaOH溶液反应
30、 Al(OH)3的实验室制法
31、 Al(OH)3与HCl溶液反应
32、 Al(OH)3与NaOH溶液反应
33、 高温加热Al(OH)3
34、 向AlCl3溶液中逐滴加入NaOH溶液,现象及相应方程式
35、 向AlCl3溶液中加入过量的NaOH溶液
36、 已知偏铝酸(HAlO2)为积弱的酸,酸性比H2CO3还弱,在溶液中,
偏铝酸极易结合水分子形成H3AlO3形式的化合物即Al(OH)3向NaAlO2溶液中通入CO2现象及方程式
37、 向NaAlO2溶液中逐滴加入HCl溶液的现象及方程式
38、 Fe在氧气中燃烧
39、 铁粉与水蒸气高温下反应
40、 Fe与稀盐酸反应
41、 FeO与稀盐酸反应
42、 Fe2O3与稀盐酸反应
43、 向FeCl2溶液中加入NaOH溶液的现象及方程式
44、 向FeCl3溶液中加入NaOH溶液的现象及方程式
45、 高温加热Fe(OH)3
46、 向FeCl3溶液中加入足量铁粉
47、 向FeCl3溶液中加入铜粉
48、 向FeCl2溶液通入氯气(或加入氯水)
49、 实验室如何鉴别Fe2+和Fe3+
50、 如何检验溶液中是否含有Fe2+
