实验二天平的使用和溶液的配置及标定
实验目的
掌握实验室几类常用天平的使用方法
学会配置标准溶液并对其他溶液进行标定
实验原理
反应方程式:H﹢+OH﹣=H2O
浓度计算关系式:HOOC-COOH.2H2O------2NaOH
1 : 2
所以C(NaOH)=2*m(草酸)*1000/ (V2-V1)*126
m为草酸的质量,126是它的摩尔质量
(V2-V1)为滴定时消耗的NaOH的体积,单位为ml
实验试剂
草酸 氢氧化钠 酚酞 蒸馏水
实验仪器
电子天平1台 分析天平2台 玻璃杯8根 滴定管8个 250ml锥形瓶3*8 试剂瓶8个 铁架台8 称量瓶8 250ml烧杯8 250ml量筒 2
实验内容
① 配置草酸标准溶液:
a. 用分析天平准确称取3份约1.2-1.3g草酸(m),分别倒入3个干净的250ml锥形瓶中,标号1、2、3,记录数据,
b. 在锥形瓶中加蒸馏水搅拌使草酸溶解,分别滴加2滴酚酞试剂,备用.
② 配置250ml浓度为1mol/L左右的氢氧化钠溶液
a. 用电子天平称量10g左右的氢氧化钠,倒入一干净的250ml烧杯中,
b. 往烧杯中加入约250ml蒸馏水稀释,搅拌溶解,
c. 将溶液全部转移至干净的试剂瓶中,并贴上标签。
③ 标定:
a. 取滴定管洗干净,并最后用少量氢氧化钠溶液润洗一次,装入氢氧化钠溶液,记下滴定管的初始刻度V1,固定在铁架台上,
b. 用氢氧化钠溶液将锥形瓶中的草酸溶液分别滴定至淡红色,并在半分钟内不褪色即视为终点,记下此时滴定管的示数V2;
c. 重复b的操作滴定另外2分草酸溶液至终点,同时记录相应数据。
④ 计算氢氧化钠的浓度,并写在试剂瓶上的标签上面,NaOH溶液留下次实验用。
实验数据处理

附:分析天平使用方法
·准备
将天平放在稳定的工作台上,避免振动,气流、阳光直射和剧烈的温度波动。
调整水平调节脚,使水泡位于水准器中心。
接通电源前请确认当地交流电压是否与天平所需电压一致。
为获得准确的称量结果,在进行称量前必须使天平按通电源预热,至少 60分钟以达到工作温度。
·开机
使称盘空载并按压<ON>键,天平进行显示自检(显示屏所有字段短时点亮)显示天平型号,
当遇到各种功能键有误无法恢复时,重新开机即可恢复出厂设置。
·校准
为获得准确的称量结果,必须对天平进行校准以适应当地的重力加速度。校准应在天平经过预热并达到工作温度后进行,遇到以下情况必须对天平进行校准。
·首次使用天平称量之前
·天平改变安放位置后
·称量工作中定期进行
具体校准方法
准备好校准用的标准砝码,确保称盘空载
按<TAR>键:使天平显示回零
按<CAL>键:显示闪烁的CAL-200,将标准砝码放到称盘的中心位置,天平显示CAL……,等待十几秒钟后,显示标准砝码的重量。此时,移去砝码,天平显示回零,表示校准结束,可以进行称量了。如天平不回零,可再重复进行一次校准工作。
·清零/去皮键<TAR>
清零:当天平空载时,如显示不在零状态,可按<TAR>键,使天平显示回零。此时才可进行正常称量。
去皮:小颗粒物和液体在称量时都需使用容器,可将容器放在称盘上,按<TAR>键,使天平
·称量
天平经校准后即可进行称量,称量时须等显示器左下角“○”标志熄灭后才可读数,称量时被测物必须轻拿轻放,并确保不使天平超载,以免损坏天平的传感器。
·关机
确保称盘空载后按压<OFF>,天平如长时期不用,请拔去电源插头。
实验四 酸度计法测定醋酸解离常数
实验目的
(1)测定醋酸的解离常数.
(2)巩固酸碱滴定操作,掌握方法和原理.
(3)练习使用酸度计.
实验原理
醋酸(以HAc表示)是弱电解质,在水溶液中存在以下解离平衡:
HAc== H+ + Acˉ
起始浓度 c 0 0
平衡浓度c(HAc) c(H+) c(Acˉ)
c(H+)=c(Acˉ) c(HAc)=c-c(H+)
Kφ(HAc)= c(Acˉ)* c(H+)/ c(HAc)= c(H+)2/ c-c(H+)
在HAc溶液中 c可以通过滴定测得;
若测定已知浓度HAc溶液的pH,便可算出c(H+)=10-PH从而算出它的解离常数。
实验仪器及试剂
酸度计 移液管 锥形瓶 滴定管 醋酸溶液 已知浓度的NaOH溶液 酚酞试剂
实验步骤
(1)醋酸溶液的配置
(2)醋酸溶液浓度的测定
用移液管吸取HAc溶液25.00mL放入锥形瓶中,加入2滴酚酞,用已标定的NaOH溶液滴定HAc溶液(注意每次滴定都从0.00mL开始).
重复上述操作3次,计算HAc的浓度,取平均值
(3)配制不同浓度的醋酸溶液
用移液管和吸量管分别取25.00mL,5.00mL,2.50mL已测定浓度的HAc溶液,把它们分别加入3个50mL容量瓶中,再用蒸馏水稀释到刻度,摇匀.算出此3瓶HAc溶液的浓度.
(4)测定醋酸溶液的pH值
把以上稀释的HAc溶液和原HAc溶液共4种不同浓度的溶液,分别放入4个干燥的50mL烧杯中,按由稀到浓的次序用酸度计分别测定它们的pH,记录数据和室温.计算解离常数.
实验结果处理
原HAc溶液的起始浓度c原= mol* L-1 Kφ(HAc)= 10-2PH/c-10-PH

Kφ(HAc)=K1+K2+K3+K4/4(即取平均值)
思考题
(1)不同浓度的HAc溶液的解离常数是否相同
(4)实验时为什么要记录温度
硝酸钾的制备
实验目的
1.学习利用物质溶解度随温度变化的差别,通过复分解反应制备硝酸钾;
2.掌握溶解、减压抽滤操作,练习用重结晶法提纯物质。
实验原理
本实验是采用转化法由NaNO3和KCl来制备硝酸钾,其反应如下:
NaNO3 + KCl ===NaCl + KNO3
该反应是可逆的,无法用上述反应制取叫纯净的KNO3,根据反应物和产物溶解度随温度变化不同,可以制备和提纯KNO3。
表 NaNO3、KCl、NaCl、KNO3在不同温度下的溶解度(g/100g水)
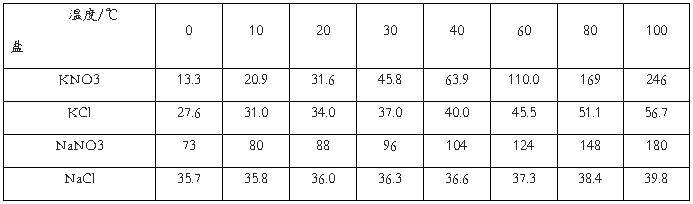
由表中的数据可以看出,反应体系中四种盐的溶解度在不同温度下的差别是非常显著的,氯化钠的溶解度随温度变化不大,而硝酸钾的溶解度随温度的升高却迅速增大。因此,将一定量的固体硝酸钠和氯化钾在较高温度溶解后加热浓缩时,由于氯化钠的溶解度增加很少,随着浓缩,溶剂水减少,氯化钠晶体首先析出。而硝酸钾溶解度增加很多,它达不到饱和,所以不析出。趁热减压抽滤,可除去氯化钠晶体。然后将此滤液冷却至室温,硝酸钾因溶解度急剧下降而析出。过滤后可得含少量氯化钠等杂质的硝酸钾晶体。再经过重结晶提纯,可得硝酸钾纯品。
硝酸钾产品中的杂质氯化钠可利用氯离子和银离子生成氯化银白色沉淀来检验。
实验仪器与试剂
烧杯(100mL, 250mL),温度计(200℃),减压抽滤装置,电子天平,石棉网,电热套,玻棒,量筒(10mL, 50mL)。
氯化钾,硝酸钠(工业级或试剂级),滤纸。
实验步骤
1.溶解:称取10g硝酸钠和8.5g氯化钾固体,倒入100mL烧杯中,加入20mL蒸馏水。将盛有原料的烧杯放在电热套里加热,并不断搅拌,至杯内固体全部溶解,记下烧杯中液面的位置。
2.浓缩:继续加热并不断搅拌溶液,使NaCl晶体析出,当加热至杯内溶液剩下约为原有体积的2/3时,趁热快速减压抽滤(布氏漏斗要预热,吸滤瓶必须洗干净)。
3.溶解结晶:将滤液迅速从吸滤瓶转移至小烧杯中,并用10mL热的蒸馏水洗涤吸滤瓶,洗液转入盛滤液的烧杯中,记下此时烧杯中液面的位置。加热至滤液体积只剩原有体积的2/3时,冷却至室温,观察晶体的析出并记录晶体的形态。减压抽滤把所得晶体尽量抽干,得到的产品为粗产品,称量。
4.重结晶:按粗产品:水=2:1(质量比)将粗产品溶于蒸馏水中,加热,搅拌至全部溶解,(若沸腾时还未溶解完可加少量蒸馏水使溶解完)停止加热。待溶液冷却至室温后减压抽滤尽量抽干,得到纯度较高的硝酸钾晶体,称量,计算KNO3的理论产量和产率。
注意事项
第3步过滤一定要趁热快速减压抽滤,这就要求布氏漏斗在沸水中或烘箱中预热。
问题思考
1.何谓重结晶?本实验都涉及哪些基本操作?应注意什么?
2.能否将除去氯化钠后的滤液直接冷却制取硝酸钾
第二篇:硝酸钾
目前农业硝酸钾市场运用十分广泛,硫酸钾和硝酸钾同属于二元复合肥,硫酸钾价格为2200元左右,而硝酸钾在3300-3400元左右 。硝酸钾比硫酸钾在农业上的应用综合测评来说较有优势,硝酸钾是无氯钾、氮复合肥料,植物营养素钾、氮的总含量可达60%左右,具有良好的物理化学性质。
农田中施用硝酸钾有如下优点:
①由于没有挥发性,可直接施于土壤表面而不需覆盖;
②对氯离子敏感作物施用硝态氮比铵态氮更为有利,如烟草、柑橘、葡萄、蔬菜、甜菜以及其它对氯离子敏感的作物,因为硝酸钾中的硝态氮能阻止作物吸收土壤中氯;
③硝态氮在任何条件下能迅速提供养分,适用于春、夏、秋、冬作物; ④不会在土壤中造成盐类的积累。
特别是硝酸钾施用于烟草具有肥效高,易吸收,促进幼苗早发,增加烟草产量,提高烟草品质的重要作用。现已在云南玉溪地区大量使用(全由智利进口)。据中国烟草总公司介绍,全国每年需烟草专用肥200万吨,该专用肥若全部用硝酸钾混配,则需硝酸钾40多万吨。随着我国无土栽培技术的发展以及高经济价值农作物的生产,对硝酸钾的需求量将会越来越大,市场前景十分广阔。
当前,世界硝酸钾生产主要集中在以色列、智利、美国、丹麦等国,其中以色列、智利硝酸钾产量大,并且还在不断扩大产量。据国外权威机构预测,今后10年内世界硝酸钾将以每年6—8%的速度递增,主要市场在欧洲、拉美、美国及亚洲,世界硝酸钾总产量70%以上用于农业。
我国硝酸钾的生产有着悠久的历史,但产品的应用却局限在工业领域。生产规模小且技术落后,基本上为间歇式生产方法。农用硝酸钾的生产基本为空白。随着人们对硝酸钾在农业生产中应用的认识,以及其广阔的市场前景,国内的研究单位和生产企业都在寻找适合我国国情的农用硝酸钾生产技术和生产方法。谁先行一步,谁就能在将来的激烈竞争中赢得主动,谁就能获得丰厚的回报。
2 硝酸钾生产方法的比较
硝酸钾的生产方法主要有以下几种:
1、安徽省化工研究院开发的以硝酸铵、氯化钾为原料的复分解循环法;
2、以硝酸铵、氯化钾为原料的离子交换法;
3、以硝酸钠、氯化钾为原料的复分解循环法;
4、以天然硝酸钾矿为原料的提纯法;
5、美国离子交换法;
6、以色列IMI法;
7、美国西南钾碱公司法;
8、智利SQM硝钠转化法。
前四种都是国内现有的生产方法。其中硝酸钾矿提纯法只在我国新疆有这种独特的资源,未来发展情况尚难定论。以硝酸钠为原料复分解法生产砂酸钾由于硝酸钠价格远离于硝酸铵,现已逐渐被淘汰。以硝酸铵为原料离子交换法生产硝
酸钾近年发展较快,但其能耗高、建厂投资大、难于大规模连续化生产的缺陷限制了它的发展。以硝酸铵为原料复分解循环法生产砂酸钾已历经十余年的生产考验,技术已相当成熟,随着大规模连续化生产装置的成功开发必将极大地推动国内农用硝酸钾的发展。
美国西南钾碱公司法、智利SQM硝钠转化法在国内难以推广。安徽省化工研究院开发的硝酸钾生产方法虽原料消耗指标略高于美国离子交换法、以色列IMI法,但其副产品为,它可作为复混肥的原料,易于销售、储存和运输。特别是它建厂投资远低于其它方法,无“三废”污染,设备易加工维修,可实现自动化连续生产的要求。
3 结论
3.1 开发农用硝酸钾从国内市场到生产技术条件都已具备,谁能先行一步并选择合适的生产技术谁就能在将来的激烈竞争中赢得主动。
3.2 安徽省化工研究院开发的以硝酸铵、氯化钾为原料复分解循环法生产农用硝酸钾由于具有工艺流程简单、副产品易于使用、无“三废”污染、可实现大规模连续化生产、建厂投资省等优点,是一种非常适合我国国情的生产方法。
3.3 生产农用硝酸钾可获得明显的经济效益。
3.4 中氮企业生产农用硝酸钾可将80%或90%的硝酸铵溶液直接输送到生产装置中,这样不仅能节约运费和包装费,而且可降低能耗,经济效益将更加显著。
中国目前以秦岭和淮河为界,以北,为石灰性土壤;以南为酸性土壤,均适合硝酸钾。
