实验十七硫酸铜的提纯
一、 实验目的
1. 掌握用化学法提醒混硫酸铜的原理和方法
2. 练习并初步学会无机制备的某些基本操作
二、 实验原理(略)
三、 仪器、药品和材料(略)
四、 实验内容
(一)粗硫酸铜的提纯
1.称量溶解。
2.在粗CuSO 4 溶液中,滴加3% H 2 O 2 溶液2ml,加热搅拌,用2mol·L -1 NaOH调节溶液的 pH≈3.5-4.0(精密pH试纸)并加热煮沸,使Fe 3+ 离子水解为 Fe(OH) 3 沉淀滤去。其反应式为
2Fe 2+ + 2H + + H 2 O 2 === 2Fe 3+ + 2H 2 O
Fe 3+ + 3H 2 O === Fe(OH) 3 ↓ + 3H+
趁热减压过滤,将滤液转入蒸发皿中。
3.在提纯后的硫酸铜溶液中,滴加1mol·L -1 H 2 SO 4 ,调节溶 液的pH≈1.0—2.0,然后在石棉网上加热,蒸发浓缩至液面出现晶膜为止。
4.让其自然冷却至室温有晶体析出(如无晶体,再继续蒸发浓缩),减压过滤,用3mL无水乙醇淋洗,抽干。
5.产品转至表面皿上,用滤纸吸干后称重。计算产率,母液回收。
(二)硫酸铜纯度的检验
对比未提纯的粗硫酸铜以及提纯过的硫酸铜中三价铁离子的含量进行检验其纯度。(步骤略)
五、注意事项
1.在粗硫酸铜的提纯中,浓缩液要自然冷却至室温析出晶体。否则其它盐类如Na 2 SO 4 也会析出。
六、思考题
1.除去Fe3+时,为什么要调节pH=3.5—4.0左右,pH过高对实验有何影响?
答: Fe 3+ ,在 pH≈3.5-4.0就会水解完全,生成氢氧化铁沉淀除去。pH太大,会析出Cu(OH) 2 ;pH 太小,Fe 3+ 水解不完全。
2.提纯后的硫酸铜溶液中,为什么用1mol.l-1的硫酸进行酸化?且pH调节到1.0-2.0?
答:一是用硫酸酸化不引进新的物质;
3.检验硫酸铜纯度时为什么用氨水洗涤Fe(OH)3,且洗到蓝色没有为止?
答:用氨水洗涤Fe(OH)3主要原因有一是氨水不与Fe(OH)3反应,二是氨水与硫酸铜反应生成[Cu(NH3)4]SO4溶液利于与Fe(OH)3分离。
4.那些常见氧化剂可以将Fe2+氧化为Fe3+?实验中选用H2O2作为氧化剂有什么优点?还可以选用什么物质作为氧化剂?
答:可以将Fe2+氧化为Fe3+的常用的氧化剂有:H2O2 高锰酸钾 Cl2 、氧气等。选用H2O2的优点有:产物是水,不给提纯物质引进新的杂质,还可以选用氧气。
5.调节溶液pH为什么常用稀酸、稀碱?除酸碱外。还可以选用那些物质?选用的原则是什么?
答:部分强酸强碱具有氧化性或者容易破坏沉淀的生成。还可以选用弱酸弱碱。选用的原则是一是容易出去且不能引进新的杂质,二是不能影响物质的分离。
实验
粗硫酸铜的提纯
一,实验目的 1.了解粗硫酸铜提纯及产品纯度检验的原理和方法. 2.学习台秤和 pH 试纸的使用以及加热,溶解,过滤,蒸发,结晶等基本操作. 二,实验原理 不溶性杂质: 直接过滤除去;可溶性杂质 Fe2+, Fe3+等: 先全部氧化为 Fe3+,后调节 pH ≈4,使其水解为 Fe(OH)3 沉淀后过滤;其它可溶性杂质:重结晶留在母液中. 三,实验内容 20mLH2O 2mLH2O2 静置 5g 硫酸铜 搅拌, 加热溶解 滴加 NaOH 至 pH≈4 100mL 烧杯 Fe(OH)3↓ 倾析法过滤 滤液承接在蒸发皿(另留 10d 于试管中用于检验纯度) 2~3dH2SO4 蒸发至刚出现晶膜 冷却 抽滤 取出晶体,称重 pH1~2 6molL-1NH3H2O NH3H2O 10d 待测液 深蓝色溶液 过滤 洗涤滤纸蓝色 3mLHCl 2dKSCN 弃去蓝色溶液 接收滤液 比较颜色深浅 溶解沉淀 产品外观,色泽 ;理论产量 ;实际产量 ; 产率 ;纯度检验结果 . 四,思考题 产品纯度高,得率高的关键 1,水解时控制好 pH 值:pH 过低,Fe3+水解不完全;过高会生成 Cu(OH)2 沉淀. 2,蒸发浓缩时控制母液的量:母液过多,硫酸铜损失多,产率低;母液过少,杂质析出, 纯度低.
实验
滴定分析基本操作练习(一)
一,实验目的 1,了解并掌握酸式滴定管,碱式滴定管的使用,练习正确读数. 2,练习酸碱标准溶液比较,学会控制滴定速度和判断终点. 二,实验内容 1,酸式滴定管旋塞涂油:给酸式滴定管的旋塞涂油(P18) 试 漏 . , 要求:姿势正确,旋塞与旋塞槽接触的地方呈透明状态,转动灵活,不漏水. 2,碱式滴定管配装玻璃珠:为碱式滴定管配装大小合适的玻璃珠和乳胶管. 要求:不漏水. 3,洗涤:洗涤滴定管和锥形瓶(P5) . 要求:内壁完全被去离子水均匀润湿,不挂水珠. 4,润洗:用待装溶液润洗滴定管(P19) . 要求:操作姿势正确. 5,装溶液:酸式滴定管,碱式滴定管内装入指定溶液,赶除气泡(P19) 读 数 . , 要求:无气泡,读数姿势及记录的数据有效数字正确. 6:熟练使用滴定管:学会熟练地从酸式滴定管和碱式滴定管内滴出溶液(P20) . 要求:操作姿势正确,能熟练地连续滴定,一滴,半滴(悬而未落) . 7:练习正确的滴定操作并学会确定滴定终点:从酸式滴定管放出约 5mL 盐酸溶液在锥形瓶 中,加入 30mL 左右去离子水,加入 2d 酚酞,然后用 NaOH 溶液滴定至微红,平行滴定三 次. 要求:滴定操作姿势规范(P20) ,临近终点时半滴半滴加入,终点颜色微红. 实验次数 始读数 V(HCl)/mL 终读数 净读数 始读数 V(NaOH)/mL 终读数 净读数 V (HCl)/ V (NaOH) 1 2 3 4 5
实验
滴定分析基本操作练习(二)
一,实验目的 1,了解分析天平的构造及称量方法,掌握直接称量法和减量称量法. 2,学习和掌握移液管和容量瓶的操作方法. 二,实验内容 1,直接称量法与减量称量法称量练习(P41~43) (1)取下天平罩并叠好放在天平顶端,按 ON(或 O/T)键屏上显示 0.0000g 时称量,分别称 出称量瓶和称量瓶盖的质量,再把称量瓶盖盖在称量瓶上称出总质量. m(瓶)= g;m(盖)= g;m(瓶+盖)= g; (2)将称量瓶连盖轻放在托盘上,显示稳定的数字,单位后按去皮键 TAR(或 O/T)显示 0.0000g,取出称量瓶,敲样后再称量,数字稳定后记录数据;按去皮键 TAR(或 O/T)显 示 0.0000g 后继续称量下一份.要求称取 02.~0.3g 样品 3 份. m1= g;m2= g;m3= g; (3)结束按 OFF 键,检查天平并整理干净,罩好天平罩. 2,练习移液管的移液操及移液管与容量瓶的相对校正(P21~24) . (1)洗涤移液管和容量瓶,检查容量瓶是否漏水 (2)正确吸放一定体积的指定溶液,学会用食指灵活控制调节液面高度 (3)用移液管吸取去离子水注入干燥的容量瓶中,进行 10 次,观察水面弧线是否与标线相 切. 3,容量瓶的定量转移与定容(P21) . 称取少量样品于小烧杯中,加水溶解,定量转移入容量瓶内,用去离子水稀释至刻度. 注意溶液不能洒到容量瓶外,稀释时勿超过刻度线.
实验
氢氧化钠标准溶液的标定
一,实验目的 1,学会用基准物质标定标准溶液浓度的方法 2,进一步掌握酸碱滴定法的基本原理 二,实验原理 KHC8H4O4+NaOH=KNaC8H4O4+H2O 三,实验内容 准确称取 KHC8H4O4 0.8~1.2g 于锥形瓶中(3 份) →50mLH2O →温热,溶解→冷却→2d 酚酞→NaOH 溶液滴定至微红,30s 不褪色→平行测定三次,记录数据并计算 数据记录与处理 实验次数 邻苯二甲酸氢钾/g 始读数 V(NaOH)/mL 终读数 净读数 计算公式 1 2 3 4 5
c (NaOH ) =
m(邻苯二甲酸氢钾 ) M (邻苯二甲酸氢钾 )V (NaOH )
c(NaOH)/(molL-1) 平均值( , )
相对相差/‰
(注:相对相差为结果中取最接近的两个数字,两者之差除以两者的平均值,例如:测得的浓度为 0.2001, 0.2005,0.2007,则舍去 0.2001,平均值=(0.2005+0.2007)÷2=0.2006,相对相差=(0.20##-0.2005) ÷0.2006=1‰)
四,问题与讨论 1,基准物应当纯度高,物质的组成与化学式完全吻合,稳定且摩尔质量尽可能的大.草酸 易提纯,化学式为 H2C2O42H2O,稳定且摩尔质量比较大,与 NaOH 按 1:2 定 量 反 应 , 可作基准物. 2,滴定管读数误差为 0.02mL,为使相对误差小于千分之一,消耗的 NaOH 的体积在 20~ 30mL 之间. 3,指示剂在高温下变色范围会发生移动,导致滴定终点不准确. 4,指示剂为弱酸或弱碱,可与待测液反应,多用会导致结果不准确. 5,邻苯二甲酸氢钾烘干温度过高会使少量基准物变成酸酐,此时相同质量的基准物消耗更 多体积 NaOH 待测液,标定的浓度偏低.
实验
醋酸溶液中 HAc 含量的测定
一,实验目的 1,学会用已标定的标准溶液来测定未知物的含量. 2,熟悉移液管和容量瓶的使用,巩固滴定操作. 二,实验原理 HAc+NaOH=NaAc+H2O 三,实验内容 交一洗净的 250mL 容量瓶领取未知液→定容→用待测溶液润洗移液管→分别移取三份 试液于锥形瓶中→加 2d 酚酞→吹洗瓶口并稀释→用 NaOH 溶液滴定至粉红,30s 内不褪色 记录数据 数据记录与处理 实验次数 V(HAc)/(mL) 始读数 V(NaOH)/mL 终读数 净读数 计算公式 1 25.00 2 25.00 3 25.00 4 5
m(HAc) = c( NaOH )V ( NaOH ) × 60.05 ×
250.00 25.00
c(NaOH)/(molL-1) m(HAc)/mg
平均值( , ) 相对相差/‰ 四,问题与讨论 经常用去离子水淋洗会使最终溶液体积变大,浓度变稀,导致滴定曲线的突跃变窄,指示剂 的变色范围不再在突跃范围内,滴定终点滞后,测得的 HAc 含量偏大.
实验
工业纯碱中总碱量的测定
一,实验目的 1,继续巩固容量分析仪器的正确操作. 2,掌握甲基橙双色指示剂的应用和终点颜色的判别. 二,实验原理 Na2CO3+2HCl=H2O+CO2+2NaCl 三,实验内容 准确称取 2.0~3.0g 工业纯碱(按学号取称量瓶)于 100mL 烧杯中→加水溶解后定量转 移入 250mL 容量瓶中→定容→平行移取 25mL 试液 3 份于锥形瓶中→加 20~30mL 水→加 1~2d 甲基橙→滴定至橙黄色→记录数据,计算 数据记录与处理 实验次数 m(工业纯碱)/g 1 2 3 4 5
c(HCl)/(molL-1) 始读数 V(HCl)/mL 终读数 净读数
计算公式
ω (Na 2 O ) =
c( HCl )V ( HCl ) × 61.98 × 250.00 2m (样品) × 25.00
w(Na2O)
平均值( , ) 相对相差/‰ 四,问题与讨论 1,称量时要快,避免因称量瓶中的样品吸水引起误差,试样称出后再吸水对结果无影响. 2,滴定接近终点时要剧烈摇动溶液,赶除溶解在溶液中的 CO2,避免干扰滴定终点的判断. 3,不可以用酚酞作指示剂,因为工业纯碱中含有 NaOH,NaHCO3 等杂质. 4,样品加热溶解后一定要冷却后再定容,先定容再冷却则体积缩小,实际浓度高于计算浓 度引起误差. 5,定量转移过程中溶液损失会使配制溶液的浓度偏低,导致测得的总碱量偏低.
实验
解离平衡和弱酸解离常数的测定
一,实验目的 1,学习并掌握酸度计的使用. 2,学习利用测定弱酸和缓冲溶液 pH 的方法来测定弱酸的解离常数. 二,实验原理 1,一元弱酸溶液: K
a
=
[H
][ Ac ] 10 2 pH = [ HAc ] c
+
2,HAc-NaAc 缓冲溶液:
pH = pK θ + lg
c NaAc c HAc
当 c(NaAc)=c(HAc)时,pH=pKa 三,实验内容 1,不同浓度 HAc 溶液及缓冲溶液的配制 将 5 只烘干的 100mL 烧杯编成 1~5 号. 在 1 号烧杯中,从滴定管准确放入 5.00mL 已标定的醋酸溶液,再从另一滴定管中准确 放入 45.00mL 蒸馏水,混合均匀. 用同样的方法按下表配制不同浓度的溶液. 2,溶液 pH 的测定 用酸度计由稀到浓依次测量 1~4 号溶液的 pH,仔细清洗电极后再测量 5 号溶液的 pH, 记录数据并处理下表. 烧杯 编号 1 2 3 4 5 V(HAc) /mL 5.00 10.00 25.00 50.00 25.00 V(H2O) /mL 45.00 40.00 25.00 0.00 25.00mL0.1molL-1NaAc c(HAc) /(molL-1) pH 解离常数 Ka 测定值 平均值
测定温度= ℃ 四,问题与讨论 1,实验中所用小烧杯应先干燥,但不可用 HAc 溶液润洗,否则影响所配溶液的浓度. 2,测定所用溶液的浓度不宜过高,浓溶液中活度系数小于 1,测定的 Ka 值误差较大. 3,测定溶液的 pH 应由稀到浓,因为少量的稀溶液对浓溶液的浓度影响有限,但少量的浓 溶液如果带入稀溶液则会使稀溶液的浓度产生较大变化.
氢氧化钠标准溶液的溶液配制与标定
一、实验目的
1.学会配制一定浓度的标准溶液的方法。
2.学会用滴定法测定酸碱溶液浓度的原理和操作方法。
3.进一步练习滴定管、移液管的使用。
4.初步掌握酸碱指示剂的选择方法。熟悉指示剂的使用和终点的判据。
二、实验原理
测定时,一般都使用浓度约为0.1mol/L NaOH标准溶液。由于NaOH固体试剂的纯度不高,并易吸收空气中的CO2和水分,因此,不能直接配制法配制NaOH标准溶液,而必须用标定法。
标定碱液的基准物质很多,经常使用的基准物,如草酸(H2C2O4·2H2O,相对分子质量为126.07)、邻苯二甲酸氢钾(HOOCC6H4COOK,简写KHP相对分子质量为204.44)等。其中最常用的是邻苯二甲酸氢钾,滴定反应的化学方程式如下:
滴定终点时由于弱酸盐的水解,溶液呈碱性,所以应采用酚酞为指示剂,当溶液呈现微红色,30s内不褪色即为终点。
计算公式:
三、实验步骤
1.NaOH标准溶液的配制
经计算配制500ml 0.1 mol/L NaOH标准溶液需4g NaOH固体。
用台秤称量4g NaOH于1000ml烧杯中,用100ml量筒加入500ml水,并用玻璃棒搅拌溶解。
2.NaOH溶液浓度的标定
用分析天平精确称量0.5g左右的KHP三份,分别于250ml锥形瓶中,用100ml量筒加入30ml水,充分振荡使其完全溶解,滴加2滴酚酞指示剂。
用50ml碱式滴定管盛装NaOH标准溶液滴定至终点,记录消耗NaOH标准溶液的体积。
四、数据记录与处理(利用表中数据,练习数据处理)
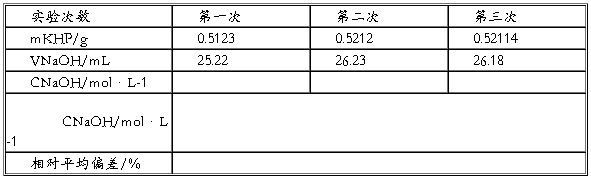
五、注意事项
1.称量邻苯二甲酸氢钾时,所用锥形瓶外壁要干燥并编号(以后称量同)。
2.NaOH饱和溶液侵蚀性很强,长期保存最好用聚乙烯塑料化学试剂瓶贮存(用一般的饮料瓶会因被腐蚀而瓶底脱落)。在一般情况下,可用玻璃瓶贮存,但必须用橡皮塞。
六、思考题
1.如果用H2C2O4·2H2O标定时,又如何操作?
2.标定时,三次滴定消耗标准溶液的体积之间,远超过容量分析允许的0.2%相对误差,即0.04ml,如此分析测定的结果能准确吗?
第二篇:实验 硫酸铜的提纯
硫酸铜的提纯
一、实验目的
1.了解用重结晶法提纯物质的基本原理。
2.练习托盘天平的使用。
3.掌握加热、溶解、蒸发浓缩、结晶、常压过滤、减压过滤等基本操作技术。
二、实验原理
硫酸铜为可溶性晶体物质。根据物质的溶解度的不同,可溶性晶体物质中的杂质包括难溶于水的杂质和易溶于水的杂质。一般可先用溶解、过滤的方法,除去可溶性晶体物质中所含的难溶于水的杂质;然后再用重结晶法使可溶性晶体物质中的易溶于水的杂质分离。
重结晶的原理是由于晶体物质的溶解度一般随温度的降低而减小,当热的饱和溶液冷却时,待提纯的物质首先结晶析出而少量杂质由于尚未达到饱和,仍留在母液中。 粗硫酸铜晶体中的杂质通常以硫酸亚铁(FeSO4)、硫酸铁[Fe2(SO4) 3]为最多。当蒸发浓缩硫酸铜溶液时,亚铁盐易氧化为铁盐,而铁盐易水解,有可能生成Fe(OH) 3 沉淀,混杂于析出的硫酸铜晶体中,所以在蒸发浓缩的过程中,溶液应保持酸性。 若亚铁盐或铁盐含量较多,可先用过氧化氢(H2O2)将 Fe2氧化为 Fe3,再调节溶液++的pH值约至4,使Fe3水解为Fe(OH) 3沉淀过滤而除去。 +
2Fe2 + H2O2 + 2H = 2Fe3 + 2H2O Fe3 + 3H2O = Fe(OH)3 + 3H +++++pH≈4
三、仪器和试剂
1.仪器 台秤(公用)、烧杯(100rnl) 、量筒、石棉网、玻棒、酒精灯、漏斗、滤纸、漏斗架、表面皿、蒸发皿、铁三脚、洗瓶、布氏漏斗、油滤装置、硫酸铜回收瓶。
2. 试剂 CuSO4 · 5H2O(粗)、H2SO4(1 rnol·L1)、H2O2(3%)、pH试纸、NaOH(0.5 -
mol·L1)。 -
四、实验内容
(-)称量和溶解
用台秤称取粗硫酸铜4g,放入洁净的100mL烧杯中,加入纯水20mL。然后将烧杯置于石棉网上加热,并用玻棒搅拌。当硫酸铜完全溶解时,立即停止加热。大块的硫酸铜晶体应先在研钵中研细。每次研磨的量不宜过多。研磨时,不得用研棒敲击,应慢慢转动研棒,轻压晶体成细粉末。
(二)沉淀
往溶液中加入3%H2O2溶液10滴,加热,逐滴加入 0.5mol·L1NaOH溶液直到 pH-
=4(用pH试纸检验),再加热片刻,放置,使红棕色 Fe(OH) 3沉降。用pH试纸(或石蕊试纸)检验溶液的酸碱性时,应将小块试纸放入干燥清洁的表面皿上,然后用玻璃棒蘸取待检验溶液点在试纸上,切忌将试纸投入溶液中检验。
(三)过滤
将折好的滤纸放入漏斗中,用洗瓶挤出少量水润湿滤纸,使之紧贴在漏斗壁上。将漏斗放在漏斗架上,趁热过滤硫酸铜溶液,滤液承受在清洁的蒸发皿中。从洗瓶中挤出少量水洗涤烧杯及玻璃棒,洗涤水也应全部滤入蒸发皿中。过滤后的滤纸及残渣投入废液缸中。
(四)蒸发和结晶
在滤液中滴入2滴1mol·L1H2SO4溶液,使溶液酸化,然后放在石棉网上加热,蒸发-
浓缩(切勿加热过猛以免液体溅失)。当溶液表面刚出现一层极薄的晶膜时,停止加热。静置冷却至室温,使CuSO4·5H2O充分结晶析出。
(五)减压过滤
将蒸发皿中CuSO4·5H2O晶体用玻棒全部转移到布氏漏斗中,抽气减压过滤,尽量抽干,并用干净的玻棒轻轻挤压布氏漏斗上的晶体,尽可能除去晶体间夹的母液。停止抽气过滤,将晶体转到已备好的干净滤纸上,再用滤纸尽量吸干母液,然后将晶体用台秤称量,计算产率。晶体倒入硫酸铜回收瓶中。
五、结果记录
粗硫酸铜的重量W1 = 精制硫酸铜的重量W2 = 。
思考题
1.粗硫酸铜溶解时,加热和搅拌起什么作用?
2.用重结晶法提纯硫酸铜,在蒸发滤液时,为什么加热不可过猛?为什么不可将滤液蒸干?
3.滤液为什么必须经过酸化后才能进行加热浓缩?在浓缩过程中应注意哪些问题?
4.在提纯硫酸铜过程中,为什么要加H2O2溶液,并保持溶液的pH值约为4?
5.为了提高精制硫酸铜的产率,实验过程中应注意哪些问题?
