实验:细胞培养
1.实验目的
初步掌握哺乳动物细胞的原代培养与传代培养的基本操作过程,为生物工程在医学上的应用打下基础。
2.实验原理
从生物体中取出某种组织或细胞,模拟体内生理条件,在人工培养条件下使其生存、生长、繁殖或传代,这一过程称为细胞培养。细胞培养技术的最大优点是使我们得以直接观察活细胞,并在有控制的环境条件下进行实验,避免了体内实验时的许多复杂因素,还可以与体内实验互为补充,可同时提供大量生物性状相同的细胞作为研究对象,耗费少,比较经济,因此成为生物学研究的重要手段。近年来,在体细胞遗传、分化、胚胎发生、肿瘤发生、免疫学、细胞工程、放射生物学以及老年学等一系列的研究领域中得到广泛的应用,并取得了丰硕的成果。
细胞培养可分为原代培养和传代(继代)培养。直接从体内获取的组织细胞进行首次培养为原代培养;当原代培养的细胞增殖达到一定密度后,则需要做再培养,即将培养的细胞分散后,从一个容器以1:2或其他比率转移到另一个或几个容器中扩大培养,为传代培养,传代培养的累积次数就是细胞的代数。
细胞培养是一种程序复杂、要求条件多而严格的实验性工作。所有离体细胞的生长都受温度、渗透压、pH值、无机盐影响,消毒、配液等均有严格的规范和要求,特别是无菌操作是细胞培养成败的关键。
3.实验用品
3.1 材料和标本 乳兔、HeLa细胞(人宫颈癌细胞)
3.2 器材和仪器 手术器械、平皿、培养瓶、吸管、离心管(灭菌后备用)、酒精灯、烧杯、超净工作台、二氧化碳培养箱、倒置显微镜。
2.3 试剂 含有5%小牛血清的MEM培养液、0.01mol/L PBS,0.25%胰蛋白酶一0.02%EDTA混合消化液、75%乙醇。
4.实验方法
4.1 原代细胞培养
4.1.1 原理
细胞培养(Cell culture)是模拟机体内生理条件,将细胞从机体中取出,在人工条件下使其生存、生长、繁殖和传代,进行细胞生命过程、细胞癌变、细胞工程等问题的研究。近年来,广泛地应用于分子生物学、遗传学、免疫学、肿瘤学、细胞工程等领域,发展成一种重要生物技术,并取得显著成就。由体内直接取出组织或细胞进行培养叫原代培养。原代培养细胞离体时间短,性状与体内相似,适用于研究。一般说来,幼稚状态的组织和细胞,如:动物的胚胎、幼仔的脏器等更容易进行原代培养。
4.1.2 操作
①.取材
用颈椎脱位法使乳兔迅速死亡。然后,把整个动物浸入盛有75%乙醇的烧杯中数秒钟消毒,取出后放在大平皿中携入超净台。用消过毒的剪刀剪开用碘酒和乙醇再次消毒后的皮肤,剖腹取出肝脏或肾脏。置于无菌平皿中。
②.切割
用灭菌的PBS液将取出的脏器清洗三次,然后用眼科手术剪刀仔细将组织反复剪碎,直到成1mm3左右的小块,再用PBS清洗,洗到组织块发白为止。移入无菌离心管中,静置数分钟,使组织块自然沉淀到管底,弃去上清。
③.消化、接种培养
吸取0.25%胰蛋白酶一0.02%EDTA混合消化液1ml,加入离心管中,与组织块混匀后,加上管口塞子,37℃水浴中消化8~10分钟,每隔几分钟摇动一下试管,使组织与消化液充分接触,静止,吸去上清,向离心管中加入5~10ml含5%小牛血清的MEM培养基,用吸管吹打混匀,移入二个培养瓶中,置于二氧化碳培养箱中培养。
4.1.3 结果
细胞接种后一般几小时内就能贴壁,并开始生长,如接种的细胞密度适宜,5天到一周即可形成单层。
4.2 传代细胞培养
4.2.1 原理
体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2或l:3以上的比率转移到另外的容器中进行培养,即为传代培养。
细胞“一代”指从细胞接种到分离再培养的一段期间,与细胞世代或倍增不同。在一代中,细胞培增3~6次。细胞传代后,一般经过三个阶段:游离期、指数增生期和停止期。
常用细胞分裂指数表示细胞增殖的旺盛程度,即细胞群的分裂相数/100个细胞。一般细胞分裂指数介于0.2%~0.5%,肿瘤细胞可达3~5%。细胞接种2~3天分裂增殖旺盛,是活力最好时期,称指数增生期(对数生长期),适宜进行各种试验。
4.2.2 操作
①.将长成单层的原代培养细胞或HeLa细胞从二氧化碳培养箱中取出,在超净工作台中倒掉瓶内的培养液,加入少许消化液。(以液面盖住细胞为宜),静置5~10分钟。
②.在倒置镜下观察被消化的细胞,如果细胞变园,相互之间不再连接成片,这时应立即
在超净台中将消化液倒掉,加入3~5ml新鲜培养液,吹打,制成细胞悬液。
③.将细胞悬液吸出2ml左右,加到另一个培养瓶中并向每个瓶中分别加3ml左右培养液,盖好瓶塞,送回二氧化碳培养箱中,继续进行培养。
4.2.3 结果
一般情况,传代后的细胞在2小时左右就能附着在培养瓶壁上,2~4天就可在瓶内形成单层,需要再次进行传代。
4.3 器材及液体的准备和无菌操作的注意事项
4.3.1 器材和液体的准备
细胞培养用的玻璃器材,如:培养瓶、吸管等在清洗干净以后,装在铝盒和铁筒中,120℃,2小时干烤灭菌后备用;手术器材、瓶塞、配制好的PBS液用灭菌锅15磅,20分钟蒸气灭菌;MEM培养液、小牛血清、消化液用G6滤器负压抽滤后备用。
4.3.2 无菌操作中的注意事项
在无菌操作中,一定要保持工作区的无菌清洁。为此,在操作前要认真地洗手并用75%乙醇消毒。操作前20~30分钟起动超净台吹风。操作时,严禁说话,严禁用手直接拿无菌的物品,如瓶塞等,而要用器械,如止血钳、镊子等去拿。培养瓶要在超净台内才能打开瓶塞,打开之前用乙醇将瓶口消毒,打开后和加塞前瓶口都要在酒精灯上烧一下,打开瓶口后的操作全部都要在超净台内完成。操作完毕后,加上瓶塞,才能拿到超净台外。使用的吸管在从消毒的铁筒中取出后要手拿末端,将尖端在火上烧一下,戴上胶皮乳头,然后再去吸取液体。总之,在整个无菌操作过程中都应该在酒精灯的周围进行。
5.实验报告
(1).原代细胞和传代细胞培养有哪些区别?
(2).总结一下你自己的经验,怎样才能既迅速,又保证无菌操作。
第二篇:原代细胞培养
原代细胞培养实验
实验目的和要求:
掌握无菌操作技术。
了解小鼠解剖操作技术。
了解原代细胞培养的一般方法与步骤
了解培养细胞的消化分散。
了解细胞计数方法。
了解倒置显微镜的使用。
实验原理:
原代细胞培养
是将机体内的某组织取出,分散成单细胞,在人工条件下培养使其生存并不断生长、繁殖的方法。借助这种方法可以观察细胞的分裂繁殖、细胞的接触抑制、以及细胞的衰老,死亡等生命现象。
实验内容:
动物的选择:
选择大约一半足孕时间的胚胎,10-13天龄胚胎含有最大数量的未分化的间质细胞,成纤维细胞可从这些细胞衍生获得。
每组小鼠胚胎1个
实验材料:
每组的超净台中有以下物品:
1. 50ml 配制好的RPMI1640培养液1瓶;8ml小牛血清(FCS) 1瓶;100ml 0.25%胰蛋白酶 1瓶;PBS(-)1 瓶
2. 100ml灭菌烧杯2个;
3、50ml离心筒2个
4、灭菌培养皿1个,细胞培养瓶1个
4、1ml ,200μl移液器各1支;枪头盒2个;无菌玻璃搅拌棒1个
5、细胞计数板1块;
6、灭好菌的镊子1把,剪刀1把;
7、酒精灯1台;
试验操作步骤:
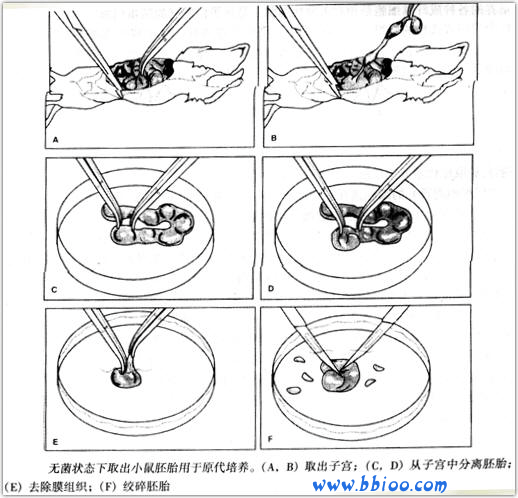
1)胚胎的分离。适用哺乳动物(仓鼠、小鼠和大鼠)
a.采用认可的方案处死啮齿动物。
b.立即在无菌超净台内用70%乙醇擦洗整个动物。
c.用无菌的镊子和剪子在前腿下作一腹部水平切口,用无菌镊子将皮肤扯向后腿。
d.用另一无菌的剪刀和镊子切开腹部,取出含有胚胎的子宫,置于无菌的培养皿上。
e.剔除胚胎周围的包膜,将胚胎放于无菌的含有无菌PBS的100ml烧杯中。
f.漂洗胚胎,去掉PBS。继续用PBS漂洗胚胎直至清洗液清亮为止。
2)将1-2个胚胎转移至一个小的无菌培养皿中,用新的无菌剪刀小心地绞碎胚胎, 用PBS漂洗。
3)在无菌状态下,将绞碎的胚胎转移于一50ml 的无菌离心筒中, 加入40ml 0.25%的无菌胰蛋白酶,用搅拌棒轻轻搅动 。
4)在温暖的环境中或置于37 °C培养箱中轻轻摇动15分钟。
5)让存留的组织块在重力作用下慢慢沉降,将含有悬浮细胞的液体转移至一无菌50ml的离心管中,该管内按照每10ml上清加入l ml小牛血清的比例加入牛血清以灭活,胰蛋白酶。
6)加人新鲜胰蛋白酶溶液(见前述步骤)于含有残留未消化组织块的原来的50ml离心筒中,重复步骤4和5。
7)离心混合的细胞悬液,1200r/rain,5分钟,弃上清。
8)用新鲜的无菌PBS重悬沉淀的细胞,按步骤7再次离心。
9)用PBS反复洗涤细胞直至上清清亮为止。
10)用含有10%牛血清和抗生素(如青霉素、链霉素)的DMEM(GIBCO/BRL)lOml再悬沉淀,并使终体积为20ml。
11)让残留的大块未破碎的组织或特殊颗粒物质沉降。可采用数层无菌纱布过滤细胞悬液以去除任何残留的细胞块。
12)为确定现有细胞浓度,加入0.2ml细胞悬液于1.8ml 1%醋酸溶液中以裂解红细胞,用血细胞计数器进行细胞计数。
13)按每细胞瓶I x 106细胞的数量接种于10ml组织培养液中,在饱和湿度的37°C CO2培养箱中孵育直至细胞铺满。