高中化学补充资料 元素周期律·碱土金属元素性质总结 化学必修2 第1章 第1节
元素周期律 碱土金属元素性质总结
I.元素周期律
1.周期表位置 IIA族(第2纵列),在2、3、4、5、6、7周期上均有分布。元素分别为铍(Be)-4,镁(Mg)-12,钙(Ca)-20,锶(Sr)-38,钡(Ba)-56,镭(Ra)-88。 2碱土金属的氢氧化物都是苛性较强的碱(除铍外),多存在于难用化学方法分解的化合物中,所以把它们被称为为碱土金属。
3.碱土金属在自然界均有存在且都以化合物的形式存在,前五种含量相对较多,镭为放射性元素,由居里夫妇在沥青矿中发现。由于它们的性质很活泼,一般的只能用电解方法制取。
II.物理性质
1.碱土金属单质皆为具金属光泽的银白色金属(铍为灰色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。常温下均为固态。 2.碱金属熔沸点均较低(但大于碱金属)。硬度略大于碱金属,莫氏硬度均小于5,质软(可用小刀切割,新切出的断面有银白色光泽,空气中迅速变暗)。.导电、导热性、延展性都较好。
3.碱金属单质的密度小(但大于碱金属),是轻金属。 随着周期的递增,卤族元素单质的物理递变性有:
1.金属光泽逐渐增强。2.熔沸点逐渐降低。3.密度逐渐增大。硬度逐渐减小。
4.碱土金属元素晶体结构随着原子序数的增大呈现出六方密堆积→面心立方堆积→体心立方堆积的结构变化 1.铍呈现灰色,属于轻稀有金属。2.铍和镁没有焰色反应。3.碱土金属熔沸点存在不规律性
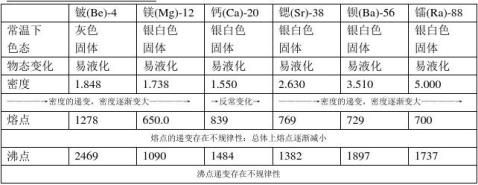
碱土金属熔点不规律变化的原因:影响熔点的因素有:1.价电子2.原子半径3.金属晶格结构 对碱土金属来讲,晶格结构不很规律,Be,Mg为六方晶格(配位数为12),Ca\Sr为面心立方晶格(配位数12),Ba体心立方晶格(配位数8),因此变化存在不规律性
1.碱土金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色(除铍、镁),这可以用来鉴定碱土金属离子的存在。钙、锶、钡可用焰色反应鉴别。
2.电子跃迁可以解释焰色反应,一些碱土金属离子的吸收光谱落在可见光区,因而出现了标
1
高中化学补充资料 元素周期律·碱土金属元素性质总结 化学必修2 第1章 第1节
志性颜色。

III.化学性质
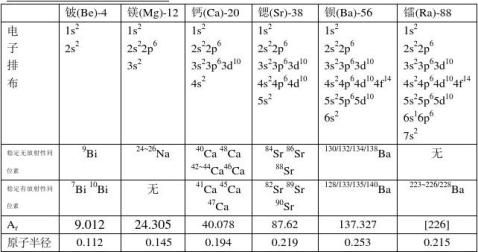
1.最外层均有2个电子 2.单质均为单原子分子,化学性质活泼。 3.在化学反应中易失2个电子形成离子。 4.与典型的非金属形成离子化合物(除铍外)。 1.原子半径逐渐增大,相对原子质量逐渐增大。原子核对外层电子的引力逐渐减弱。 2.电子层逐渐增多,原子序数(核电荷数、质子数、核外电子数)逐渐增大。 3.金属性性随周期数递增而增强。 1.铍的原子化学特性:
(1)原子半径和离子半径特别小(不仅小于同族的其它元素,还小于碱金属元素) (2)电负性又相对较高(不仅高于碱金属元素,也高于同族其它各元素)
结论:铍形成共价键的倾向比较显著,不像同族其它元素主要形成离子型化合物。铍常表现出不同于同族其它元素的反常性质。
铍由于原子化学特性所形成的反常性质归结于下:
(1)铍由于表面易形成致密的保护膜而不与水作用,而同族其它金属镁、钙、锶、钡均易与水反应。
(2)氢氧化铍是两性的,而同族其它元素的氢氧化物均是中强碱或强碱性的。
(3)铍盐强烈地水解生成四面体型的离子[Be(H?O)?],Be-O键很强,这就削弱了O-H键,因此水合铍离子有失去质子的倾向:因此铍盐在纯水中是酸性的。而同族其它元素(镁除外)的盐均没有水解作用。
2.镭的所有同位素均具有放射性。
2
高中化学补充资料 元素周期律·碱土金属元素性质总结 化学必修2 第1章 第1节
1.单质都有还原性(相似性)原因:最外层都有2个电子,决定了在化学反应中易失电子,从而表现出还原性,还原性自上而下增强,金属性自上而下增强 原因:碱土金属位于第二主族,越往下走电子层数依次增加,原子核对最外层电子的束缚力越来越小,所以越容易失电子。
2.离子具有弱氧化性。
3. 与其他元素化合时,一般生成离子型的化合物。但Be和Mg离子具有较小的离子半径,在一定程度上容易形成共价键的化合物。
普通氧化物
碱土金属在室温或加热时与氧化合,主要生成普通氧化物MO:
反应通式:2M+O2=2MO
但实际生产中常由它们的碳酸盐、硝酸盐或氢氧化物等加热分解来制备。例如
反应通式:MCO3=MO+CO2↑
氧化物的性质:碱土金属的氧化物均是难溶于水的白色粉末。除BeO为ZnS型晶体外,其余MO都是NaCl型晶体。由于阴、阳离子都是带有两个单位电荷,而且M-O核间距又较小,所以碱土金属氧化物具有较大的晶格能,因此它们的熔点都很高、硬度也较大。 注意1:在空气中,镁表面生成一薄层氧化膜,这层氧化物致密而坚硬,对内部的镁有保护作用,所以有抗腐蚀性能,可以保存在干燥的空气里。钙、锶、钡等更易被氧化,生成的氧化物疏松,内部的金属会继续被氧化,所以钙、锶、钡等金属要密封保存。
注意2:钡和氧气加热下反应除了得到氧化钡,还能得到过氧化钡(过氧化钡可以吸氧、放氧,用来提取大气中的氧气)
过氧化物
钙、锶、钡的氧化物与过氧化氢作用,可得到相应的过氧化物:
反应通式:MO+H2O2+7H2O=MO2·8H2O
钙、锶、钡燃烧可生成过氧化物
反应通式:M+O2=点燃=MO2
反应通式:M+2H2O=M(OH)?+H?↑
注意:铍表面生成致密的氧化膜,与水不反应。镁跟热水反应,钙、锶和钡易与冷水反应。 共同现象:放出热量,生成可燃气体(氢气),反应后向水中滴加酚酞变红。
反应通式:M+X?--→MX?
碱土金属可和卤素(例如:氯)反应,产生离子化合物。不过铍的卤化物是共价化合物,不是离子化合物。其中越重的元素就反应得越剧烈。
点燃反应通式:3X+N2=X3N2
铍、镁、钙在常温下不与氮反应,要到一定的温度下,才和氮气反应生成氮化物。而锶、钡、镭遇到空气,其表面就失去金属光泽,不仅形成氧化物,也形成氮化物。氮化物含有氮离子,游离态氮化物稳定,但在水溶液中迅速水解生成氨气和氢氧化物。
高温反应通式:2X+H2=2XH 钙、锶和钡能与氢气反应。
1.碱土金属的氢化物均为气态,H显-1价。
2.碱土金属氢化物与水剧烈反应放出氢气MH+H2O=MOH+H?
3
高中化学补充资料 元素周期律·碱土金属元素性质总结 化学必修2 第1章 第1节
反应通式:2H++M=M2++H?↑ 置换反应
1.碱土金属的氧化物(BeO和MgO外)与水作用,即可得到相应的氢氧化物。碱土金属的氢氧化物均为白色固体,易潮解,在空气中吸收CO2生成碳酸盐。
2.碱土金属氢氧化物的溶解度较低,其溶解度变化按压Be(OH)2→Ba(OH)2的顺序依次递增,Be(OH)2和Mg(OH)2属难溶氢氧化物。
3.碱土金属氢氧化物溶解度依次增大的原因是随着金属离子半径的递增,正、负离子之间的作用力逐渐减小,易被水分子所解离的缘故。
4.在碱土金属的氢氧化物中,Be(OH)2呈两性,Mg(OH)2为中强碱,其余都是强碱。 常见碱土金属的盐类有卤化物、硝酸盐、硫酸盐、碳酸盐、磷酸盐等
1.晶体类型
绝大多数碱土金属盐类的晶体属于离子型晶体,它们具有较高的熔点和沸点。常温下是固体,熔化时能导电。碱土金属氯化物的熔点从Be→Ba依次增高,BeCl2熔点最低,易于升华,能溶于有机溶剂中,是共价化合物,MgCl2有一定程度的共价性。
2.颜色
碱土金属离子都是无色的,它们盐类的颜色一般取决于阴离子的颜色。无色阴离子与之形成的盐一般是无色或白色的;有色明离子与之形成的盐则具有阴离子的颜色。
3.溶解性
碱土金属的盐比相应的碱金属盐溶解度小,有不少是难溶解的,这是区别碱金属的特点之一。碱土金属的硝酸盐、氯酸盐、高氯酸盐和醋酸盐等易溶。卤化物中除氟化物外,也是可溶的。但是碳酸盐,磷酸盐和草酸盐等都难溶于水。对于硫酸盐和铬酸盐来说,溶解度差别较大,例如:BeSO4、MgSO4、BeCrO4和MgCrO4易溶,其余全难溶(CaSO4微溶)。尤其BaSO4和BaCrO4是溶解度最小的难溶盐之一。CaC2O4(白色)、SrCrO4(白色)和BaCrO4(黄色)的溶解度也很小,反应又很灵敏,可用作Ca、Sr或Ba离子的鉴定。铍盐有许多是易溶于水的,这与Be的半径小,电荷较多,水合能大有关。
4.存在形式
在自然界中,碱土金属的矿石常以硫酸盐、碳酸盐的形式存在,例如白云石CaCO3·MgCO3,方解石(大理石)CaCO3、天青石SrSO4、重晶石BaSO4等等。
元素周期表中,碱金属锂与位于其对角线位置的碱土金属镁存在一定的相似性,这里体现了元素周期表中局部存在的"对角线规则"。
锂与镁的相似性表现在:
1.单质与氧气作用生成正常氧化物
2.单质可以与氮气直接化合(和锂同族的其它碱金属单质无此性质)
3.氢氧化物为中强碱,溶解度小,加热易分解
4.氟化物、碳酸盐、磷酸盐难溶于水
5.碳酸盐受热易分解
锂-镁对角线规则可以用周期表中离子半径的变化来说明:同一周期从左到右,离子半径因有效电荷的增加而减少,同族元素自上而下离子半径因电子层数的增加而增大,锂与镁因为处于对角线处,镁正好在锂的"右下方",其离子半径因周期的递变规律而减小,又因族的递变规律而增大,二者抵消后就出现了相似性。
碱土金属盐的热稳定性较碱金属的差,但常温下也都是稳定的(除BeCO3外)。碱土金属的 4
高中化学补充资料 元素周期律·碱土金属元素性质总结 化学必修2 第1章 第1节
碳酸盐在强热的情况下,才能分解成相应的氧化物MO和CO2,碳酸盐的热稳定性依Be→Ba的顺序递增,因为按此顺序离子极化力减弱。
铍通常是用金属镁在大约1300℃下还原BeF2来制取的,也可以用电解熔融BeCl2(加入碱金属氯化物作助熔剂)的方法制得。镁是所有这族金属中生产规模最大的金属,世界年产量在几十万吨以上。
电解法和硅热还原法是工业上生产镁的主要方法。电解法是在750℃的温度下,通过电解熔融的MgCl2而获得镁。硅热还原法则是在减压和1150℃的温度下,用硅铁与煅烧过的白云石进行反应而制得镁:
2(MgO·CaO)+FeSi==2Mg+Ca2SiO4+Fe
钙、锶、钡都可以用其氯化物进行熔盐电解制得,锶和钡还可以用金属铝在高温和真空条件下还原其氧化物制得。
5
第二篇:酸碱盐性质总结
酸碱盐的性质总结
2
(1)碱溶液能跟酸碱指示剂起反应,紫色石蕊试液遇碱变蓝,无色酚酞试液遇碱变红。不溶性碱,如不能使酸碱指示剂变色。
(2)碱能跟酸性氧化物起反应生成盐和水。
(3)碱能跟酸起中和反应生成盐和水。
(4)碱能跟某些盐起反应生成新碱与新盐。
常见的碱有NaOH、KOH、Ca(OH)2、氨水等,它们各自具有一些特性。
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CONaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH ②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH ③氨水(NH3?H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为:
2NH3 + 3CuO 3Cu + N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
3、盐的性质
(1) 盐跟某些金属反应生成新的金属和新的盐。例如:
①Zn+CuSO4 === ZnSO4+Cu
②Cu+Hg(NO3)2 === Cu(NO3)2+Hg
只有排在金属活动性顺序表前面的金属才能把排在后面的金属从它们的盐溶液里置换出来。
(2) 盐跟酸反应生成新酸与新盐。例如:
BaCl2+H2SO4=BaSO4↓+2HCl;
(3) 盐跟碱反应生成新盐与新碱。例如:
①MgSO4+2NaOH=Mg(OH)2↓+Na2SO4;
②MgSO4 + Ba(OH)2 == BaSO4↓+ Mg(OH)2↓
(4) 盐跟另一种盐反应生成两种新盐,例如:
2AgNO3+Na2CO3 === Ag2CO3↓+2NaNO3
也有例外,如:Al2(SO4)3 + 6NaHCO3 == 2Al(OH)3↓+ 6CO2↑+ 3Na2SO4。
(5) 不溶性碳酸盐,高温下可分解生成对应金属氧化物和二氧化碳气体。
①CaCO3 CaO + CO2↑, ②BaCO3 BaO + CO2↑;
②Cu2(OH)2CO3(绿色) 2CuO + H2O + CO2↑。
常见的盐有NaCl、Na2CO3、NaHCO3、CuSO4、KMnO4、铵盐等。它们的特性和重要用途如下: ①NaCl是食盐的主要成分。粗盐中除NaCl外,还有MgCl2、CaCl2等,这是粗盐在空气中易潮解的原因。
②Na2CO3俗名纯碱、苏打,是白色粉末状物质,易溶于水,其水溶液显碱性。自然界某些盐湖出产的Na2CO3俗称口碱。碳酸钠晶体的化学式为:Na2CO3?10H2O,在常温时在干燥的空气中易风化而失去部分水份。
③NaHCO3是白色细小的固体,俗名小苏打,能溶于水,但溶解度比Na2CO3小,其水溶液显弱酸性。NaHCO3热稳定性差,受热易分解:
2NaHCO3 Na2CO3+CO2↑+H2O
不管是Na2CO3还是NaHCO3都可与酸反应产生CO2气体:
Na2CO3+2HCl=2NaCl+CO2↑+H2O,
NaHCO3+HCl=NaCl+CO2↑+H2O。
在饱和的Na2CO3溶液中通入二氧化碳气体,也可生成NaHCO3。
利用上述反应可以制备CO2,也可鉴别CO32-或HCO3-离子。NaHCO3在医疗上用于治疗胃酸过多。
④CuSO4是一种白色固体,能溶于水,其水溶液呈蓝色,硫酸铜晶体的化学式是CuSO4?5H2O是一种蓝色晶体,俗称胆矾或蓝矾。胆矾受热能失去结晶水,变为白色的CuSO4。
⑤铵盐是含有铵根离子(NH4+)的盐。NH4Cl、(NH4)2SO4、NH4NO3、NH4HCO3等都属于铵盐。铵盐都可作氮肥,易溶于水。铵盐都能与碱微热后反应产生NH3,如:
Ca(OH)2 + (NH4)2SO4 == CaSO4 + 2NH3↑+2H2O
2NH4H2PO4 + 3Ca(OH)2 == Ca3(PO4) 2↓(白色)+ 2NH3↑+ 6H2O
NH3能使湿润的红色石蕊试纸变蓝,利用这一性质可检验含铵根离子(NH4+)的盐。同时要注意铵盐与碱性物质如石灰、草木灰(主要成分是K2CO3)混合使用,以免降低肥效。NH4HCO3在常温下分解生成氨气、水和二氧化碳气体,从而失去肥效。
⑥KMnO4是一种紫黑色的固体,易溶于水,其水溶液呈紫红色,常用作消毒剂。高锰酸钾与浓硫酸混合后,生成了具有极强氧化性的七氧化二锰,七氧化二锰遇酒精时,发生剧烈的氧化还原反应,而使酒精灯点燃。
其反应方程式为:2KMnO4+ H2SO4 === K2SO4 + Mn2O7 + H2O
