金属钠的性质与应用


《金属钠的性质与应用》
学习目标:
1、 用实验的方法探索和认识钠的物理性质和化学性质。
2、 了解钠的用途和存在;
3、 通过实验探究和问题讨论的过程,了解实验研究化学物质的一般方法,初步形成推理、综合归纳的能力。
学习重点 钠的化学性质
学习难点 对实验现象的观察和分析
学习方法 情景设计、实验探究、分析、归纳
学习用具
1、阅读材料、多媒体课件及辅助设备
2、仪器及药品:小烧杯、玻璃片、小刀、镊子、滤纸、酒精灯、铁架台、钠、蒸馏水、酚酞试液、盛有蒸馏水的小烧杯、石棉网、火柴盒
课前预习
回忆金属有哪些通性?(以金属铁为例)
可以在氧气中燃烧,可以与酸反应
学习过程: 【导入】在准备今天的课时,我在网上找到了这样一段资料,请同学们阅读资料并回答问题。
生:阅读信息材料《炸起千层浪 珠江“水雷”谜团待解》。讨论并回答问题。 得出关键信息:①金属桶,②亮黄色火苗,③遇水爆炸。 师:引起爆炸的物质是什么?原因是什么?
生:含有钠元素的物质。(窜起亮黄色火苗)
师:很好,我们看到了火焰的颜色,回顾前面讲到的焰色反应,可以推断出其中一定含有钠元素。那么,会不会是我们常见的钠盐和碱(氢氧化钠)。其实,经过我们的专家进一步研究,发现是金属钠。
【过渡】钠为什么会出现爆炸呢?钠究竟是一种什么样的物质?它有哪些性质呢?那么,这节课我们首先来认识一下金属钠这一物质。
【板书】金属钠的性质与应用
师:请同学们回忆,我们前面的学习中,有没有接触到金属钠? 生:有,在氯气的学习中,金属钠能与氯气反应。
【视频演示实验】金属钠与氯气反应。
【实验现象】剧烈燃烧,有白烟生成
【板书】2.化学性质
(2)与氯气反应 2Na+Cl2 2NaCl
师:那么,金属钠还有哪些性质呢?请同学们通过以下三个实验的探究,总结归纳出金属钠的性质,包括物理性质和化学性质。
【学生实验】
1、用镊子取出一小块钠,用滤纸吸干表面的液体,用小刀切去一端的表层,观察表面的颜色。将其放置在空气中,观察表面颜色的变化;提醒学生剩余的钠必须放回原瓶。
2、在石棉网上,放入一小块钠加热,观察实验现象。
3、在烧杯中加200mL水,用镊子取一小块(约米粒般大小)金属钠,用滤纸吸干表面煤油,投入到小烧杯中,盖上表面皿,反应结束后,加几滴酚酞溶液,观察实验现象。
【现象总结】
1、颜色——银白色;状态——固体;质地——较软;放置在空气中,钠表面变暗,失去金属光泽。
2、钠在空气中燃烧,发出黄色火焰,在石棉网上有淡黄色的固体残留。
3、(1)钠熔成一个光亮的小球,浮在水面上;(2)小球四处游动,并发出嘶嘶响声;(3)小球逐渐变小,最后消失;(4)溶液变红。
师:通过实验,我们的同学们能否总结出金属钠的物理性质呢? 【板书】2.物理性质
颜色——银白色;状态——固体;质地——较软;导电导热性——能够导电导热
师:另外,我们发现金属钠放置在空气中,发生什么变化了啊? 生:发生了反应。
师:刚才我们看到钠表面变暗,是因为钠在空气中被氧气缓慢氧化成氧化钠,请同学们写出钠在空气中被缓慢氧化的化学方程式。
生:学生板演。
【板书】 (1)与氧气反应 常温 4Na + O2 == 2Na2O(白色固体)
师:金属钠与氧气加热反应后,我们观察到的实验想象和产物与金属钠在空气中生成的产物是否一致呢?
生:不一样。
师:这说明金属钠与氧气在加热的条件下,生成了不同于氧化钠的物质。这个淡黄色固体是一种新的物质过氧化钠Na2O2。请同学们写出反应方程式。可见条件变化产物也不同,请同学们分别标出化合价。
生:学生板演。
【板书】 点燃 2Na +O2 2Na2O2(淡黄色固体)
师:【过渡】虽然钠很活泼,但和氧气反应并没有出现资料中所说的爆炸? 生:没有。金属钠要遇到水才会爆炸。
师:钠遇到水究竟会怎样呢?有什么现象?这些现象说明钠的哪些性质? 生:学生讨论并回答。
(1)钠熔成一个光亮的小球,浮在水面上——说明钠的熔点低、密度比水小。 【教师在物理性质中补充板书:熔点低、密度比水小。】
(2)小球四处游动,并发出嘶嘶响声——说明有气体放出,推动小球四处游动。 (3)小球逐渐变小,最后消失。
生:溶液变红——说明有碱性物质NaOH生成。
师:那么钠和水反应生成的气体可能是什么,怎么检验呢?
生:可能是H2或O2。可以用一支小试管收集,靠近火焰,若能产生轻微的爆鸣声则是H2。
师:很好。那么现在请大家写出化学方程式。
生:学生板演。
【板书】(3)与水反应 2Na+2H2O==2NaOH+H2↑
师:由于金属钠的活泼性,钠除了能和水反应以外,还能发生置换反应,也能和酸发生反应。
【板书】(4)置换反应 TiCl4+4Na Ti+4NaCl
(5)与酸反应 2Na+2HCl=2NaCl+H2 ↑
师:通过刚才的实验探究学习,我们已经了解钠的有关性质了。那么,现在再来想想看,为什么“水雷”会爆炸呢?
生:当钠遇到水释放出大量H2,同时释放出大量的热。由于H2的着火点相当低,大量的钠在水里迅速的化学反应就会产生剧烈的爆炸。
师:我们知道了“水雷”为什么会爆炸。现在我们来看看还有一个急待解决的问题那就是还有5个金属桶在水中,该怎么处理?请同学们讨论一下,假如你是现场指挥,你怎么做?
生:学生讨论。
师:看看当时的工作人员如何处理的。(展示相关图片资料)
【过渡】这篇报道就到这里结束了,剩下的5桶金属钠已经安全收回。那么同学们可能会想这些钠究竟有哪些用途呢?在运输和保存中应该注意哪些问题呢?请同学们阅读课本。
师:指导学生阅读教材。
生:学生总结(教师同时展示相关图片)
【板书】 二、金属钠的用途、保存和存在
1、用途:
(1)制备钠的化合物(2)钠和钾的合金可做原子反应堆的导热剂
(3)高压钠灯 (4)还原贵重金属
2、金属钠的保存
保存在煤油里;不能保存在无水酒精里,原因是金属钠可以与无水酒精进行化学反应。
3、金属钠的存在
由于金属钠的活泼性,在自然界中金属钠的存在都是以化合价态的形式。
【总结】一、物理性质
二、化学性质
1、与非金属反应(O2,Cl2,S等) 2、与水反应
3、发生置换反应(钛,钽,铌,锆等金属氯化物) 4、与酸反应
三 钠的用途、保存与存在形式
作业布置 学案后的练习巩固
板书设计
金属钠的性质与应用
一、钠的物理性质
钠的物理性质:
银白色金属,质软,有延展性,导电,导热,熔、沸点低,密度小
二、钠的化学性质
1、与氧气反应 常温:4Na + O2 = 2Na2O (白色)
点燃:2Na +O2 2Na2O2(淡黄)
2、与氯气反应 点燃:2Na+Cl2 2NaCl
3、与水反应 现象:“浮”、 “熔”、 “游”、 “响”、 “红”
2Na + 2H2O = 2NaOH + H2↑
4、置换反应: 2NaCl(熔融) 2Na+Cl2↑
5、与酸反应: 2Na+2HCl=2NaCl+H2 ↑
三、钠的用途、保存和存在形式
1、钠的用途: 制备钠的化合物;钠钾合金可做原子反应堆的导热剂
高压钠灯;还原贵重金属
2、钠的保存:
保存在煤油里;不能保存在无水酒精中,金属钠可以与无水酒精进行
化学反应。
3、钠的存在: 均以化合价态的形式存在。
【信息材料】 炸起千层浪 珠江“水雷”谜团待解
20xx年7月7日,在珠江石溪附近,飘着七个白色的来历不明的金属桶。突然,从飘在水面上的一个金属桶内冒起一股白烟,窜起亮黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起,这个铁桶接着又连续爆炸了多次,爆炸腾起的白色烟雾有近十米高,还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就不停地冒泡,有时甚至还突然着火。
据悉,其中另有一金属桶被过往船只发现,并将其打捞上船,打算清洗后使用,但当船员把盖子打开后,桶内冒起浓浓白烟,一接触桶内物质,双手立即感到剧烈地疼痛,于是他们又将其推入江里,一遇水,这个桶就又爆炸了。所幸该船只迅速逃离,伤亡不大。
珠江水面上尚有五个一触即发的“水雷”漂浮着,消防队员、民警及广州化工集团的化学品专家赶来凑在一起,紧张地调查爆炸物的性质及研究“水雷”的处置对策。
【交流与讨论】
1、 引起爆炸的物质是什么?(根据相关内容与我们学习过的物质检验方法结合判断)
2、 为什么会发生爆炸(金属桶为什么会成为“水雷”,什么物质在爆炸?) 3、 如何防止爆炸(另五个没有爆炸的金属桶如何处理?)
4、 事故的启示。(物质的保存、运输及事故处理方法?)
第二篇:苏教版必修1高中化学专题二第二单元第一课时金属钠的性质与应用备课参考
第二单元 钠、镁及其化合物
第一课时 金属钠的性质与应用

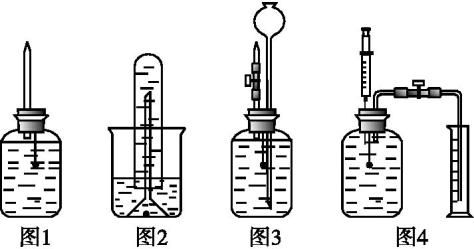
“金属钠与水反应”实验装置的改进方法 “金属钠与水反应”是中学化学中体现和培养观察能力、由现象分析结论的思维能力的重要范例,也是高考经常涉及的重要基础实验,对它的改进极为重要。教材介绍的“金属钠与水反应”实验可以使同学们很清楚地观察到实验现象,但却无法收集到产生的氢气,怎样改进呢?
方法1:图1是在课本实验的基础上略作改进,在塑料瓶的橡皮塞口上加了一尖嘴管和固定一根大头针,钠块扎在大头针上,反应时向下压大头针,使Na块接触水面。反应后在尖嘴管处点燃气体。
方法2:利用图2装置进行实验时,将钠块用铝箔包好后再用铜网裹住(防止钠块浮起),置于倒扣的漏斗内,即可用排水法收集一试管气体用于点燃。
方法3:利用图3装置进行实验时,将广口瓶中盛满水,在胶塞上固定一根大头针,将钠块扎在大头针上,迅速用胶塞塞住瓶口,产生的气体将水压入长颈漏斗中,反应结束后,打开止水夹即可在尖嘴管处点燃气体。
方法4:图4的原理类同于图3,将广口瓶中盛满水,取一小块钠,将其插在大头针上,在注射器中吸入1~2 mL酚酞。实验时,把止水夹打开,把插有钠和注射器的橡皮塞迅速插入瓶口,并塞紧。钠与水剧烈反应,广口瓶中的水沿导管流入量筒。反应完毕,将注射器中的酚酞推入塑料瓶,溶液变红。更换50 mL注射器,抽取瓶内的气体。抽气后将注射器移近火焰,匀速推出气体,针头处立即燃起细长的火焰。
1
