金属的物理性质和化学性质
(一)金属的物理性质及其用途
(二)常见金属的化学性质
1.金属与氧气反应
2.金属与水发生反应
3.金属与酸发生反应
4.金属与某些盐溶液发生反应
(三)置换反应
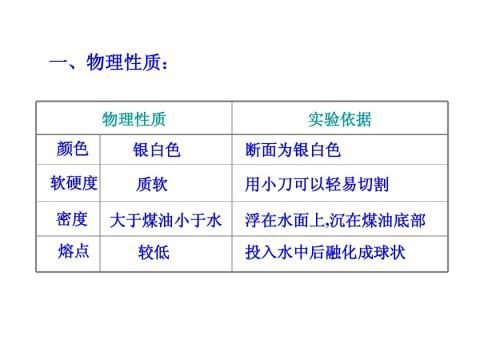
一、钠的物理性质
银白色金属,质软,密度比煤油大、0.97g/cm3。
二、钠的化学性质
1.可与氧气发生反应,钠与氧气反应分两种,一种是在氧气中燃烧,剧烈燃烧生成淡黄色的过氧化钠 ;一种是在常温下与氧气反应,生成白色的氧化钠。
4Na+O2=2Na2O(白色)
2Na+O2= Na2O2(过氧化钠,淡黄色)
同样是钠与氧气反应,但是反应条件不同时,现象不同,产物也不同,过氧化钠比氧化钠稳定。氧化钠可以和氧气化合成为过氧化钠。
2Na2O+O2=2Na2O2
2、钠与水的反应
现象:浮、游、球、响、红
原因:1、钠浮在水面上(钠的密度比水小) 2.钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低) 3.钠在水面上四处游动(有气体生成) 4.发出嘶嘶的响声(生成了气体,反应剧烈)
化学方程式:2Na+2H2O=2NaOH+H2↑
离子方程式:2Na+2H2O=2Na+ +2OH-+H2↑
钠的化学性质很活泼,所以它在自然界里不能以游离态存在,因此,在实验室中通常将钠保存在煤油里.
3. 钠能跟卤素、硫、磷、氢等非金属直接发生反应,生成相应的化合物,如
2Na+Cl2=2NaCl
2Na+S=Na2S(硫化钠)(跟硫化合时甚至发生爆炸
4、钠与酸反应:钠与酸溶液反应钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na+2HCl=2NaCl+H2↑如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应
5、钠与盐反应(1)与盐溶液反应将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(2)与熔融盐反应这类反应多数为置换反应,常见于金属冶炼工业中,如4Na+TiCl4(熔融)=4NaCl+Ti(条件为高温)Na+KCl=K+NaCl(条件为高温)★钠与熔融盐反应不能证明金属活动性的强弱
三:钠的制取:制取
通过电解熔融的氯化钠(食盐)或熔融氢氧化钠制得。反应方程式:熔融状态下,2NaCl(通电)=2Na+Cl2↑2NaOH(通电)=2Na+O2↑+H2↑
四:焰色反应:钠离子能使火焰呈黄色,可用来灵敏地检测钠的存在(因为焰色的反应原理不是化学现象,而是物理现象
微观世界中,他并没有分子和原子自由移动,从新组合。就跟水变成汽,不是化学反应,而是物理反应原理一样。)
1 焰色反应的操作步骤:①将铂丝蘸稀盐酸在无色火焰上灼烧至无色;②蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧,观察火焰颜色(若检验钾要透过蓝色钴玻璃观察,因为大多数情况下制钾时需要用到钠,因此钾离子溶液中常含有钠离子,而钠的焰色反应为黄色,黄色与少量的紫色无法分别出来).③将铂丝再蘸稀盐酸灼烧至无色,就可以继续做新的实验了。
(1).金属钠露置在空气中的变化过程:
银白色金属钠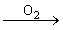

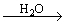

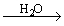

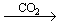
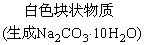
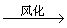
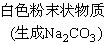
钠的用途(ppt 4)
1.做还原剂:用以将钛、锆、铌、钽等在国防工业上有重要用途的金属从其熔融的卤化物中还原出来。
TiCl4+4NaTi+4NaCl
四氯化钛 钛
2.做电光源:高压钠灯。
3.制造合金:钠钾合金用做核反应堆的冷却剂和热交换剂。
4.做化工原料。
1.金属钠应保存在( )
A.空气中 B.水中 C.煤油中 D.密闭容器中
答案:C。
2.钠应用于电光源是因为( )
A.钠很软 B.高压钠灯发出的黄光射程远,透雾力强
C.是一种强还原剂 D.那燃烧发出黄色火焰
答案:B。
3.钠与水反应时产生的现象是( )
①钠浮在水面上; ②钠沉在水底; ③钠熔化成小球; ④钠迅速游动逐渐减小,最后消失; ⑤发出嘶嘶的声音; ⑥滴入酚酞后溶液显红色。
A. ②③④⑤ B. ①②③④⑤⑥ C. ①③④⑤ D. ①③④⑤⑥
答案:D。
4.将2.3g钠放入100g水中,所得溶液的质量分数是(不考虑水的挥发)( )
A.等于2.3% B.等于4% C.大于2.3% ,小于4% D.不能确定
答案:B。
5.将1克的下列金属,分别与足量的盐酸反应,放出氢气最多的是( )
A.锌 B.铁 C.铝 D.钠
答案:C。
6.关于Na原子和钠离子的下列叙述不正确的是( )
A.它们相差1个电子层 B.它们的化学性质相似
C.钠原子的半径比钠离子大 D.它们核内的质子数相同
答案:B。
7.一块表面已被氧化的钠,质量为10.8g,将其放入100mL水中,可收集到标准状况下2.24L气体,则钠元素的质量分数为?
答案:钠元素的质量分数为42.6%。
在进行钠和水的反应实验中,有如下操作和实验现象,请根据钠的性质解释说明。
(1)刚用小刀切开的金属钠断面呈_______色,在空气中放置几分钟后发生的变化为______________。
(2)切下来的金属钠块要用滤纸擦净后方可放入水中实验,这是因为________________。
(3)金属钠块必须用_______夹取,而不能用手拿取,理由是________________________。
(4)金属钠块投入水中后,钠很快熔成一个闪亮的小球并浮于水面上,这是因为____
__ _。
(5)钠小球在水面上迅速游动,这是因为_____________________________________,反应容器的上方弥漫着"白色物",它的主要成分是___________________________________。
(6)如果水中在未加钠之前已滴入酚酞试溶,反应后溶液由无色变为_____________________色,理由是____________________________。
2. 红热的铁能与水蒸气反应,有氢气生成,根据下图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集,检验生成氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式_______________________________。
(2)干燥管C内盛放的药品是_______或______。干燥管的________(m或n)端与g导管相连接。
(3)在D处画出用简单方法用试管来收集氢气的装置图(所需其他仪器自己选择)。
(4)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象___________________。
3. 钠与水反应时的现象与钠的下列性质无关的是( )
A.Na的熔点低 B.Na的硬度小 C.Na的密度小 D.有强还原性
4.将一小块Na投入足量的CuSO4溶液中,现象是( )
A.置换出金属铜 B.产生气体,置换出金属铜
C.生成蓝色沉淀 D.产生气体,生成蓝色沉淀
5.将质量为mg的铁片放入CuSO4溶液中,过一会儿取出干燥,铁片的质量变为ng,则被氧化的铁的质量是
A.8(n-m)g B.8(m-n)g C.7(m-n)g D.7(n-m)g
6.将2.3g金属钠投入100g水中,反应结束后,溶液中溶质的质量分数计算式表示正确的是( )
A.2.3/100×100% B.4/(100+2.3-0.1)×100%
C.4/(100+2.3)×100% D.4/(4+100-1.8)×100%
7. 在实验室里做钠跟水反应的实验时,用到的仪器是( )
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵 g.烧杯 h.坩埚 i.石棉网 j.玻璃片 k.药题 l.燃烧匙
A. abdi B. ecfk C. fghl D. bcegj
8. 往烧杯内注入煤油和水各100mL,静置后将一小块钠投入烧杯内。(已知钠的密度介于煤油和水之间,且水和煤油互不相溶)发生的现象是
A.钠沉到液柱1/2处,钠块下部有许多气泡放出,附有气泡的钠块徐徐上升到液体表面,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个光亮的小球,小球四处浮动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
9.已知煤油的密度是0.8g·cm-3,试根据金属钠的保存方法和与水反应的现象,推测金属钠的密度是( )
A.大于1.0g·cm-3
B.小于0.8g·cm-3
C.介于(0.8-1.0)g·cm-3之间
D.无法推测
10.室温下,氢氧化钠的溶解度为22g,将多少g金属钠投入100g水中,可获得该温度下的饱和溶液?
11.将2.3g金属钠放入多少克水中,反应完全后,溶液中Na+与H2O分子的个数比为1:50,最后溶液中水的质量为多少?
12.一块表面已部分被氧化成氧化钠的钠块质量为1.08g,投入到100g水中,完全反应后收集到0.02gH2。
求: (1)未被氧化的金属钠的质量是多少?
(2)被氧化的金属钠的质量是多少?
备课参考:
参考答案:1、(1)银白 变暗 这是因为钠与氧气反应,在钠的表面生成了一薄层氧化物所致
(2)用滤纸吸干钠块表面煤油,防止钠与水反应放热,引起煤油燃烧
(3)镊子 手指表面有水份,能跟钠块反应生成强碱NaOH腐蚀皮肤
(4)钠的密度比水小,与水反应,放热,使钠熔化形成银白色小球
(5)钠与水反应放出氢气,推动钠球在水面上运动 钠与水反应放热使与钠球接触的水蒸发,在容器上方凝聚而形成白雾。
(6)钠与水反应生成NaOH,使酚酞变红
2.(1)3Fe+4H2O(g)=Fe3O4+4H2↑
(2)CaCl2 碱石灰 n
(3)向下排空气法.导管口伸入试管底部
(4)用拇指堵住试管口,移近火焰,松开,能燃烧或发出爆鸣声,说明收集的是H2
3.B 4.D 5.D 6.B 7.D 8.A 9.C 10.11.5g 11.90g 12.0.46g 0.46g
1.下列物质中不能与NaOH溶液反应的是( )
A. Na B. Fe C. Al D. Cu
2.在铝和NaOH溶液的反应中,作为还原剂的是( )
A.水 B.铝 C.氢氧化钠 D.氢氧化钠和水
3.用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到气体的为( )
A.O2和H2的混合气体 B.0.05molH2
C.大于0.05molH2 D.小于0.05molH2气体
4.铝与氢氧化钠溶液反应的离子方程式正确的是( )
A.2Al+2Na++2OH-+2H2O=2NaAlO2+3H2↑
B.Al+OH-+H2O=AlO2-+3H2↑
C.2Al+2OH-+2H2O=2AlO2-+3H2↑
D.Al+2OH-+H2O=AlO2-+2H2↑
5.铝具有较强的抗腐蚀性能,主要是因为( )
A.与氧气在常温下不反应 B.铝性质不活泼
C.铝表面形成一层氧化膜 D.铝耐酸耐碱
6.等质量的钠、镁、铝分别与足量的盐酸反应,产生H2的质量由大到小排列顺序正确的是
A. Al、Mg、Na B. Mg、Al、Na C. Na、Mg、Al D. Na、Al、Mg
7.相同质量的两块铝,分别和足量的稀H2SO4和NaOH溶液反应,产生气体的物质的量之比是( )
A.2:3 B.3:2 C.2:1 D.1:1
8.请你设计至少两种方法除去细小的铁粉中混有的细小的铝粉(作简要说明)
9.天平两边各放一个烧杯,烧杯分别盛放同体积同浓度的盐酸(足量),调节天平达到平衡。将12g镁和12g铝分别放入两烧杯中,反应完毕后,哪一端还要放入多少克同种金属,反应完毕后天平才能平衡?
备课参考
参考答案:1.BD 2.B 3.C 4.C 5.C 6.A 7.D 8.①磁铁 ②加NaOH溶液过滤 9.0.4g
1. 金属钠是_______色固体,质地__________,将钠放在空气中一会儿,会发现金属钠的表面变暗,原因是(用化学方程式表示)___________________________;将钠放在空气中燃烧,其反应的化学方程式是_____________________,生成物的颜色是___________色。
2. 保存金属钠时,应放在( )
A.水中 B.煤油中 C.棕色瓶中 D.酒精中
3. 以下说法错误的是( )
A.钠在常温下就容易被氧化
B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃
D.钠在氧气中燃烧更为激烈
4. 关于Na2O与Na2O2的叙述正确的是( )
A.都是白色的固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂
5. 当钠着火时,应选用灭火的是( )
A.煤油 B.水 C.沙土 D.泡沫灭火器
6. 下列物质放置在空气中,因发生氧化还原反应而变质的是( )
A.Na B.NaCl C.NaOH D.Na2O2
7. 2.3g纯净金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化物是( )
A.只有Na2O B.只有Na2O2 C.Na2O和Na2O2 D.无法确定
8. 钠离子的性质是( )
A.有强还原性 B.有弱氧化性 C.有碱性 D.比钠原子稳定
9. 取一小块钠放在玻璃燃烧匙里加热,下列实验现象正确的是( )
①金属先熔化②在空气中燃烧火焰呈黄色③燃烧时火星四射④燃烧后生成淡黄色固体⑤燃烧后生成白色固体
A.①②③ B.①②④ C.①②⑤ D.①③⑤
10.下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化剂,Na2O2主要有还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A.都正确 B.②③④⑤ C.②③⑤ D.④⑤
备课参考
参考答案 1.银白 柔软 4Na+O2=2Na2O 2Na+O2=Na2O2 淡黄
2.B 3.C 4.C 5.C 6.AD 7.C 8.BD 9.B 10.D
第二篇:金属钠的性质与应用-苏教版