实验一酸碱标准溶液的配制和标定
实验目的
1. 掌握标准溶液的配制方法。
2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。
3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。
实验原理
酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。
按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:
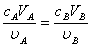
式中,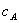 、
、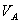 、
、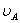 分别为酸的“物质的量”浓度、体积、化学计量系数;
分别为酸的“物质的量”浓度、体积、化学计量系数;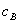 、
、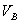 、
、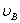 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。
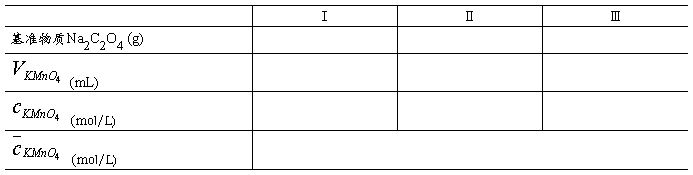
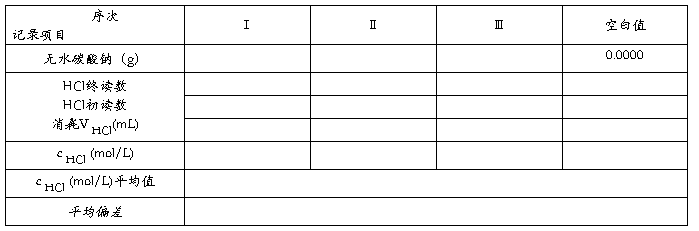
酸碱滴定中常用HCl和NaOH溶液作为标准溶液,但由于浓HCl容易挥发,NaOH固体容易吸收空气中的H2O和CO2,直接配成的溶液其浓度不能达到标准溶液的精度,只能用标定法加以标定。基准物质H2C2O4的分子式确定,化学性质稳定,不易脱水或吸水,可以准确称量,所以,本实验采用(H2C2O4·2H2O,摩尔质量为126.07g·mol-1) 为基准物质,配成H2C2O4标准溶液。以酚酞为指示剂,用H2C2O4标准溶液标定NaOH溶液;再以甲基橙为指示剂,用标定后的NaOH标准溶液滴定HCl溶液,从而得到HCl标准溶液。
…… …… 余下全文

 7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。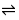 CaIn-(酒红色) +H+
CaIn-(酒红色) +H+