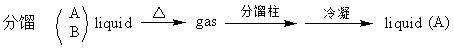.

报告题目:乙醇的蒸馏及沸点测定
专业班级:生物工程
指导老师:刘明星
学生姓名:何德维
学 号:1108110384
20##年3月30日
乙醇的蒸馏及沸点测定
一.实验目的
1、了解用蒸馏法分离和纯化物质及测定化合物沸点的原理与方法。
2、训练蒸馏装置的安装与操作方法,要求整齐、正确。
3、掌握常量法和微量法测定沸点的原理和方法、蒸馏与沸点测定的原理。
二.实验原理
蒸馏是分离和提纯液体有机物质的最常用方法之一
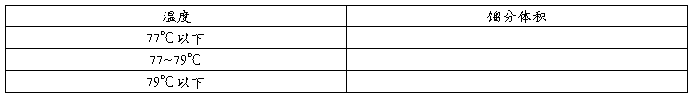
液体加热时蒸汽压就随着温度升高而加大,当液体的蒸汽压增大到与外压相等时,会有大量气泡从液体内逸出,液体沸腾。这时的温度称为液体的沸点。
蒸馏是将液体加热到沸腾,使液体变为蒸汽,然后使蒸汽冷却再凝结为液体这两个过程的联合操作。因为组成液体混合物的各组分的沸点不同,当加热时,低沸点物质就易挥发,变成气态,高沸点物质不易挥发汽化,而留在液体内,这样,我们就能把沸点差别较大(至少30℃以上)的两种以上混合液体分开,以达到纯化的目的。同时,利用蒸馏法,可以测定液体有机物的纯度,每一种纯的液体有机物质,在平常状况下,都有恒定的沸点(恒沸混合物除外),而且恒定温度间隙小(纯粹液体的沸程一般不超过1-2℃);当有杂质存在,则沸点会有变化(有时升高,有时降低,根据杂质温度高低二变化),而且沸点的范围也会加大。
…… …… 余下全文