新乡医学院 医用化学 实验课教案首页
授课教师姓名及职称:
新乡医学院化学教研室 年 月 日
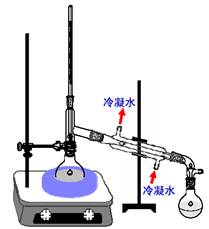
实验 常压蒸馏及沸点测定
一、实验目的
1.了解沸点测定的原理及意义;
2.掌握常压蒸馏操作技术及沸点测定方法。
二、实验原理
沸点测定实际上是一个蒸馏操作。蒸馏是一个将物质蒸发、冷凝其蒸气,并将冷凝液收集在另一种容器中的操作过程。当混合物中各组分的沸点不同时,可用蒸馏的方法将它们分开,所以蒸馏是分离有机化合物的常用手段。蒸馏的方法主要有以下四种:常压蒸馏、减压蒸馏、分馏和水蒸气蒸馏。下面我们就简单介绍一下,实验室中最常用的常压蒸馏。
基本原理
液体的分子由于热运动有从液体表面逸出的倾向,这种倾向随着温度的升高而增大,进而在液面上部形成蒸气。如果把液体置于密闭的真空体系中,液体分子继续不断地逸出而在液面上部形成蒸气,最后使得分子由液体逸出的速度与分子由蒸气中回到液体中的速度相等,亦即使其蒸气保持一定的压力。此时液面上的蒸气达到饱和,称为饱和蒸气,它对液面所施加的压力称为饱和蒸气压,简称蒸气压。同一温度下,不同的液体具有不同的蒸气压,这是由液体的本性决定的,而且在温度和外压一定时都是常数。
将液体加热,它的饱和蒸气压就随着温度升高而增大。当液体的蒸气压增大到与外界施于液面上的总压力(通常为大气压力)相等时,就有大量气泡从液体内部逸出,即液体沸腾。这时的温度称为液体的沸点。显然沸点与外压大小有关。通常所说的沸点是指在101.3 kPa压力下液体的沸腾温度。例如水的沸点为100℃,就是指在101.3 kPa压力下,水在100℃时沸腾。在其它压力下的沸点应注明压力。例如在70 kPa时水在90℃沸腾,这时水的沸点可以表示为90℃/70 kPa。
所谓蒸馏就是将液体加热到沸腾变为蒸气,再将蒸气冷凝为液体这两个过程的联合操作。如将沸点差别较大(至少30℃以上)的液体蒸馏时,沸点较低者先蒸出,沸点较高的随后蒸出,不挥发的留在蒸馏瓶内,这样可达到分离和提纯的目的,故蒸馏为分离和提纯液态有机化合物常用的方法之一。但在蒸馏沸点比较接近的混合物时,各物质的蒸气将同时被蒸出,只不过低沸点的多一些,难以达到分离和提纯的目的,只能借助于分馏(见分馏部分)。在常压下进行蒸馏时,由于大气压往往不是恰好为101.3 kPa,因而严格说来应对观察到的沸点加以校正,但由于偏差一般都很小,即使大气压相差2.7 kPa,这项校正值也不过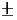 1℃左右,因此可忽略不计。
1℃左右,因此可忽略不计。
…… …… 余下全文