实验1 酸碱滴定与醋酸电离度和电离常数的测定
一、实验目的
1.掌握酸碱滴定基本原理,练习基本操作;掌握准确确定滴定终点的方法;掌握移液管、滴定管、容量瓶的使用;
2.了解用pH计法测定醋酸电离度和电离常数的原理和方法;加深对弱电解质电离平衡的理解;
3.学习pH计的使用方法;
二、实验原理
滴定分析是将一种已知浓度的标准溶液滴加到被测溶液中,直到化学反应完全为止,根据所耗标准溶液浓度和体积求得被测溶液的浓度的方法。
HAc+NaOH——NaAc+H2O
酚酞变色范围8.0-10
电离度和电离常数原理:
醋酸HAc是弱电解质.在水溶液中存在着下列电离平衡:
HAc = H+ + Ac-
起始时浓度(M0) C 0 0
平衡时浓度(M1) C-Cα Cα Cα

式中:Ka表示弱酸(如醋酸)的电离常数;C表示弱酸的起始时浓度;α表示弱酸的电离度。
在一定温度时,用pH计(酸度计)测定的一系列已知浓度的醋酸的pH值,按pH=-lg[H+]换算成[H+]=Cα,即可求得一系列对应的醋酸的电离度α和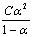 值。在一定温度下,
值。在一定温度下,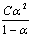 值近似地为一常数,取所得的一系列
值近似地为一常数,取所得的一系列 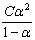 的平均值,即为该温度时HAc的电离常数Ka。
的平均值,即为该温度时HAc的电离常数Ka。
三、仪器和药品
l、仪器
pHS-3C 酸度计;酸式滴定管2支;小烧杯(100mL 14只);铁架台和滴定管夹;温度计;锥形瓶(250mL 2只);吸耳球和碱式滴定管;移液管(25mL)
2、药品
HAc 0.1mol/l;标准氢氧化钠NaOH(0.lmol/ L已经标定的);酚酞(0.5%)
四、实验内容步骤
l、醋酸溶液浓度的标定
用移液管精确量取2份25.00mL,0.lmol/LHAc溶液,分别注入两只250mL锥形瓶中,各加入2滴酚酞指示剂,分别用标准NaOH溶液滴定至醋酸溶液呈浅红色经摇荡后半分钟不消失为止。分别记下滴定前和滴定终点时滴定管中NaOH液面的读数,计算出所用的NaOH的溶液体积,从而求得醋酸溶液的精确浓度。
2、不同浓度的醋酸溶液的配制和pH值的测定
在4只干燥的100mL烧杯中,用酸式滴定管分别加入已标定的醋酸溶液48.00ml,24.00mL,12.00mL,6.00mL,接近所要刻度时应一滴一滴的加入。再从另一盛有去离子水的滴定管(酸式和碱式均可),往后面3只烧杯中分别加入24.00mL、36.00mL、42.00mL去离子水(使各溶液的体积均为48.00mL),并混合均匀。计算各份HAc溶液的精确浓度。
用pH计分别测定上述各种浓度的醋酸溶液(由稀到浓)的pH值。记录各份溶液的pH值及实验时的室温,然后计算各溶液中醋酸的电离度以及电离常数。
酸度计(也称pH计)是用来测定溶液pH值的仪器。实验室目前使用的酸度计有pHS--3型等。各种型号结构虽有不同,但基本原理相同。
五、酸度计的操作步骤(略)
实验2 气体常数的测定
一、实验目的
1.了解一种测定气体常数的方法及其操作。
2.掌握理想气体状态方程式和分压定律的应用。
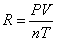 二、实验原理
二、实验原理
在理想气体状态方程式PV=nRT中,气体常数 的数值可以通过实验来确定本
实验通过金属锌置换出盐酸中的氢来测定R的数值。其反应为:
Zn+2HC1=ZnC12+H2
如果称取一定质量锌与过量的盐酸反应,则在一定温度和压力下,可以测出反应所放出的氢气的体积。实验时的温度和压力可以分别由温度计和气压计测得。氢的摩尔数可以通过反应中的锌的质量来求得。由于氢是在水面上收集的,氢中还混有水汽。在实验温度下水的饱和蒸气压P(H2O),可在附录中查出。根据分压定律,氢的分压可由下式求得:
P=P(H2)+P(H2O)
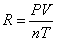 P(H2)=P-P(H2O)
P(H2)=P-P(H2O)
将以上所得各项数据代入 式中,即可算出R值。
三、仪器、药品及材料
仪器:分析天平、测定气体常数的装置(如图)
药品和材料::HCl(3mol/L)、锌片。
四、实验内容
1.在分析天平上准确称出锌片的质量(在0.03-0.06g范围内)。
2.按图1所示把仪器装好。取下试管,移动水平管,使量气管中的水面略低于刻度零,然后把水平管固定。
3.在试管中用滴管加入3ml 3mol/L HCl,注意不要使盐酸沾湿试管壁。将己称重的锌片沾少许水,贴在试管内壁上而不与盐酸接触。最后把这试管固定,塞紧橡皮塞。
4.检查仪器是否漏气,方法如下:将水平管向下(或向上)移动一段距离,使水平管中的水面略低(或略高)于量气管中的水面。固定水平管后,量气管中的水面如果不断下降(或上升),表示装置漏气。应检查连接处,看一看是否接好(主要是橡皮塞没有塞紧)。按上法检验直至不漏气为止。
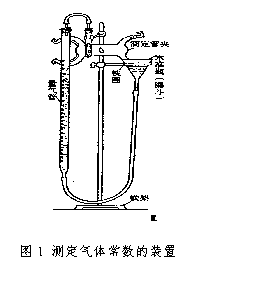
5.如果装置不漏气,调整水平管的位置,使量气管内水面与水平管内水面在同一水平面上(为什么),然后准确读出量气管内水面凹面最低点的读数V1。
6.轻轻摇动试管,使锌片落入盐酸中,锌片和盐酸反应而放出氢,此时量气管内水面即开始下降。为了不使量气管内气压增大而造成漏气,在量气管内水平下降的同时,慢慢下移水平管,使水平管内的水面和量气管内的水面基本保持相同水平。反应停止后,待试管冷却至室温(约10min左右),移动水平管,使水平管内的水面和量气管内的水面相平,读出反应后量气管内水面的精确读数V2。
7.记录实验时的室温t和大气压P。
8.从附录中查出室温时水的饱和蒸气压P(H2O)。
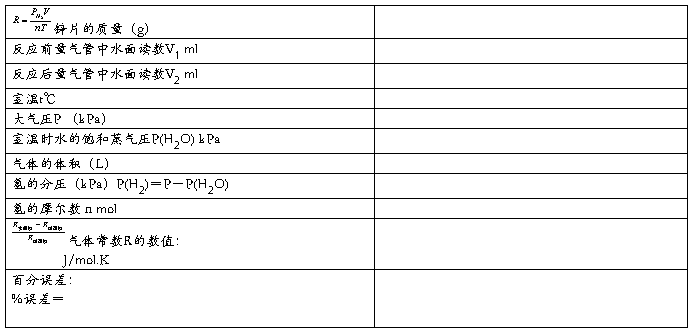
五、数据记录
实验3 磺基水杨酸合铁(Ⅲ)配合物的稳定常数的测定
一、实验目的
1. 掌握用比色法测定配合物的的稳定常数的原理和方法。
2. 进一步学习分光光度计的使用及有关实验数据的处理方法。
二、实验原理
测定配合物的组成常用光度计,其前提条件是溶液中的中心离子和配位体都为无色,只有它们所形成的配合物有色。本实验是在pH值为2~3的条件下,用光度法测定上述配合物的组成和稳定常数的,如前所述,测定的前提条件是基本满足的;实验中用高氯酸(HClO4)来控制溶液的pH值和作空白溶液(其优点主要是ClO4-不易与金属离子配合)。由朗伯—比尔定律A=KCL可知,所测溶液的吸光度在液层厚度一定时,只与配离子的浓度成正比。通过对溶液吸光度的测定,可以求出该配离子的组成。
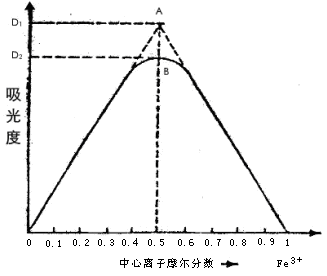
等摩尔系列法:即用一定波长的单色光,测定一系列变化组分的溶液的吸光度(中心离子M和配体R的总摩尔数保持不变,而M和R的摩尔分数连续变化)。显然,在这一系列的溶液中,有一些溶液中金属离子是过量的,而另一些溶液中配体是过量的;在这两部分溶液中,配离子的浓度都不可能达到最大值;只有当溶液离子与配体的摩尔数之比与配离子的组成一致时;配离子的浓度才能最大。由于中心离子和配体基本无色,只有配离子有色,所以配离子的浓度越大,溶液颜色越深,其吸光度也就越大,若以吸光度对配体的摩尔分数作图,则从图上最大吸收峰处可以求得配合物的组成n值,如图所示,根据最大吸收处:
等摩尔系列法
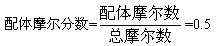


由此可知该配合物的组成(MR)。
最大吸光度A点可被认为M和R全部形成配合物时的吸光度,其值D1。由于配离子有一部分离解,其浓度再稍小些,所以实验测得的最大吸光度在B点,其值为D2,因此配离子的离解度α可表示为:
α=(D1-D2)/D1
再根据1∶1组成配合物的关系式即可导出稳定常数 K稳θ 或β。
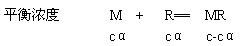
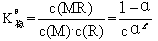
式中是c相应于A点的金属离子浓度(这里的是 K稳θ没有考虑溶液中的Fe3+离子的
水解平衡和磺基水杨酸电离平衡的表现稳定常数)。
试剂和仪器
1.仪器:
UV2600型紫外可见分光光度计,50mL比色管,100mL容量瓶,10mL移液管,洗耳球
2.试剂
0.01mol·L-1HClO4、0.0100mol·L-1磺基水杨酸、 0.0100mol·L-1 (NH4)Fe(SO4)2
实验步骤
1. 溶液的配制
(1) 配制0.0010mol·L-1 Fe3+溶液
用移液管吸取10.00mL(NH4)Fe(SO4)2(0.0100mol·L-1)溶液,注入100mL容量瓶中,用
HClO4(0.01 mol·L-1)溶液稀释至该度,摇匀,备用。
(2)配制0.0010 mol·L-1磺基水杨酸(H3R)溶液 用移液管量取10.00mLH3R(0.0100mol·L-1)
溶液,注入100mL容量瓶中,用HClO4(0.01mol·L-1)溶液稀释至刻度,摇匀,备用。
2. 系列配离子(或配合物)溶液吸光度的测定
用移液管按表的体积数量取各溶液

(2) 在波长500nm条件下,以0.01mol·L-1 HClO4作试剂空白,分别测定各待测溶液的吸光度,并记录已稳定的读数。
数据记录及处理
(1)实验数据记录

(2)用等摩尔变化法确定配合物组成:根据表中的数据,以吸光度A为纵坐标,摩尔比(Fe/acid )为横坐标做图。将两侧的直线部分延长,交于一点, 从图中找出D1和D2,按公式计算α和稳定常数。
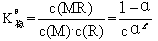
其中:C为配合物初始浓度:本实验条件下,配合物配合比为1:1,即摩尔比为0.5。此时配合物初始浓度为:
C=0.001×5/20(母液浓度为0.001,5 mL 混合后,变为20mL)
思考题:
(1) 用等摩尔系列法测定配合物组成时,为什么说溶液中金属离子的摩尔数与配位体的摩尔数之比正好与配离子组成相同时,配离子的浓度为最大?
(2) 在测定吸光度时,如果温度变化较大,对测得的稳定常数有何影响?
第二篇:西北大学化学实验教学中心
西北大学化学系综合化学实验学生实验成绩考核表(20##级化学基地) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级化学基地) 指导教师:

注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级材料化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级材料化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级应用化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
西北大学化学系综合化学实验学生实验成绩考核表(20##级应用化学) 指导教师:
注:每一实验成绩是预习(10%)、实验过程(60%)及实验报告(30%)成绩的总和,前两项可以用A(90)、B(80)、C(70)、D(<60)四个等级给,最后一项实验报告给出具体分数
