三年制大专化学教育专业《无机化学》教学大纲
职业技术教育系 陈英编
第一部分 大纲说明
一、 课程性质、内容、任务
(一)课程性质:《无机化学》是化学教育专业学生进入大学后的第一门主干基础课程,无机化学课程内容包含基础理论和元素化学两部分,它们互相渗透,紧密联系,组成了无机化学课程的整体。它既与中学化学内容相衔接,同时又为后续专业课程的学习提供必要的化学基础知识储备,对学生学习起到承前启后的作用。考虑到化学教育专业一年级学生的化学知识结构特点和当前化学学科的迅猛发展,本课程强调在无机化学教学中既要重视基础课程内容的阐述,又要适当兼顾介绍现代化学中的新发展,以期学生通过学习,不但掌握无机化学的基本内容,而且了解现代化学的发展特点,充分发挥学生学习化学的主动性,提高学生的学习兴趣和能力。
(二)课程内容:本课程主要选编了近代物质结构理论基础、酸碱理论与溶剂化学理论和配位化学等基本理论;元素及其重要化合物的基本性质和特征反应;核化学;生物无机化学等内容。
(三)课程的任务:无机化学的主要任务是通过课堂讲授、自学与讨论,使学生初步掌握近代物质结构理论基础、化学反应速率、化学平衡、电离平衡、氧化还原和配位化学等基本理论。并在这些理论的指导下,理解化学变化中物质的组成、结构和性质的关系,掌握元素及其重要化合物的基本性质和特征反应;掌握元素定性分析的硫化氢系统定性分析方法及常见阴、阳离子的检定方法。了解镧系元素及其化合物、核化学、生物无机化学的基础知识,同时适当介绍现代化学的新发展和新特点。通过学习,帮助学生树立辩证唯物主义观点,训练科学思维,培养学生对一般化学问题进行理论分析、计算、独立思考、归纳总结以及利用参考文献等方面的能力,逐步掌握解决化学问题的基本方法,为后继课程的学习打下基础。
二、教学要求、方法
(一)教学要求:本课程坚持“厚基础、高素质、强能力”的人才培养宗旨,体现师范教育特点和现代无机化学教育理念。以教学内容和方法的改革为切入点,以重视学生能力培养和良好素质养成为主线,以无机化学实验相辅助,加强学生获取知识的能力、分析解决问题的能力和创新能力的培养,构建无机化学课程新体系,使之充分体现以知识为基础,能力为重点,素质为根本的现代教学思想,使无机化学课程在逐步深化教育教学改革,不断提高教育教学质量基础上,全面提高学生的基本综合素质。具体如下:
1、通过课堂讲授、自学与讨论,使学生初步掌握近代物质结构理论基础、化学反应速率、化学平衡、电离平衡、氧化还原和配位化学等基本理论。
2、在这些理论的指导下,理解化学变化中物质的组成、结构和性质的关系,掌握元素及其重要化合物的基本性质和特征反应。同时适当介绍现代化学的新发展和新特点。
3、训练科学思维,培养学生对一般化学问题进行理论分析、计算、独立思考、归纳总结以及利用参考文献等方面的能力,逐步掌握解决化学问题的基本方法、化学的学习方法和学习策略,为后继课程的学习打下基础。
4、通过学习,帮助学生树立辩证唯物主义观点;培养实事求是、尊重客观事实、一丝不苟、严肃认真的科学态度;培养学生对化学的兴趣和热爱。
(二)教学方法:采用现代教学手段——PPT电子课件、传统教学方式和无机化学实验相结合的多元教学模式进行教学。一方面,多媒体电子课件既能使课堂教学突出和强调教学的重点和难点,增大课堂容量,同时又能增强教学内容的感染力和表现力,激发学生学习兴趣,其优势是传统教学方法无法比拟的。但另一方面,单纯使用课件讲课并不能很好地表达某些无机化学教学内容,因此同时辅以黑板图示、板书补充说明某些重点、难点问题等是必要的。对于元素部分教学内容,必须紧密与实验相结合,才能使学生的认知从感性认识上升为理性认识,同时又用所学到的理论知识去指导自己的实践,学会归纳总结,使知识系统化,培养和提高学生分析解决问题的能力以及应用能力。
应该强调的是,在无机化学理论课程的教学过程中,主要采用以学生为主体,以“结构-性能-原理-应用”为主线进行教学。无机化学理论原理部分以“设疑-精讲-讨论-总结”为基本教学方法;无机元素化学部分以“课堂引导-实验-讨论归纳-实验报告”作为基本教学方法,强调理论知识与实验相结合的综合运用能力培养,同时将本学科的学科新进展融入其中,增强化学知识的应用性和实用性特点。
本课程的教学旨在通过不断的教学实践,深入探索,总结经验,及时进行学习交流,广泛吸收先进的教学经验,提高课堂教学效果,实现教学培养目标。
三、考核方式
平时作业,10%;期中闭卷考试,20%;期末闭卷考试,70%。
四、教材
何凤娇编. 《无机化学》,科学出版社,2001。
五、推荐教材
1.北京师范大学等编,《无机化学》第三版,高等教育出版社,1992.
1.武汉大学,吉林大学等校编,《无机化学》(上、下册)第三版,高等教育出版社,1994.
2.傅献彩编,《大学化学》,高等教育出版社,1999.
3.申泮文主编.《近代化学导论》(上、下册),高等教育出版社,2002.
4.尹敬执,申泮文合著. 《基础无机化学》,人民教育出版社,1980.
五、教学时数安排表
学时分配:
讲授108学时,实验54学时,合计144学时。学时分配具体如下表:
无机化学(第一学期,每周6学时)
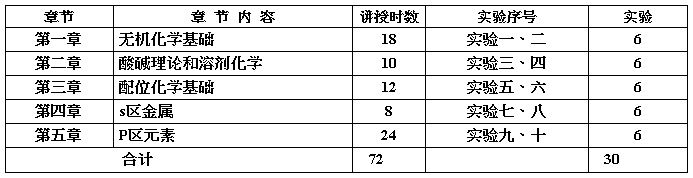
无机化学 (第二学期,每周3学时)
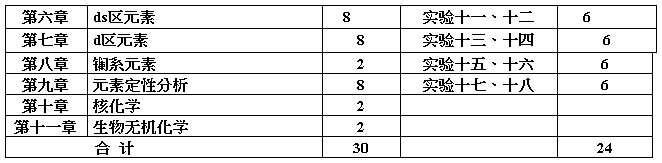
第二部分 大纲内容
第一章 无机化学基础
一、教学要求
(一)教学要求:
1.了解玻尔理论的要点。
2.了解核外电子的运动特征。
3.掌握描述核外电子运动的四个量子数及其物理意义,了解波函数及电子云的物理意义。
4.掌握各种波函数图形及其物理意义。
5.熟练应用原子轨道近似能级图,写出原子的电子排布(组态)。
6.了解屏蔽效应及钻穿效应。
7.掌握原于半径、电离能、电子亲合能、元素电负性的周期性变化规律。
8.掌握共价键的本质、特点以及它们的形成过程。
9.掌握共价键的价键理论、杂化轨道理论。
10.了解分子间力及氢键的概念,掌握分子间力和氢键的特征和形成条件及其对物质物理性质的影响。
(二)教学重点:
1.核外电子的运动特征。
2.核外电子运动的四个量子数及其物理意义,各种波函数图形及其物理意义。
3.原子轨道近似能级图和原子的电子组态。
4.元素的周期性变化规律。
5.共价键的本质。
6.杂化轨道理论。
7. 分子间力(范德华力)及氢键。
(三)教学难点:核外电子的运动状态和四个量子数;杂化轨道理论及其应用
二、教学内容
第一节 原子结构
(一) 氢光谱,玻尔(Bohr)理论。
(二) 微观粒子的运动特征(波粒二象性,不确定原理,微观粒子运动的统计规律)
(三) 波函数和量子数。
(四) 核外电子排布。
(五) 元素周期系与核外电子分布的关系。
(六) 原子基本性质(原子半径,电离能,电子亲和能,电负性,氧化态)的周期性变化规律。
第二节 化学键与分子结构
(一) 离子键理论。
(二) 共价键理论(电子配对原理,能量最低原理,原子轨道最大重量原理)。
(三) 分子间力(范德华力)。
(四) 氢键。
三、教学建议
1、教学设计:以“设疑-精讲-讨论-总结”为基本教学方法,配合多媒体化抽象为具体开展教学。
2、教学安排:讲授10学时。
3、作业、练习:教材所有习题
第二章 酸碱理论和溶剂化学
一、教学要求
(一)教学要求:
1.了解酸碱质子理论对酸碱的定义,掌握酸碱共轭关系;软硬酸碱理论。
2.了解溶剂的基本概念;掌握溶剂的基本性质。
(二)教学重点:酸碱共轭关系,软硬酸碱理论。
(三)教学难点:酸碱共轭关系,软硬酸碱理论。
二、教学内容
第一节 酸碱理论
(一)各种酸碱理论简介。
(二)软硬酸碱原理。
第二节 溶剂化学
(一)溶剂的基本概念。
(二)溶剂的性质。
(三)溶剂的分类。
三、教学建议
1、教学设计:“设疑-精讲-讨论-总结”为基本教学方法,配合多媒体化抽象为具体
2、教学安排:讲授10学时。
3、作业、练习:教材所有习题。
第三章 配位化合物
一、教学要求
(一)教学要求:
1.掌握有关配位化合物的组成、命名等基本概念。
2.掌握配合物价键理论的主要内容,并用它解释配合物的有关性质。
3.了解配合物的几何异构现象和立体结构。
4.掌握配合物稳定常数和不稳定常数的意义、表示方法及其相互关系,熟练应用稳定常数进行有关计算。
(二)教学重点:配合物的定义、组成和命名;配合物的价键理论及其应用;配合物的性质及其有关计算。
(三)教学难点:配合物的价键理论,配合物的性质及其有关计算。
二、教学内容
第一节 配合物的基本概念
(一) 配合物的定义。
(二) 配合物的组成。
(三) 配合物的命名。
第二节 配合物中的异构现象和立体结构
(一)结构异构和几何异构。
第三节 配合物的价键理论
(一)配合物的价键理论基本要点:杂化类型与空间构型,高自旋(外轨型)和低自旋(内轨型)配合。
(二)价键理论的应用:解释配合物的配位数、空间结构、稳定性和磁性等性质。
第四节 配位平衡
(一)配合物的稳定常数和不稳定常数,逐级稳定常数及其有关计算。
(二)影响配合物在溶液中的稳定性的因素:中心原子的结构和性质的影响,配体性质的影响。
第五节 配合物的性质
(一)溶解度——配合物的形成对难溶物的溶解度的影响及其有关计算。
(二)配合物的形成对氧化还原反应的影响,配离子之间的相互转化。
(三)酸碱性对水溶液中配合物稳定性的影响。
三、教学建议
1、教学设计:配合多媒体化抽象为具体,讲练结合。
2、教学安排:讲授10学时。
3、作业、练习:教材所有习题。
第四章 s区元素
一、教学要求
(一)教学要求:
1.掌握碱金属和碱土金属的存在、性质、制备和用途。
2.了解碱金属和碱土金属氧化物的性质和类型以及氢化物性质。
3.掌握碱金属和碱土金属氢氧化物的溶解性、碱性和盐类溶解性、热稳定性的变化规律。
4.掌握一些重要碱金属和碱土金属盐类的性质。
(二)教学重点:碱金属和碱土金属单质及氢氧化物的溶解性、碱性和盐类溶解性、热稳定性的变化规律。
(三)教学难点:对性质变化规律的理论解释。
二、教学内容
第一节 氢
(一) 氢的成键特征。
(二) 氢化物。
(三) 反应综述。
第二节 碱金属和碱土金属
(一) 碱金属和碱土金属的通性。
(二) 碱金属和碱土金属单质的性质、制备及用途。
(三) 碱金属和碱土金属化合物,金属和碱土金属氧化物(普通氧化物、过氧化物、超氧化物、臭氧化物),氢氧化物,氢化物,重要盐类性质简介。
三、教学建议
1、教学设计:复习已有知识;理论联系实际,结合实验学习理论,归纳概括。
2、教学安排:讲授8时。
3、作业、练习:教材所有习题。
第五章 p区元素
一、教学要求
(一)教学要求:
1.熟悉卤素单质、氧族元素、氮族元素、碳族元素及其重要化合物的结构,基本化学性质,制备和用途,掌握其共性、差异性及其性质递变规律。
2.较熟练地运用元素电势图来判断元及其化合物的氧化还原性以及各氧化态间的转化关系。
(二)教学重点:
1.卤素及其重要化合物的基本化学性质,结构和制备;元素电势图的应用。
2. 臭氧,过氧化氢,亚硫酸、硫酸及其盐,硫代硫酸盐,过二硫酸盐等重要化合物的化学性质。
3. 氮、磷重要含氧化合物的性质和制备,氮的主要氧化态间的相互转化关系。
4. 碳、硅、硼各重要化合物的性质,碳、硅、硼之间的相似性和差异。
(三)教学难点:
1.卤素卤素含氧酸及其盐的结构,元素电势图的应用。
2. 离域丌键的概念。
3. d←pп配键的形成和各种化合物的结构。
4. 硼的缺电子特征及乙硼烷的结构。
二、教学内容
第一节稀有气体
(一) 稀有气体的存在、分离和应用。
(二) 稀有气体的化合物。
第二节 卤素通性
卤素原子的物理性质,卤素的存在和卤素的电势图。
第二节 卤素单质
卤素单质的性质、制备和用途。
第三节 卤素的化合物
(一) 卤化氢和氢卤酸,卤化物,卤素互化物,多卤化物。
(二) 卤素含氧酸及其盐。
第三节 氧族元素
(一) 氧族元素的通性
1、氧族元素的存在,氧族元素的基本性质及氧族元素的电势图。
(二) 氧及其化合物
氧气单质,氧化物,臭氧及过氧化氢的性质和制备
(三)硫及其化合物
1、硫的同素异性体,硫化氢、硫化物及多硫化物。
2、硫的含氧化合物:二氧化硫、亚硫酸及其盐,三氧化硫、硫酸及其盐,焦硫酸及其盐,硫代硫酸钠,连二亚硫酸钠,过硫酸盐,连多硫酸,SOx对环境的危害。
(四 ) 硒和碲
第四节 氮 磷 砷
(一) 元素的基本性质
氮族元素的基本性质,氮在本族元素中的特殊性,氮 磷 砷的元素的电势图。
(二) 氮和氮的化合物
1、氮气的实验制法,生物模型固氮工程的原理和进展。
2、氮的氢化物:NH3及其氨衍生物N2H4、NH2OH和HN3等的结构、性质和制法。
3、氮的含氧化合物:NO、NO2等氧化物的结构和性质,HNO3、HNO2及其盐的性质及鉴别。
(三) 磷及其化合物
1、单质磷的同素异型体及其结构、性质和制备。
2、磷的氢化物和卤化物的结构和性质。
3、磷的氧化物、含氧酸(H3PO4、H4P2O7、HPO3、H3PO3、H3PO2)及其盐的结构和性质。
(四) 砷
1、砷单质的存在、性质和用途。
2、砷的氢化物及砷的检验方法,卤化物、氧化物含氧酸及其盐、硫化物及硫代酸盐的性质及用途。
第五节 碳硅 硼
(一) 通 性
碳 硅 硼的基本性质,电子构型和成键性质,自然存在和丰度。
(二 ) 碳
1、碳单质的同素异型体及其结构和性质。
2、碳的氧化物,碳酸及其盐的结构和性质。
(三) 硅
1、硅的性质、制备及用途,硅烷的组成和特殊性质。
2、卤化硅及氟硅酸盐,硅的含氧化合物(二氧化硅、硅酸、硅酸盐、分子筛)的性质和特殊用途。
(四) 硼
1、硼原子的成键特征,单质硼的结构和性质。
2、硼的氢化物和乙硼烷的分子结构。
3、卤化物和氟硼酸的性质,硼酸、硼砂的结构、性质和用途。
三、教学建议
1、教学设计:复习已有知识;理论联系实际,结合实验学习理论,讨论、归纳概括。
2、教学安排:讲授24课时。
3、作业、练习:所有习题。
第六章 ds区元素
一、教学要求
(一)教学要求:
1.掌握铜、银、锌、汞单质的化学性质和用途。
2.掌握铜、银、锌,汞的氧化物、氢氧化物、重要盐类和重要配合物的性质。
3.掌握Cu(I)、Cu(II);Hg(I),Hg(II)之间的相互转化。
4.了解锌的生物作用,镉、汞等重金属离子的生理毒性危害以及在环境保护毒性重金属离子的处理方法。
(二)教学重点:铜族和锌族重要单质及其化合物的化学性质。
(三)教学难点:Cu(I)、Cu(II);Hg(I)、Hg(II)之间的相互转化。
二、教学内容
第一节 铜族元素
(一)铜族元素的通性
2.铜族元素的重要化合物:氧化态为+Ⅰ、+Ⅱ的铜的氧化物、氢氧化物、重要盐类及其配合物的结构和性质;Cu(Ⅰ) 与Cu(Ⅱ)的相互转化。
3. 氧化银、硝酸银、卤化银及其配合物的性质和用途,卤化银的溶解度递变规律。
4.ⅠB族元素与ⅠA族元素的性质对比。
第二节 锌族元素
1.元素通性,锌族单质的存在、冶炼、性质和用途。
2.锌族元素的重要化合物:氧化物、氢氧化物、重要盐类及其配合物的性质,Hg2+与Hg22+的相互转化;锌的生物作用和含镉、汞废水的处理。
3.ⅡB族元素与ⅡA族元素的性质对比。
三、教学建议
1、教学设计:复习已有知识;理论联系实际,结合实验学习理论,讨论、归纳概括。
2、教学安排:讲授8学时。
3、作业、练习:本章后的习题。
第七章 d区元素
一、教学要求
(一)教学要求:
1.了解第一过渡系元素的价电子构型的特点及其与元素通性的关系,了解过渡元素钛、钒、铬、锰、铁、钴、镍单质的主要性质以及在材料科学、生物学及生物医疗方面的用途。
2.掌握铬、锰、铁、钴、镍的重要化合物的主要性质及其变化规律,各氧化态间的相互转化。
3.熟悉钒酸盐和铬酸盐的缩合性。
4.了解Fe—H2O体系的电势—pH图及其应用。
5.了解锆和铪、铌和钽化学性质的相似性,熟悉钼和钨同多酸、杂多酸及其盐的性质。
6.了解铂系元素的性质、化合物和用途。
(二)教学重点:
1.铬、锰和铁、钴、镍化合物的主要化学性质及其变化规律,各氧化态间的相互转化。
2.钼和钨同多酸、杂多酸及其盐的性质;3.铂单质的性质和用途,卤化物的配位性质。
(三)教学难点:1. Fe—H2O体系的电势—pH图及其应用,铁、钴、镍配合物的性质。2.同多酸、杂多酸及其盐的性质。
二、教学内容
第一节 d区元素的通性
(一) 原子的电子层结构。
(二) 金属活泼性。
(三) 氧化数。
(四) 离子的颜色。
(五) 磁性。
(六) 配合性。
(七) 催化性。
第二节 第一过渡系元素
(一) 钛
1.金属钛的存在、发现、冶炼、性质及用途。
2.钛的重要化合物二氧化钛、四氯化钛的性质。
(二)钒
1.金属钒的存在、发现、冶炼、性质和用途。
2.钒的重要化合物五氧化二钒、钒酸盐与多钒酸盐的性质(颜色、氧化还原性、缩合性)。
(三)铬
1.金属铬的存在、发现、冶炼、性质和用途。
2.氧化数为+Ⅲ的铬的重要化合物的酸碱性和还原性,铬(Ⅲ)的配合物,氧化数为+Ⅵ的铬的重要化合物的强氧化性和沉淀性,铬(Ⅲ)和铬(Ⅵ)的相互转化,铬的毒性及含铬废水的处理。
(四) 锰
1.金属锰的存在、冶炼和性质。
2.氧化态为(Ⅱ)、(Ⅳ)、(Ⅵ)和(Ⅶ)的锰的重要化合物的氧化还原性以及各氧化态的相互转化。
第七节 铁、钴、镍
1.铁系元素的存在及基本性质。
2.铁(Ⅱ)、铁(Ⅲ)重要化合物(氢氧化物、盐、配合物)的主要性质,Fe—H2O体系的电势—pH图。
3.钴和镍的重要化合物(氢氧化物、盐、配合物)的主要性质,钴(Ⅱ)与钴(Ⅲ),镍(Ⅱ)与镍(Ⅲ)的相互转化。
4.铁系元素化合物性质的变化规律。
第三节 第二、三过渡元素
(一)钼和钨
1.钼和钨的存在与冶炼,性质和用途及重要化合物的性质简介。
2.钼和钨同多酸、杂多酸及其盐的性质,钼的生物活性和固氮作用。
第四节 铂、钯
1.铂系元素的通性,单质的提炼与分离、性质和用途简介。
2.铂系金属的氧化物和含氧酸盐、卤化物及其配合物的性质简介。
三、教学建议
1、教学设计:重视从结构和理论出发,指导本章教学;由于信息量大,宜配合多媒体进行教学。
本章主要通过学生课前自学和课堂讨论、课后总结的形式完成。
2、教学安排:讲授8学时。
3、作业、练习:本章后的习题。
第八章 镧系元素
一、教学要求
(一)教学要求:
1.了解镧系和锕系元素的电子构型与性质的关系。
2.掌握镧系收缩的实质及其对镧系化合物性质的影响。
3.一般了解镧系和锕系在性质上的异同及重要化合物的性质。
(二)教学重点:镧系收缩的实质及其对化合物性质的影响。
(三)教学难点:镧系和锕系元素的电子构型。
二、教学内容
第一节 镧系元素
1.镧系元素的通性(电子层结构、氧化态、离子的颜色、镧系收缩、标准电极电势)。
2.镧系金属的存在、制备、性质及用途简介。
3.镧系元素氧化态为(Ⅱ)、(Ⅲ)和(Ⅳ)的重要化合物简介。
4.稀土元素的分离及其化合物的应用简介。
第二节 锕系元素的通性简介
三、教学建议
1、教学设计:本章主要通过学生课前自学和课堂讨论、课后总结的形式完成。
2、教学安排:讲授2学时。
3、作业、练习:本章后的习题。
第九章 元素定性分析
一、教学要求
(一)教学要求:
1.掌握阳离子系统分析方法。
2.掌握阴离子系统分析方法。
二、教学内容
第一节 概述
第二节 阳离子系统定性分析方法
1. 硫化氢系统分组法。
2. 第一组阳离子。
3. 第二组阳离子。
4. 第三组阳离子。
5. 第四组阳离子。
第三节 阴离子分析
1. 阴离子的分析特征。
2. 阴离子的分别鉴定。
三、教学建议
1、教学设计:结合实验,理论联系实际;引导学生讨论,比较分析,归纳概括;加大练习、强化巩固。
2、教学安排:讲授18课时。
3、作业、练习:本章后的习题。
第十章 核化学
一、教学要求
(一)教学要求:
1.掌握放射性衰变的类型及衰变速度。
2.掌握衰变的应用。
3.了解核的裂变和聚变。
(二)教学重点:放射性衰变的类型及衰变速度。
(三)教学难点:放射性衰变的类型及衰变速度。
二、教学内容
第一节 原子核结合能
第二节 放射性同位素与核反应
1.放射性的发现。
2.放射线和衰败。
3.放射线衰败速度。
第三节 核裂变和核聚变
1.核裂变。
2.核聚变。
第四节 放射线同位素的应用
1.示踪研究。
2.鉴定年代。
3.分析应用。
4.结构和机理研究
三、教学建议
1、教学设计:本章知识比较尖端高深、抽象难懂,必需借助多媒体化抽象为具体、注重引入实际应用实例提高学生学习积极性。
2、教学安排:讲授2课时。
3、作业、练习:本章后的习题。
第十一章 生物无机化学
一、教学要求
(一)教学要求:
1.了解生物体中重要元素及生理作用。
2.掌握金属酶和金属蛋白的结构和功能。
3.了解抗癌药物及应用。
(二)教学重点:金属酶和金属蛋白的结构和功能。
(三)教学难点:金属酶和金属蛋白的结构和功能。
二、教学内容
第一节 生物体中重要元素及生理作用
1.生物体中元素及其分布。
2.生物体内元素的生理功能。
第二节 金属酶和金属蛋白的结构和功能
1.泵和起传送作用的蛋白质。
2.氧的传送。
3.用作酸催化的酶。
第三节 金属药物的研究
1.抗癌配合物的研究。
2.排除金属中毒。
三、教学建议
1、教学设计:讲授为主,借助多媒体让学生多了解生物化学研究的新成果。
2、教学安排:讲授2课时。
