实验三环境微生物的检测
一、实验目的
1.了解周围环境中微生物的分布情况。
2.懂得无菌操作在微生物实验中的重要性。
3.了解四大类微生物的菌落特征。
二、实验原理
在我们周围的环境中存在着种类繁多的、数量庞大的微生物。土壤、江河湖海、尘埃、空气、各种物体的表面以及人和动物体的口腔、呼吸道、消化道等都存在着各种微生物。由于它们体积微小,人们用肉眼无法观察到它们个体的存在。但是只要稍加留意,我们就可以在发霉的面包、朽木上看到某些微生物群体。这些现象表明,自然界只要有微生物可以利用的物质和环境条件,微生物就可以在其上生长繁殖。据此,我们在实验室里就可以用培养基来培养微生物。
培养基是用人工配制的、适合微生物生长繁殖和产生代谢产物用的混合养料。其中含有微生物所需要的六大营养要素:碳源、氮源、无机盐、生长因子、气体和水分。此外,根据不同的微生物的要求,在配制培养基时还需用酸液或碱液调节至适宜的pH。配制好的培养基必须进行灭菌。所谓灭菌是指采用各类的物理或化学因素,使物体内外的所有微生物丧失其生长繁殖能力的措施。经过灭菌后的物体是无菌的。消毒是与灭菌完全不同的概念,它是指用较温和的物理因素杀死物体表面和内部病原微生物的一种常用的卫生措施。
灭菌的方法较多,广泛使用的是高温灭菌,其中最常用的是高压蒸汽灭菌法。此法是把待灭菌的物品放在一个可密闭的加压蒸汽灭菌锅中进行的。在1.05kg/cm2的蒸汽压力下,温度可达121℃。一般只要维持15~20min,就可杀死一切微生物的营养体和它们的各种孢子。
微生物的接种技术是生物科学研究中的一项最基本操作技术。为了确保纯种不被杂菌污染,在整个接种过程中,必须进行严格的无菌操作。在实验过程中必须牢固树立无菌概念,经常保持实验台及周围环境的清洁,严格无菌操作,避免杂菌的污染,这是保证实验成功的必要条件。
如将微生物接种到适合其生长的固体培养基表面,在适宜的温度下(一般细菌37℃:霉菌等28℃),培养一段时间(一般24~48h)后,少量分散的菌体或孢子就可生长繁殖成肉眼可见的细胞群体,此即菌落。如平板上的菌落是由单个细胞(或单个孢子)生长繁殖而成的,就是一个纯种细胞群或克隆;若培养后大量菌落聚集在一起形成的为菌苔。不同种的微生物可形成大小、形态各异的菌落,根据微生物菌落形态的不同,可初步鉴别出四大类微生物:细菌、放线菌、酵母菌和霉菌。
细菌的菌落呈圆形、较小而薄、透明或不透明、质地“细腻”,有的具有色泽,有的边缘不整齐,有的表面湿润、光滑,有的表面干燥有褶皱。此外,细菌常因分解含氮化合物而产生臭味。
酵母菌的菌落通常比细菌菌落大,圆形、厚、不透明、色素单一,多为乳白,少数为橙或红色。酵母菌因普遍能发酵含碳有机物产醇,故菌落多伴有酒香味。
防线菌菌落小而致密,或坚硬、或呈粉状。不少放线菌还产生特殊的土腥味。
霉菌菌落大而疏松、或大而紧密。气生菌丝会发育形成一定形状、构造和色泽的子实器官,所以菌落表面往往有肉眼可见的构造和颜色。
三、实验材料
人体表和空气中的微生物。
四、实验器材与试剂
1.器材
恒温培养箱、无菌平皿、电炉、酒精灯、火柴、无菌棉签和记号笔。
2.试剂
牛肉膏蛋白胨琼脂培养基、酵母膏葡萄糖培养基(简称YPD)、高氏一号培养基和查氏培养基。
五、实验操作
I.融化培养基
将装有无菌培养基的三角瓶置水浴中煮沸,待培养基融化后取出,当冷至50~60℃左右时,进行下一步。
II、倒平板
有持皿法和叠皿法,操作要点如下:
1.持皿法
(1)将无菌培养皿叠放在酒精灯左侧,以便拿取。
(2)点燃酒精灯。
(3)酒精灯旁,左手握三角瓶底部,倾斜三角瓶,右手旋松棉塞,用右手小指与小尾鱼际(即小指边缘)夹住棉塞并将其拔出(切勿将棉塞放在桌上),随之将瓶口在火焰上过一下(不可灼烧,以防爆裂),以杀死可能沾在瓶口的杂菌。然后将三角瓶从左手换至右手(用拇指、食指和中指拿住三角瓶的底部)。操作中瓶口应保持在火焰2~3cm,瓶口始终向着火焰,以防空气中微生物的污染。左手拿起一套平皿,用无名指和小指托住皿底,用中指和拇指夹住皿盖,食指于皿盖上为支点,在火焰旁,打开皿盖,让三角瓶伸入,随后倒入培养基。一般倒入15ml左右培养基即可铺满整个皿底。盖上皿盖,置水平位置待凝。然后将三角瓶移至左手,瓶口在次过火并塞紧瓶盖。
2. 叠皿法
此法适于在超干净台上操作,基本步骤同持皿法。不同之处是左手不必持皿,而是将瓶皿叠放在酒精灯的左侧并靠近火焰。按上述方法用右手拿三角瓶,左手打开最上面的皿盖,倒入培养基,盖上皿盖后即移至水平位置待凝。再依次倒下面的平皿。操作中瓶口始终向着火焰,以防空气中微生物的污染。
III、贴标签
待培养基完全凝固后,在皿底帖上标签,注明检测类型,组别及日期(也可用记号笔书写在皿底)
IV、检测方法
环境中微生物种类多样,检测方法也各异,先选几种列举如下:
1.空气 检测实验室空气中的微生物时,只要打开无菌平板的皿盖,让其暴露在空气中一段时间(5~10min)然后将皿盖盖上即可。
2.桌面 检测实验台桌面微生物是,可用一根无菌棉签,先在无菌平板的
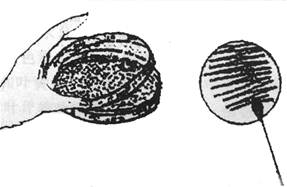
图4-1 含菌棉签平板划线示意图
左:开启皿盖法 右:划线示意图
一个区域内湿润和试划几下,然后用其擦抹桌面等物体表面,在以此棉签在平板的另一区域作来回划线接种(如图4-1)。本操作应以无菌操作要求进行,即在火焰旁用左手拿起平板,用中指 无名指和小指托住皿底部,用食指和大拇指夹住皿盖并开成一缝,右手持棉签在培养基表面划线接种,无菌棉签湿润和试剂区可作为无菌对照。
3.头发 移去放在桌面上的无菌平板的皿盖,是头发部位位于平板的上方,并用手指拨动头发数次,在盖上皿盖即可。
4.手指 可用未洗的手指先在无菌平板的培养基一侧(约一半的面积)作划线接种,并在皿底作好标记。然后用肥皂、流水洗手,用洗净的手指于平板培养基的另一侧作同样的划线接种,盖好皿盖。待培养后比较两杂菌生长的情况。
5.口腔 打开无菌平板培养基的皿盖,使口对着平板培养基的表面,以咳嗽或打喷嚏的方式接种,然后盖上皿盖。
V、培养
将以上各种检测平板倒置于28℃培养箱中培养,至下周实验时观察并计数各平板上的菌落数。
VI、观察
注意观察不同类型菌落的大小、外形和颜色等特征,将观察结果记录在实验报告上。
VII、清洗
观察记录完毕后,将含菌平板放在沸水中煮30min以上,杀死培养基表面生长的各种微生物,然后清洗并晾干培养皿。
六、思考题
1.通过本实验后,谈谈你对微生物的分布以及数量的认识。
2.本实验中那些步骤属无菌操作?为什么?
3.如何描述菌落的形态特征?
第二篇:实验五环境中微生物的检测和分离纯化
实验五 环境中微生物的检测和分离纯化
一、实验目的
1.熟悉常用微生物培养基的配制方法。
2.学习并掌握各种无菌操作技术,并用此技术进行微生物稀释分离、划线分离接种。
3.用平板划线法和稀释法分离微生物。
4.认识微生物存在的普遍性,体会无菌操作的重要性。
二、实验原理
(一)微生物的分离与纯化
土壤是微生物生活的大本营,在这里生活的微生物无论是数量还是种类都是极其丰富的。因此,土壤是微生物多样性的重要插所,也是发掘微生物资源的重要基地,可以从土壤中分离、纯化得到许多有价值的菌株。
从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。常用的是平板分离法。为了获得某种微生物的纯培养,一般是根据该微生物对雪养、酸碱度、浓度和氧等条件要求不同,而供给它适宜的培养条件,或加入某些抑制剂抑制其他菌生长而利于此菌生长的环境,从而淘汰其他一些不需要的微生物.再用稀释涂布平板法或稀释后平板划线分离,纯化该微生物,直至得到纯菌株。
(二)平板菌落计数法
平板菌落计数法是将待测样品经适当稀释,使其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞.统计菌落数,根据其稀释倍数和取样接种量即可换算出样品含菌数。
平板菌落计数法虽然操作繁琐,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是,由于该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水(包括水源水)等的含菌指数或污染程度的检测。
三、实验材料
土样10g,未知菌变形杆菌单菌落平板和无菌水.
取液器(5m1、l000ml各一支),培养箱,培养皿(20个),无菌有帽试管,三角瓶,无菌涂棒,接种环,5ml、1ml无菌吸头(移液管),记号笔,酒精灯,火柴,试管架,牙签,。
四,实验步骤
(一)培养基的制备(提前准备)
按以下步骤制备牛肉膏蛋白胨平板培养基,每组20个平板。配方参见附录I.
1.培养基的制备原则:适当的营养成分;合适的酸碱度,配制后经灭菌手续方可使用.
2.培养基配制的基本程序:称量一溶化一测定及矫正pH一过滤一分装—灭菌备用(若配制固体平板培养基,则先灭菌后再倾倒平板备用)。
3.培养基制备过程
(1)称量:按配方及配制的总量计算各种成分所需的量分别称取。
(2)溶解;将各种成分放入三角瓶(三角瓶体积要大于所装培养基体积2倍为宜)中,加自来水(一般配完全培养基用)或蒸馏水至所配培养基的总量,在微波炉中加热溶解,观察液体沸腾情况,在液体溢出之前,马上断开电源,反复多次,直到完全溶解。
(3)调pH值:初溶解好的培养基pH可能不符合要求,需用lmol/L NaOH或lmol/LHCI调pH至所需范围,
(4)过滤:趁热用滤纸或多层纱布过滤,以利于结果观察.一般无特殊要求的情况下,这一步可以省去(本实验无需过滤)。
(5)分装;按实验要求,可将配制的培养基分装入试管或三角瓶内。
液体分装:分装体积不超过三角瓶体积一半。
固体分装:培养基高度为试管的1/3为宜,配斜面培养基时,一般每试管(直径为10mm)加5ml左右培养基。分装三角烧瓶的量以不超过三角烧瓶容积的一半为宜。
半固体分装:培养基高度为试管高度的1/3为宜。
(6)加塞、包扎和灭菌;分装后,试管用试管帽,三角瓶用无菌培养容封口膜(棉塞)封好瓶口,作好标记,注明培养基的名称及配制日期。放人高压灭菌锅内,加热沸腾,排空锅内空气,以蒸汽剧烈喷出为准,然后升压到0.1MPa、稳压0.11MPa(121'C)灭菌20min,或全自动高压灭菌锅中设定121'C、15~20min灭菌,如果培养基体积较大或含有糖蜜等容易受污染的营养复合物时,可适当延长灭菌时间.
(7)摆斜面和倒平板;制斜面培养基时,应在未凝固前将试管有塞的一头搁在试管架底层、试管底部搁在桌面,形成斜面,斜度要适当,斜面长度约为试管长度的1/2,培养基上部离管口5cm以上,凝固后即成斜面.制平板培养基时,可将培养基冷却至60~70℃,无菌操作将培养基倒人已灭菌并干燥的培养皿中,让其自然流满整个子皿底或轻轻摇动培养皿,使其布满平皿底,盖上平皿盏,水平静置,等凝固后翻转培养皿.每平皿装量 15~20ml (490mm),使厚度达2~3mm。倒平板时,一般叠放培养皿,以免过多蒸汽凝结在皿盖上。
(8)无菌检查;特制好的培养基置37℃温箱孵育24h,如无杂菌生长即可使用(此步一般省略).
(9)较长时间不用的斜面或平板可用铝箔包好,放置4'C冰箱备用.
[二)周围环境中微生物的检测
在牛肉膏蛋白胨培养基平板上作如下实验:
l,取一个平板,分成4区,做好标记(下同).用未洗过的手指头以及肥皂洗过1次、2次、3次的手指头(不用毛巾擦)分别在4个区上涂抹(用力一致)。
2.取一个平板,分区,用正在使用的纸巾、硬币分别在不同的区上拖动2~3次。
3.往培养基上放置一根头发,并用无菌涂布器压紧。
4.取一个子板,将稍稍打开的嘴唇在培养基上压一下,检查嘴唇上的细菌。
5.取一个平板,分区,用无菌接种环分别沾一环自来水、河水以及矿泉水在平板不同区上画线。
6.用无菌牙签取一点牙垢在一个平板培养基上画线。
7.取两个乎板,一个打开皿盖,置实验台上(空气中)l0min,另一个按无菌操作要求在酒精灯火焰边打开皿盖lmin。
8.取一个平板,打开皿盖,对着培养基咳嗽。
9.另两个平扳可根据自己的兴趣,自由用来检测。
以上平板用报纸包好倒置于37℃培养箱里培养24h观察结果。
任何一个实验,在动手操作前均需先用记号笔在培养皿底做好标记。标记包括培养物名称、班级、姓名、日期.标记应明了、占地少,并做在乎皿底边缘,不要做在中间,以免影响结果观察。
本组的平板要统一用报纸包好,在外面写上组号,以免同学拿乱,找不到自己的平板。
(三)从土壤中分离微生物
1. 采土样:选择较肥沃韵土壤,铲去表层土,挖5~20cm深度的或特殊要求的土壤数十克,装入已灭菌的牛皮纸袋,封好袋口,做好编号记录,带回实验室供分离用。
2. 制备土壤稀释液,称取土样1.0g,放人盛99ml无菌水井带有玻璃珠的三角瓶中,置摇床振荡5min使土壤均匀分散成为土壤悬液(10-2)。用1ml的无菌吸头从中吸驻0.5ml土壤悬液,注人事先分装有4.5ml无菌水的试管中,吹吸3次,振荡均匀(10-3)。换一只新的无菌吸头,用同样方法,分别配置成稀释度为10-4、10-5、10-6的土壤溶液。
3. 涂布:用一只新的无菌吸头,分别由各浓度土壤稀释液中各吸取100μ1,对号较均匀地放入已写好稀释度的牛肉蛋白胨培养基平板上,用无菌玻璃涂棒涂匀,一定要多涂几遍,从概率角度来说,涂到细菌均匀分布为止,此步是实验成功的关键。每个浓度做3个平板。
4. 培养:将牛肉蛋白胨培养基平板倒置于37℃温箱中培养24h,统计所长出的菌落数.
5. 菌落计数;培养24h后,取出培养乎板,算出同一稀释度三个平扳上的菌落平均数,换算出土样中的菌含量。
土壤中的菌含量(个/g土壤)=
有较大片菌苔生长时,弃用,以无大片菌苔生长的培养皿计数;如成片菌苔大小不到培养皿的一半,其余一半分布均匀,将此一半计数×2。
选择平均菌落数在30~300间的平板。只有一个浓度符合此范围时,以该平均菌落数乘稀释倍数即为该样品中菌总数;有两个浓度平板的菌落数在30-300时,按两者菌落总数比值决定:比值小于2,取平均,比值大于2,取较少的菌落总数:
所有菌落数均大于300,取稀释度最高的平均菌落数乘稀释倍数;
所有菌落数均小于30,取稀释度最低的平均菌落数乘稀释倍数.
所有菌落数均不在30~300间,以最接近30或300的平均菌落乘以稀释倍数.
五、实验讨论
1.土壤中的菌数量在哪个数量级? 你分离出的微生物主要有哪些种类? 为什么?分析在分离过程中有哪些因素会导致结果偏大或偏小。
2.从你对周围环境中微生物存在的观察结果,你认为无菌操作要注意些什么?
3.在日常生活中如何讲究饮食和生活卫生?
