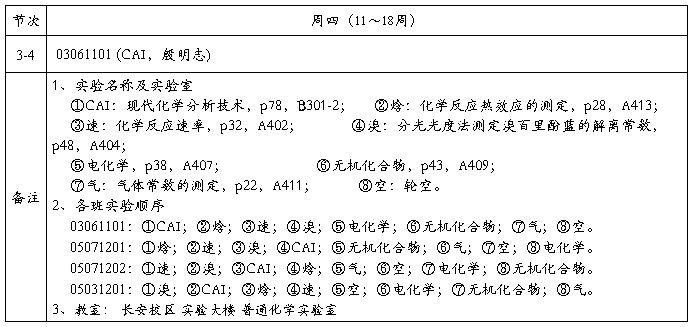
2012~20##学年第二学期化学实验课表
第二篇:南京大学物化实验系列燃烧热测定
燃烧热的测定
一.实验目的及要求
1.明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别及相互关系。
2.了解氧弹式量热计的原理,构造及使用方法,用氧弹式量热计测定萘、蔗糖的燃烧热,掌握有关热化学实验的一般知识和测量技术。
3.明确所测温差值为什么要进行雷诺图解法校正并掌握该掌握有关热化学实验的一般知识和测量技术,校正方法。。
二.实验原理
1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C→CO2(g),H2→H2O(l),S→SO2(g ),而N、Ag、卤素等元素变为游离状态。如在25℃苯甲酸的燃烧热为-3226.8KJ/mol
C6H5COOH (固) + 7O2 (气) → 7CO2(气) + 3H2O(液)
燃烧热可在恒容或恒压情况下测定。由热力学第一定律可知:在不做非膨胀功情况下,恒容燃烧热Qv=?U,恒压燃烧热Qp=?H。在氧弹式量热计中测得燃烧热为Qv,而一般热化学计算用的值Qp,这两者可通过下式进行换算:
Qp=Qv+?nRT (1)
式中 ?n为反应前后生成物和反应物中气体的摩尔数之差;R为摩尔气体常数;T为反应温度(K)。
在盛有定量水的容器中,放入内装有一定量的样品和氧气的密闭氧弹,然后使样品完全燃烧,放出的热量传给水及仪器,引起温度上升。若已知水量为W克,仪器的水当量W’(量热计每升高1℃所需的热量)。而燃烧前、后的温度为t0和tn。则m克物质的燃烧热
Q’=(CW+W’)(tn—t0) (2)
若水的比热为1(C=1),摩尔质量为M的物质,其摩尔燃烧热为:
Q=M/m(W+W’)(tn—t0) (3)
水当量W’的求法是用已知燃烧热的物质(如本实验用苯甲酸)放在量热计中燃烧,测其始、末温度,按(3)式求W’。一般因每次的水量相同,(W+W’)可作为一个定值(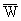 )来处理。故
)来处理。故
Q=M/m(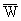 )(tn—t0) (4)
)(tn—t0) (4)
在较精确的实验中,辐射热,铁丝的燃烧热,温度计的校正等都应予以考虑。
三.仪器与药品
GR3500氧弹式量热计一套;氧气钢瓶,万用表,数字式精密温差测量仪一台。
苯甲酸(A.R.);萘(A.R.);蔗糖(A.R.)。
四.实验步骤
1.  将量热计及其全部附件加以整理并洗净擦干。
将量热计及其全部附件加以整理并洗净擦干。
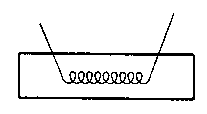
2. 压片 取燃烧丝放在干的燃烧杯中称量。另用台天平称取约0.7g~0.8g已经磨细的苯甲酸,把燃烧丝放在苯甲酸中,在压片机中压成片状,(不能压得太紧,太紧会压断燃烧丝或点火后不能燃烧),压好后样品形状如左图所示。将此样品放在燃烧杯中称量,从而可得到样品的量m。
3. 调节水温 将温差测量仪探头放入外筒水中(环境),调节数字显示在“2”左右,取3000ml以上自来水,将温差测量仪探头放入水中,调节水温,使其低于外筒水温1K左右,用容量瓶取3000ml已调温的水注入内筒,水面盖过氧弹(两电极应保持干燥),如有气泡逸出,说明氧弹漏气,寻找原因,排除。装好搅拌头(搅拌时不可有金属摩擦声),把电极插头插紧在两电极上,盖上盖子,将温差测量仪探头插入内筒水中(拔出探头之前,记下外筒水温读数;探头不可碰到氧弹)。
 4. 充氧气 把氧弹的弹头放在弹头架上,将装有样品的燃烧杯放入燃烧杯架上,把燃烧丝的两端分别紧绕在氧弹头中的两根电极上,用万用表测量两电极间的电阻值。(两电极与燃烧杯不能相碰或短路)。把弹头放入弹杯中,用手将其拧紧。再用万用表检查两电极之间的电阻,若变化不大,则充氧。
4. 充氧气 把氧弹的弹头放在弹头架上,将装有样品的燃烧杯放入燃烧杯架上,把燃烧丝的两端分别紧绕在氧弹头中的两根电极上,用万用表测量两电极间的电阻值。(两电极与燃烧杯不能相碰或短路)。把弹头放入弹杯中,用手将其拧紧。再用万用表检查两电极之间的电阻,若变化不大,则充氧。
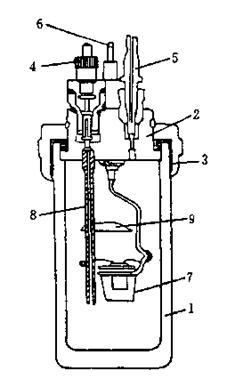
使用高压钢瓶时必须严格遵守操作规则。先充入约0.5MPa氧气,然后放气,以排出单弹内空气。再充入约1.5MPa氧气,再用万用表检查两电极间电阻,变化不大时,将氧弹放入内筒。氧弹结构如左图。
5. 点火 检查控制箱的开关,注意“振动、点火”开关应拨在振动档,旋转“点火电源”旋纽到最小。打开总电源开关,打开搅拌开关,待马达运转2min~3min后,每隔0.5min读取水温一次(精确至 0.002℃)直至连续五次水温有规律微小变化,把“振动、点火”开关由振动档拨至点火档,旋转“点火电源”旋纽,逐步加大电流,当数字显示开始明显升温时,表示样品已燃烧。把“振动、点火” 开关拨
0.002℃)直至连续五次水温有规律微小变化,把“振动、点火”开关由振动档拨至点火档,旋转“点火电源”旋纽,逐步加大电流,当数字显示开始明显升温时,表示样品已燃烧。把“振动、点火” 开关拨
氧弹的构造 至“振动”;把“点火”电源旋纽转至最小。杯内样品一经燃烧,水温很快上升,每0.5min
1.厚壁圆筒 2.弹盖 3.螺帽 4.进气孔 记录温度一次,当温度升至最高点后,再记录
5.排气孔 6.电极 7.燃烧皿 10次,停止实验。
8.电极(也是进气孔)9.火焰遮板 实验停止后,取出温差测量仪探头放入外筒水中,取出氧弹,打开氧弹出气口放出余气,最后旋下氧弹盖,检查样品燃烧结果。若有许多黑色残渣表示燃烧不完全,实验失败。
弹中没有什么燃烧残渣,表示燃烧完全,若留用水冲洗氧弹及燃烧杯,倒去内筒中的水,把物件用纱布一一擦干,待用。
6. 测量萘的燃烧热 称取0.4g~0.5g萘,代替苯甲酸,重复上述实验。
7. 测量蔗糖的燃烧热 称取1.2g~1.3g蔗糖代替苯甲酸,重复上述实验。
五.实验注意事项
1. 待测样品需干燥,受潮样品不易燃烧且称量有误。
2. 注意压片的紧实程度,太紧不易燃烧。燃烧丝需压在片内,如浮在片子面上会引起样品熔化而脱落,不发生燃烧。
3. 在燃烧第二个样品时,内筒水须再次调节水温。
六.数据处理
数据记录: 实验室温度:10.2 oC

1. 用雷诺图求解苯甲酸、萘和蔗糖燃烧前后的△T
 ⑴.苯甲酸的雷诺图
⑴.苯甲酸的雷诺图
苯甲酸的雷诺图
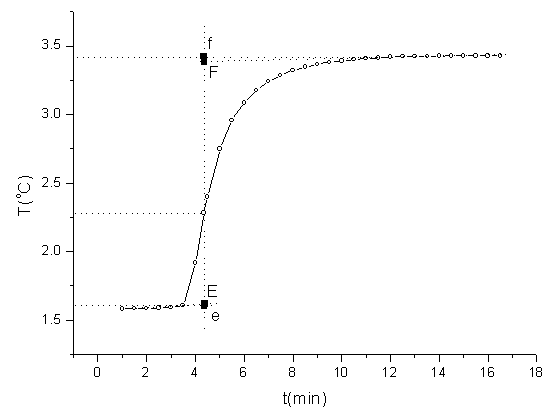 ⑵.萘的雷诺图
⑵.萘的雷诺图
萘的雷诺图
⑶.蔗糖的雷诺图
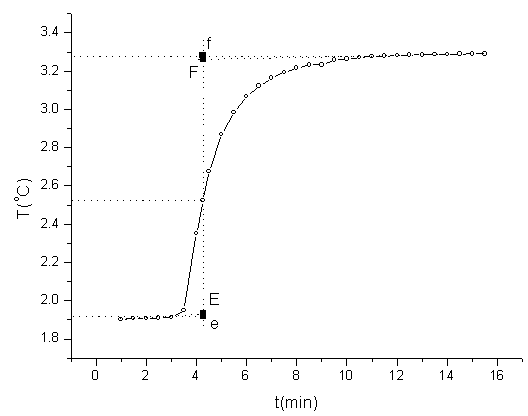 蔗糖的雷诺图
蔗糖的雷诺图
由经雷诺图校正可得:

2. 计算量热计的水当量( )
)
由公式: Qp=Qv+?nRT
-3226.8= Qv-0.5  8.314
8.314  283.4/1000
283.4/1000
Qv=-3226.8+0.5  8.314
8.314 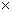 283.4/1000
283.4/1000
=-3225.6KJ/mol
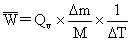 =-3225.6
=-3225.6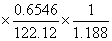 =-14.55(KJ/K)
=-14.55(KJ/K)
3. 求萘和蔗糖的燃烧热
⑴.萘的燃烧热
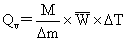 =
=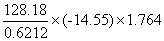 =-5296.0 KJ/mol
=-5296.0 KJ/mol
Qp=Qv+?nRT=-5296.0-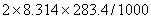 =-5300.7 KJ/mol
=-5300.7 KJ/mol
Qp标准=-5157 KJ/mol
相对误差=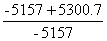
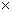 100%=-2.79%
100%=-2.79%
⑵.蔗糖的燃烧热
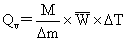 =
=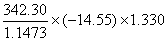 =-5773.6 KJ/mol
=-5773.6 KJ/mol
Qp=Qv+?nRT=-5773.6 KJ/mol
Qp标准=-5645 KJ/mol
相对误差=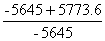
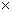 100%=-2.28%
100%=-2.28%
七.思考题
1. 在这实验中,哪些是体系,哪些是环境?实验过程中有无热热交换?热交换对实验结果有何影响?
解答:体系:内筒以及其中的水、氧弹。环境:内筒以外的一切。由于环境与体系没有绝热,两者只要存在温差就可能存在热交换。视体系温度相对于环境温度得高低,会使所测的燃烧热偏小或偏大。实验中采用雷诺图解法进行校正。
2. 加入内筒中水的水温为什么要选择比外筒水温低?低多少合适?为什么?
解答:因为体系与环境之间的热交换是不可能避免的,所以开始加入内筒水的水温应比环境低,即比外筒水温低,这样热就从环境传递到体系;当样品燃烧以后,体系温度比环境高,热就从体系传递到环境。这样就可以使得由于体系与环境之间的热交换引起的误差减小到最少。为了尽量让两个过程中传递的热量相等而抵消,内筒水被调低的温度应是样品燃烧前后温差的一半。本实验中△T在1.5K左右,所以温度选择低0.9~1K。
3. 实验中,哪些因素容易造成误差?如果要提高实验的准确度应从哪几方面考虑?
解答:造成误差因素:
⑴.样品的预处理条件。
⑵.燃烧是否充分,由于压片不好或充氧不足造成样品没有完全燃烧,将会带来极大的误差。
⑶.水温的选择影响内外筒之间的热量传递。
⑷.内筒中水量是否准确。
⑸.燃烧丝的燃烧热。
⑹.工业氧气中含氮杂质的氧化带来的热效应。
为了提高实验的准确度,可以:
⑴.待测样品需干燥,受潮样品不易燃烧且称量有误。称量要尽量准确。
⑵.适当多充一些氧气,使样品充分燃烧。且实验后应检查是否燃烧充分,并决定是否需要重做。
⑶.水温应尽量选择比环境温度低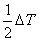 ,使热传递抵消。
,使热传递抵消。
⑷.每次做完实验后内筒中的水要倒尽,且加水时要严格定容。
⑸.可以测定燃烧丝燃烧前后失重的量,用以校正它带来的误差。
⑹.用蒸馏水洗涤氧弹内壁,并用NaOH滴定,通过计算可校正氧气中杂质带来的误差。
八.讨论
1.燃烧热是指1mol物质完全燃烧时的热效应,是热化学中重要的基本数据。燃烧热广泛地应用在各种热化学计算中,许多物质的燃烧热和反应热已经测定。
测定燃烧热的氧弹式量热计是重要的热化学仪器,在热化学、生物化学以及某些工业部门中用得很多。
目前国产氧弹式量热计有环境恒温型和绝热型两类。前者设备简单,但需进行温差校正,后者不需校正,较精确,但价格昂贵。
2.对其他热效应的测量(如溶解热,中和热,化学反应热等)可用普通杜瓦瓶作为量热计。对于放热过程也是用已知热效应的反应物先求出量热计的水当量,然后对未知热效应的反应进行测定。对于吸热反应可用电热补偿法直接求出反应热效应。
3.本实验是将可燃性物质,在与外界隔离的体系中燃烧,从体系温度的升高值及体系的热容计算燃烧热。这就要求体系和外界热量的交换很小,并能够进行校正。为此,仪器要有较好的绝热性能。体系与环境间交换能量的途径有热传导、辐射对流、蒸发和机械搅拌等。体系与外界隔以空气层防止热传导;量热计的外套内通水,并与体系温度接近,以控制环境温度恒定;内筒下方用塑料垫脚架起,上方有胶木板盖,以减少对流和蒸发;搅拌棒使热量分布均匀;搅拌棒上端以绝热棒与马达相连,不会传导热;体系内部各元件抛光或镀银,以减少热辐射。
在点火前和实验末期,体系与环境间温度差变化不大,交换能量较稳定。反应期温度变化大,体系与环境温度随时改变,并且交换着一定的热量,常用雷诺作图法,校正温度改变值。本实验所做的雷诺校正图中都没有出现最高点,说明量热计绝热情况良好,热漏小,但由于搅拌不断引进少量能量,使燃烧后最高点不出现。
4.实验中需要注意的事项:
1) 待测样品需干燥,受潮的样品不易燃烧而且称量时会带来误差。
2) 压片时,燃烧丝不要缠绕在一起,否则会短路、烧断;压片不能压得太紧,太紧会压断燃烧丝或点火后不能燃烧。但在压蔗糖片时,因为其颗粒较大、松散,需要用较大力气才能压片成功。燃烧丝需压在片子内,不要浮在片子表面。
3) 把样品固定在氧弹弹头上时,要注意燃烧丝不要交缠,以防短路。并注意前后测量三次电阻值。
4) 调节水温时,不要把温度探头当成搅拌棒使用。要边倾加冷/热水,边搅拌,防止加入过量。每次更换样品时,都需要重新调节内筒水温。
5) 如实验时氧气压力较高,不需要排空气的步骤,但一定要充氧充分,保证完全燃烧。
附: 燃烧热的测定教学简要内容
一.重点与难点
- 注意恒容燃烧热与恒压燃烧热的关系,要明确实验中用氧弹量热计测量的是恒容燃烧热。在数据处理时,很多同学将二者搞混,求得恒容燃烧热后不求恒压燃烧热。在处理数据时,要写出三个反应的方程式,计算前后气相物质的摩尔差,由等容燃烧热计算出等压燃烧热。
- 原理部分提到的“水当量”,物理意义是氧弹量热计每升高1°C所需要的热量。因此,只要能知道或测定氧弹的水当量,那么样品的燃烧热也就不难求出。“水当量”隐含了一个重要的信息,那就是不管是测量苯甲酸,还是萘或蔗糖的燃烧热,每次使用的水的量必须相等。实验中是要求用容量瓶量取3000mL,而且一次实验结束需将内筒晾干,以便进行下一次实验。
- 本实验最关键的部分是燃烧丝的绕制与压片:(1)燃烧丝要绕制紧密,太松在压片过程中可能会产生接触,点火时就会短路;绕制过程中不可用指甲去掐或按,否则会在燃烧丝上留下折痕,点火时电流通过受阻,折痕处就会被熔断,导致样品无法燃烧;一般绕制8-10圈,蔗糖样品颗粒较大,相对较为难烧,可绕10圈。(2)压片放置燃烧丝时,注意两端不要搭在一起;萘样品较少,因此压片时燃烧丝放置的位置较苯甲酸与蔗糖要低些。
- 整个实验过程中,我们关心的是内筒水温度的改变值,而不是绝对温度。由于燃烧放热使内筒的水温升高,这样内筒就会向温度较低的外筒辐射热量,那么内筒水温的升高就不能真实地反应燃烧放出的准确热量。因此,要求内筒的初始水温要比外筒的低,在样品燃烧前让外筒向内筒辐射热量,而燃烧后,内筒向外筒辐射热量,如果两部分热量抵消,那么内筒水温的升高就能准确反映燃烧放出的热量。
- 要利用好万用表,实验中燃烧丝的电阻值一般在十个欧姆左右。压好片、装到氧弹电极上以及充好气都要测量电阻。压好片后电阻太大表示燃烧丝可能被压断,电阻太小可能是发生短路,需重新绕丝压片;装到电极上后,电阻如果太大,说明缠得不牢,接触不好,电阻太小则可能短路,需小心缠紧,不能有折痕;充气后如果电阻太大,可能是气流太急,冲断燃烧丝,需缓缓充气。在保证电路畅通的情况下方能进行下一步实验,这样就能大大提高实验的效率。
- 结合实验中采集数据点时的要求,仔细讲解雷诺校正的目的。为什么要等每0.5min水温上升规律变化(0.002或0.003°C)才记录读数?样品烧着后,为什么要等最高点出现再记录十个数据点?
- 实验结束后结合思考题引导学生思考总结,本实验中,体系是什么?环境又是什么?哪些因素会带来误差?
二.讲解基本要点
1.有关概念和实验方法
本实验是测量热效应的实验。测热效应时首先要考虑为吸热反应还是放热反应。吸热反应可用电热补偿法来测量,放热反应则用温差量热法来测量。
1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C→CO2(g),H2→H2O(l),S→SO2(g ),而N、Ag、卤素等元素变为游离状态。(提问:什么是燃烧热?)燃烧热可在恒容或恒压情况下测定。两者之间的关系可由热力学第一定律得:Qp=Qv+?nRT。今天我们在恒容情况下用氧弹式量热计来测物质的燃烧热。
将一定量的样品加入氧弹中,样品完全燃烧后,放出的热量传给水及仪器,引起温度上升。m克物质的燃烧热可表示为Q’=(CW+W’)(tn—t0):W为水量,W’为仪器的水当量,t0和tn为燃烧前、后的温度,C为水的比热。若水的比热为1,其摩尔燃烧热为Q=M/m(W+W’)(tn—t0)。如果每次实验的水量都相同,可把W+W’作为一个定值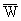 来处理,摩尔燃烧热为Q=M/m(
来处理,摩尔燃烧热为Q=M/m(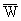 )(tn—t0)。
)(tn—t0)。
本实验用苯甲酸作为标准物质,来求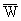 。再由求出的
。再由求出的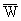 计算待测物的燃烧热。
计算待测物的燃烧热。
2.实验内容讲解
2.1了解量热计的构造,为了达到绝热目的:
⑴.盖子的正面涂上黑色,反面是光亮的金属,防止热辐射。
⑵.内筒与底部有塑料垫脚
⑶.内筒与外筒中有一层空气,空气是热的不良导体。以上为了防止热传导。
⑷.搅拌,使温度混合均匀。
⑸.实验前为什么要将内筒水温调调至比外筒水温低1K?(提问:为什么?)
因为客观上系统与环境不可避免存在热交换,而燃烧是放热反应,将水的起始温度调调至比环境低约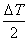 ,可使反应前半期系统向环境吸收的热量与后半期系统向环境吸收的热量大致相抵消,以减小实验的误差。反应前后,温度变化△T=2K时,内筒水温度应当调低1K,即可达到平衡。我们实验中的△T在1.5K左右。所以我们水温调节时低0.8~1.0K就可以了。
,可使反应前半期系统向环境吸收的热量与后半期系统向环境吸收的热量大致相抵消,以减小实验的误差。反应前后,温度变化△T=2K时,内筒水温度应当调低1K,即可达到平衡。我们实验中的△T在1.5K左右。所以我们水温调节时低0.8~1.0K就可以了。
在做实验前,先要将外筒水温置在2左右,便于我们读数(示范操作一下)。将温度探头从外筒中拿出来,等示数降了2K左右时,按下置零键。
调节水温时(操作),不要把温度探头当搅拌棒,以免损坏温度探头,要用玻棒。一边倒入冰水,一边搅拌。水温调好后,将水倒在容量瓶中,一个2000ml、一个1000ml。定容。倒入内筒。
2.2压片:要求压出的片子,燃烧丝要在片子中间,这样才能保证点火成功,燃烧完全。
氧弹和弹头是配套的,价格昂贵,为了减少损耗,弹头一定要放在弹头架上来操作。
先将燃烧丝装在燃烧杯中用电子天平称量,称准至毫克。压片前将燃烧丝穿于垫片中孔,注意不要让燃烧丝的中间绕在一起(点火时会烧断),燃烧丝不要紧贴金属片,要抬高0.5~0.8cm,这样就不会压完片后,燃烧丝浮在样品片上。研磨苯甲酸后在台称天平上称0.7~0.8g压片(提问:为什么要粗称?)。压好后取出片子把毛边用手轻轻地弄掉,将样品片装在燃烧杯中称量。前后质量相减就是样品片的重量。
2.3固定样品:称量完后,把燃烧丝两端固定在弹头上,量电阻。要求电阻小于15Ω。把弹头装在氧弹上,装好后再量电阻,同样要求小于15Ω。
由于我们的氧弹密封性不是很强,这时应该先调节水温,将量热计准备好。准备好后,再充氧。
压片的注意点:
a.压片的两个凹槽防止在压片的时候引火丝受挤压从而电阻改变可能会不引燃;]
b.在船引火丝的时候两个长脚不要交叉,否则短路;
c.引火丝的螺旋部分:增加接触面积;
d.取压片时要光滑压片;
e. 压片时不要用力过大,在压蔗糖时要用力;
f. 称量的时候用中间四台天平。
2.4.钢瓶的安全知识及充氧
钢瓶应存放在阴凉、干燥,远离热源的地方,避免明火和太阳曝晒。(提问)
钢瓶受热后,气体膨胀,瓶内压力增大,易造成漏气,甚至爆炸。可燃性气体钢瓶与氧气钢瓶必须分开存放。
一般的气体钢瓶,除了CO2,NH3外,都要有减压阀。
总阀与分压阀频繁使用很容易坏。教师把总阀与分压阀打开后,调到一定的压力,同学只要调压阀就可以了。
充气时,一手竖直地拿住钢管,一手将螺纹旋紧。当“咝咝”声没有了,就表示充好了。如果有的氧弹没有声音,等15秒钟即可。
充完氧后,是第三次量电阻,同样要求小于15Ω。
高压钢瓶及充气注意点:
a.钢瓶的颜色(氧气:蓝色 氢气:绿色);
b.钢瓶的安全知识;
c.钢瓶的操作:总阀在分阀关闭时才可以打开,分阀松为关闭,老师调节好分压学生不可调节,压力看表头(注意单位和精度),表压表示体系和大气的压差,充气时听不到“呲呲”声表示充气完毕。
d.切记冲完气后关闭阀门!!!
e. 充气前和充气后都要用万用表测电极间的电阻值,变化不大可测。(一般电阻值15欧姆左右)
将氧弹放入内筒时,先将橡胶电极插好,金属电极由于不能碰水,先拿在手里,待氧弹放进去后,再将夹子夹上。一定要将电极夹稳,不要中途松动下来。
记下外筒温度后,拔出温度探头,放入内筒中。
调节水温的注意点:
a.调节数字显示在2到3都可以;
b.搅拌不可有金属声;
c. 不可用温度探头搅拌;
d.状如氧弹时,现插入一个电极,另一个夹子的等到放入水中后再夹上;
f. 在把温度探头插入内桶前一定要记录读数。
2.5燃烧测定:开电源之前要先检查一下,开关是不是打在振动档,点火电源旋在最小。(提问:为什么?)
⑴.打开总电源
⑵.打开搅拌电源:先不要急着记数据,当体系温度有规律变化:小数点最后一位变化小于等于3时,记下这样的5个数据。
记数据:报时器每隔30秒闪一下同时叫一下,每叫一下时记下数据。当开始记数据后,数据记录不能间断,包括点火过程也要记录。
⑶.记好5个数据后,点火。匀速调节“点火电源”开关至最大。这时,温度明显上升,当小数点后第一位变化0.2左右时,关掉点火开关。将电源旋在最小。操作的同时不要忘记记数据。
⑷.样品燃烧完后,要等记下来的数据变化幅度很小了,也就是小数点后的最后一位变化小于等于3时,记下10个这样的数据,就可以结束这次反应。
⑸.反应完后,放气(操作)。放气时,放气阀出口不要对着自己或他人。把氧弹打开来,检查一下是否完全燃烧。
点火及读数的注意点:a. 开总电源前察看点火开关的位置是否在“振荡”;
b. 搅拌等到体系温度有规律的变化,小于3%o可记录数据(5个点);
c. 打开点火开关,调大电流(匀速,防止瞬间加的电流过大,引火丝烧断),等到温度上升0.2后,调回“振荡”,电流将至最小;
d. 后每次鸣叫纪录一个数据,等到上升到最高点后纪录10个数据,停止实验(学生自己判断何时停止结束纪录)
2.6在进行下一次测量前,要将内筒水倒掉,擦干。搅拌棒取下来擦干水。氧弹中由于燃烧而产生的水也要擦干。需重新调节水温量取内筒水,外筒水温则不用再调。
4. 再简单讲一下操作全过程:
⑴称量;压片;测电阻;装氧弹;再测电阻;
⑵.调水温;准备好量热计;
⑶充氧;测电阻;把氧弹放入量热计中;记下外筒温度;
⑷.开电源;搅拌;点火;
⑸结束;放气;准备下一次测量。
6.作雷诺图的正确方法(可在实验结束后讨论中进行)。
