电导法测定PbSO4的溶度积
张玉 吴玲
一、实验目的
(1)掌握电导法测定难溶盐溶解度的原理和方法;
(2)掌握电导率仪的使用方法;
(3)注意有毒物质的排放。
二、基本原理
难溶电解质在水中会建立一种特殊的动态平衡。尽管难溶电解质无法溶解, 但仍有一部分阴阳离子进入溶液, 当这两个过程的速率相等时, 难溶电解质的溶解就达到平衡状态, 这样的平衡状态叫沉淀溶解平衡, 其平衡常数叫溶度积。在一定温度下, 一种难溶电解质的饱和溶液中形成一种多相离子平衡, 可表示为:
AmBn( s) ? nAm+ ( aq) + mBn- ( aq)
K sp= αn (Am+ ) αm( Bn- )
K sp 称为溶度积常数, 简称溶度积。若能测出难溶电解质的饱和溶液中相应离子浓度, 就可计算出溶度积。难溶盐的饱和溶液浓度很低,可以把浓度当做活度处理,即c≈α,所以:
K sp= cn (Am+ ) cm ( Bn- )
难溶盐PbSO4在其饱和溶液中存在如下溶解平衡:
PbSO4(s)?Pb2+(aq)+ SO42-(aq)
其溶度积为:
K sp= c (Pb2+ ) c (SO42-)=c(PbSO4)
本实验采用电导法测定PbSO4的溶度积,惠斯顿电桥
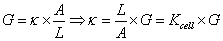
由电导率仪测出: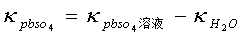
由离子独立移动定律,查表计算:
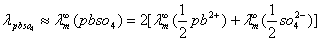
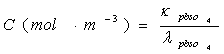 或
或 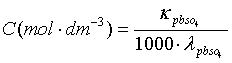
所以:
K sp=c2(mol.m-3)
因温度对溶液的电导有影响,本实验在恒温下测定。电导测定不仅可以用来测定硫酸铅、硫酸钡、氯化银、碘酸银等难溶盐的溶解度,还可以测定弱电解质的电离度和电离常数,盐的水解度等。
三、实验仪器与试剂
(1)仪器 电导率仪1台,恒温水浴装置1套,滤纸若干,洗瓶1只,烧杯若干,玻璃棒一根。
(2)试剂 KCl标准溶液(0.1mol/L),硝酸铅固体试样,去离子水。
四、实验步骤
(1)将恒温水浴温度调至25℃。
(2)制备PbSO4饱和溶液
准确称取PbSO4固体试样0.0045g(最好稍微过量一点),放入250ml烧杯中,用100ml容量瓶取100ml去离子水加入烧杯中,放入恒温槽中恒温并用玻璃棒搅拌溶解(由于PbSO4很难溶解,必要时用电炉加热溶解)。
(3)测定电导池常数kcell
取适量配置好的0.1mol/L KCl标准溶液,在恒温槽中恒温10分钟后,用电导率仪测其电导率,重复三次。
(4)测定电导水的的电导率
调节好电导率仪的电导池常数kcell,将电极和电导池用电导水洗干净并擦干,然后测电导水的电导率,重复三次。
(5)测定PbSO4饱和溶液的电导率
取适量的PbSO4饱和溶液于锥形瓶中并恒温,将电极用去离子水洗净,插入锥形瓶中测待测液的电导率,重复三次。
(6)拆洗实验仪器,含铅物质不能随便乱丢,要倒入指定点。
五、原始数据记录
气压:101.1KPa 室温:5 ℃ 实验温度:25℃
查相关文献得:25℃下,0.1mol/L KCl溶液的电导率为0.012852S/cm,PbSO4的溶解度为0.0045g每100g水,PbSO4的溶度积为2.53 10-8。
10-8。
氯化钾溶液的浓度:0.1mol/L
表1标准样品电导率测量数据表
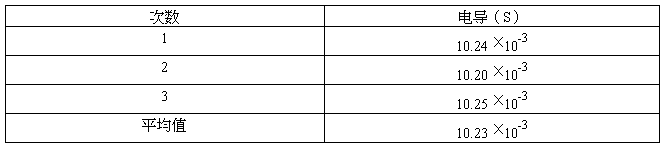
表2 样品PbSO4饱和溶液电导率测量数据表

六、数据处理
电导池常数 kcell 10=0.012852/(10.23
10=0.012852/(10.23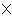 10-3)=1.254cm-1
10-3)=1.254cm-1
溶质的电导率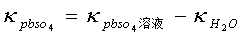 =51.2
=51.2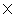 10-6-3.39
10-6-3.39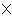 10-6
10-6
=47.81 10-6S/cm=47.81
10-6S/cm=47.81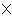 10-4S/m
10-4S/m
查附录表得: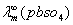 =
=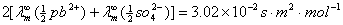
所以PbSO4饱和溶液的浓度: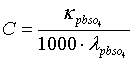 =47.81
=47.81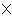 10-4/(1000
10-4/(1000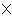 3.02
3.02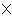 10-2)=1.58
10-2)=1.58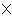 10-4mol/L
10-4mol/L
溶度积 Ksp= C 2 =(1.58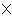 10-4)2 =2.50
10-4)2 =2.50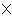 10-8
10-8
实验误差=(2.50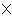 10-8-2.53
10-8-2.53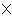 10-8)/2.53
10-8)/2.53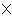 10-8
10-8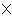 100%=-1.29%。
100%=-1.29%。
六、注意事项
(1)配制溶液需用电导水(电导率小于1us/cm)。处理方法是,向蒸馏水中加入少量高锰酸钾,用硬质玻璃烧瓶进行蒸馏。
(2)饱和溶液必须经三次煮沸制备,以除去可溶性杂质。
(3)温度对电导有较大影响,所以测电导率时必须在恒温槽中恒温后方可测定。
(4)铂黑电极上的溶液不能擦,用滤纸吸,以免破坏电极表面积。电极不用时,应保存在蒸馏水中不可使之干燥,防止电极干燥老化。
(5)测水及溶液电导前,电极要反复冲洗干净,特别是测水前。
七、结果讨论
误差分析:制备PbSO4饱和溶液时,可能还没有达到饱和就开始试验了。
第二篇:实验电导法测难溶盐的溶度积
实验 电导法测难溶盐的溶度积
一、实验目的
1. 掌握电导测定的原理和电导仪的使用方法。
2. 通过实验验证电解质溶液电导与浓度的关系。
3. 掌握电导法测定BaSO4的溶度积的原理和方法。
二、实验原理
导体导电能力的大小常以电阻的倒数去表示,即有

式中G称为电导,单位是西门子S。
导体的电阻与其长度成正比与其截面积成反比即:

ρ是比例常数,称为电阻率或比电阻。根据电导与电阻的关系则有:
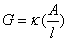
κ称为电导率或比电导

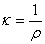
对于电解质溶液,浓度不同则其电导亦不同。如取1mol电解质溶液来量度,即可在给定条件下就不同电解质溶液来进行比较。1mol电解质溶液全部置于相距为1m的两个平行电极之间溶液的电导称之为摩尔电导,以λ表示之。如溶液的摩尔浓度以c表示。则摩尔电导可表示为
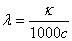
式中λ的单位是S.m2.mol-1,c的单位是mol.L-1。λ的数值常通过溶液的电导率k式计算得到。
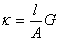 或
或 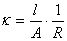
对于确定的电导池来说l/A是常数,称为电导池常数。电导池常数可通过测定已知电导率的电解质溶液的电导(或电阻)来确定。
在测定电导率时,一般使用电导率仪。使用电导电极置于被测体系中,体系的电导值通过电子线路处理后,通过表头或数字显示。每支电极的电导池常数一般出厂时已经标出,如果时间太长,对于精密的测量,也需进行电导池常数校正。仪器输出的值为电导率,有的电导仪有信号输出,一般为0~10mV的电压信号。
在测定难溶盐BaSO4的溶度积时,其电离过程为
BaSO4 → Ba2+ + SO42-
根据摩尔电导率Λm与电导率κ的关系: 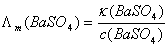
电离程度极小,认为溶液是无限稀释,则可Λm用Λm∞代替。
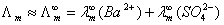
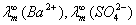 可通过查表获得。
可通过查表获得。
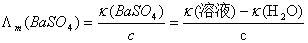
而 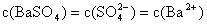
所以 
这样,难溶盐的溶度积和溶解度是通过测定难溶盐的饱和溶液的电导率来确定的。很显然,测定的电导率是由难溶盐溶解的离子和水中的H+和OH-所决定的,故还必须要测定电导水的电导率。
三、仪器和试剂
DDS—11C型电导仪1台; 电子天平 1台;
电导电极(铂黑) 1支; 电热套 1个;
锥形瓶 250mL 1个; 烧杯 100mL 1个;
BaSO4(AR)。
四、实验步骤
1. 蒸馏水的电导测定
取约100mL蒸馏水煮沸、冷却,倒入一干燥烧杯内,插入电极,读三次,取平均值。
2. 测定BaSO4的溶度积:
(1)称取1g BaSO4放入250mL锥形瓶内,加入100mL蒸馏水,摇动并加热至沸腾,倒掉上层清液,以除去可溶性杂质,重复2次。
(2)再加入100mL蒸馏水,加热至沸腾,使之充分溶解。冷却至室温,将上层清液倒入一干燥烧杯中,插入电极,测其电导值,读3次,取平均值。
五、数据处理
BaSO4溶度积测定
饱和溶液

电导水

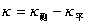
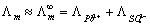
c = κ/1000Λm
计算BaSO4的溶度积与文献值比较。
六、实验注意事项
1. 实验用水必须是重蒸馏水,其电导率应≦1*10-4S.M-1。
2. 实验过程中温度必须恒定,稀释的电导水也需要在同一温度下恒温后使用。
3. 测量BaSO4溶液时,一定要沸水洗涤多次,以除去可溶性离子,减小实验误差。
七、思考题
1. 本实验为何需要测量水的电导率?
2. 实验中为何用镀铂黑的电极?使用时注意事项有哪些?
3. 在连续滴定法中,混和液体积的计算是近似的,为什么?如何控制实验条件,尽量地减少误差?
附录:电导率仪(DDS-11系列)的原理与使用
DDS-11A型电导率仪的测量范围广,可以测定一般液体和高纯水的电导率,操作简便,可以直接从表上读取数据,并有0mV~10mV讯号输出,可接自动平衡记录仪进行连续记录。
1) 测量原理
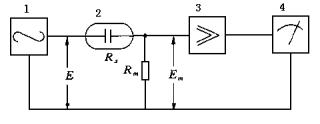

电导率仪的工作原理如图16-3所示。把振荡器产生的一个交流电压源E,送到电导池Rx与量程电阻(分压电阻)Rm的串联回路里,电导池里的溶液电导愈大,Rx愈小,Rm获得的电压Em也就越大。将Em送至交流放大器放大,再经过讯号整流,以获得推动表头的直流讯号输出,表头直读电导率。
2)测量范围
(1)测量范围:0μS·cm-1~105μS·cm-1,分12个量程。
(2)配套电极:DJS-1型光亮电极,DJS-1型铂黑电极,DJS-10型铂黑电极。光亮电极用于测量较小的电导率(0μS·cm-1~10μS·cm-1),而铂黑电极用于测量较大的电导率(10μS·cm-1~105μS·cm-1)。通常用铂黑电极,因为它的表面比较大,这样降低了电流密度,减少或消除了极化。但在测量低电导率溶液时,铂黑对电解质有强烈的吸附作用,出现不稳定的现象,这时宜用光亮铂电极。
3)使用方法
DDS-11A型电导率仪的面板如图16-4所示。
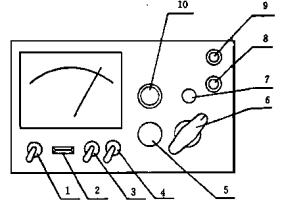

(1)打开电源开关前,应观察表针是否指零,若不指零时,可调节表头的螺丝,使表针指零。
(2))根据电极选用原则,选好电极并插入电极插口。各类电极要注意调节好配套电极常数。将校正、测量开关拨在“校正”位置。
(3)插好电源后,再打开电源开关,此时指示灯亮。预热数分钟,待指针完全稳定下来为止。调节校正调节器,使表针指向满刻度。
(4)根据待测液电导率的大致范围选用低周或高周,并将高周、低周开关拨向所选位置。
(5)将量程选择开关拨到测量所需范围。如预先不知道被测溶液电导率的大小,则由最大档逐档下降至合适范围,以防表针打弯。
(6)倾去电导池中电导水将电导池和电极用少量待测液洗涤2~3次,再将电极浸入待测液中并恒温。
(7)将校正、测量开关拨向“测量”,这时表头上的指示读数乘以量程开关的倍率,即为待测液的实际电导率。
(8)当用0μS·cm-1~0.1μS·cm-1或0μS·cm-1~0.3μS·cm-1这两档测量高纯水时,在电极未浸入溶液前,调节电容补偿调节器,使表头指示为最小值(此最小值是电极铂片间的漏阻,由于此漏阻的存在,使调节电容补偿调节器时表头指针不能达到零点),然后开始测量。
(9)10mV的输出可以接到自动平衡记录仪或进行计算机采集。
4)注意事项
(1)电极的引线不能潮湿,否则测量不准确。
(2)高纯水应迅速测量,否则空气中CO2溶入水中变为CO32-离子,使电导率迅速增加。
(3)测定一系列浓度待测液的电导率,应注意按浓度由小到大的顺序测定。
(4)盛待测液的容器必须清洁,没有离子玷污。
(5)电极要轻拿轻放,切勿触碰铂黑。
(6)清洗电极,并用滤纸吸干多余最后淋洗的电导水,切勿损伤电极。
(7)对于电导率不同的体系,应采用不同的电极。
电导率低于10-5Ω-1cm-1时使用光亮电极;
电导率在10-5 – 10-2Ω-1cm-1时使用DJS-1铂黑电极;
电导率大于10-2Ω-1cm-1时使用DJS-10铂黑电极。此时电极常数调到1/10的位置,测出的结果乘以10。
附录3:重蒸馏水;
蒸馏水是电的不良导体。但由于溶有杂质,如二氧化碳和可溶性固体杂质,它的电导显得很大,影响电导测量的结果,因而需对蒸馏水进行处理。
处理的方法是,向蒸馏水中加人少量高锰酸钾,用硬质玻璃烧瓶进行蒸馏。本实验要求水的电导率应小于1×10-4S.m-
