一、实验目的
1. 掌握阳极极化曲线测试的基本原理和方法;
2. 测定Zn电极在1M KOH溶液和1M ZnCl2溶液中的阳极极化曲线;
3. 通过实验理解金属电极钝化与活化过程。
二、实验原理
线性电位扫描法是指控制电极电位在一定的电位范围内,以一定的速度均匀连续的变化,同时记录下各电位下反应的电流密度,从而得到电位-电流密度曲线,即稳态电流密度与电位之间的函数关系:i= f(ψ)。
特别适用于测量电极表面状态有特殊变化的极化曲线。如下:如阳极钝化行为的阳极极化曲线。
阳极极化:金属作为阳极时在一定的外电势下发生的阳极溶解过程叫做阳极极化,如下式所示:M = Mn+ + ne 【金属的钝化现象:阳极的溶解速度随电位变正而逐渐增大。这是正常的阳极溶出。但当阳极电位正到某一数值时,其溶解速度达到一最大值。此后阳极溶解速度随着电位变正,反而大幅度的降低,这种现象称为金属的钝化现象。】 线性电位扫描法不但可以测定阴极极化曲线,也可以测定阳极极化曲线,特别适用于测定电极表面状态有特殊变化的极化曲线,如测定具有阳极钝化行为的阳极极化曲线,用线性电位扫描法测得的阳极极化曲线,如下图所示
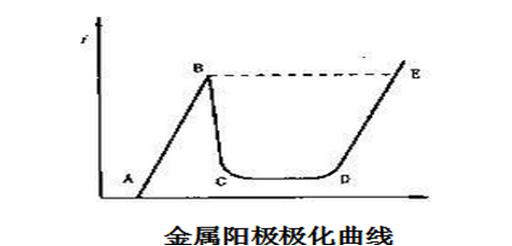
? AB段-----称为活性溶解区;此时金属进行正常的阳极溶解,阳极电流随电位改变服从Tafel公式的半对数关系。
? BC段-----称为钝化过渡区;此时是由于金属开始发生钝化,随着电极电位的正移,金属的溶解速度反而减小了。
? CD段-----称为钝化稳定区;在该区域中金属的溶解速度基本上不随电位二改变;
? DE段-----称为过度钝化区;此时金属溶解速度重新随电位的正移而增大,为氧的析出或者高价金属离子的生成。
从阳极极化曲线上可以得到下列参数:c点对应的电位---临界钝化电位;c点对应的电流—临界钝化电流密度;而这些参数恒电流法是测不出来的。
影响金属钝化的因素很多,包括溶液的组成、金属的组成和结构以及外界条件。
金属Zn是中性锌锰电池、碱性锌锰电池和锌-空气电池等的负极材料,其电化学行为受到广泛的研究。本实验应用线性电位扫描法测量金属Zn电极在1M KOH和1M ZnCl2 中阳极极化曲线。实验中控制电极电位以较慢的速度连续地改变(扫描),并测量对应电位下的瞬时电流值,并以瞬时电流与对应的电极电位作图,获得整个的极化曲线,故称为动电位法。
三、实验器材
CHI电化学工作站、锌电极、Hg/HgO电极、甘汞电极、铂电极、三口电解槽、1M KOH溶液250ml、1M ZnCl2溶液250ml。
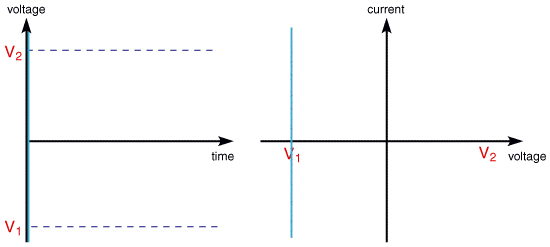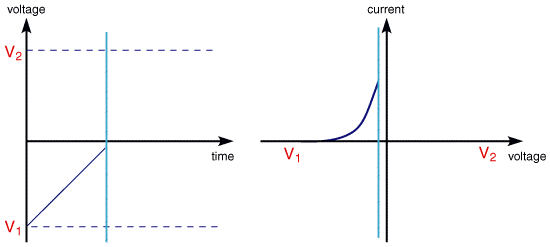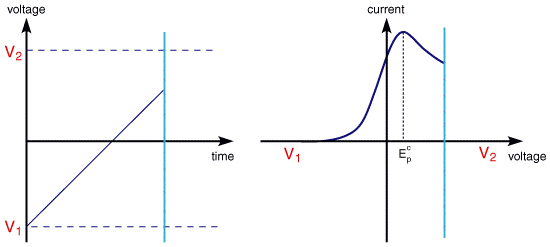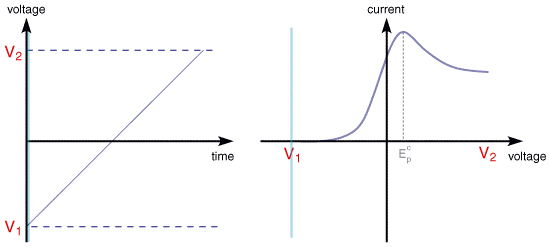
左:仪器施加的电压信号;
右:测量到的电流-电压关系曲线(极化曲线)

控制电压方法的测量回路和极化回路
四、实验步骤
(1)电极预处理
将锌电极在砂纸上轻轻打磨至光亮,除去氧化膜,用去离子水冲洗干净,铂电极用硫酸浸泡以除去表面杂质,并用去离子水冲洗。
(2)极化曲线测定
启动工作站,运行CHI测试软件,在Setup菜单中单击“Technique”选项,在弹出菜单中选择电化学工作站中的线性电位扫描技术(Linear Sweep Voltammetry)分别测量Zn电极在1M KOH溶液和1M ZnCl2溶液中常温和450C的阳极极化曲线(扫描速率5mV/s,从开路到截止电压分别为-1.0V和-0.5V) 。
(3)测试完成
关闭仪器,将电极清洗干净待用。
四、实验数据处理及分析
1.每种溶液中不同温度下的极化曲线叠加在同一张图中。

图1.Zn电极在KOH溶液中,不同温度下的阳极极化曲线
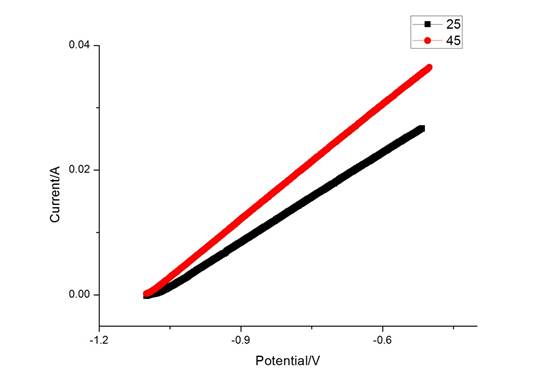
图2. Zn电极在ZnCl2溶液中,不同温度下的阳极极化曲线
2. 结合文献,指出图中的活性溶解区、过渡钝化区、稳定钝化区和过度钝化区。
以图一45℃为例,AB为活性溶解区,BC为过渡钝化区,CD为稳定钝化区,D之后有一段电流随电势的增加而上升的过度钝化区DE,本次实验结果并没看到。
3. 比较不同溶液中电极的阳极极化行为。尝试分析原因。
3.1 Zn电极在KOH溶液中,不同温度下的阳极极化分析(如图1)
3.1.1 25℃下,Zn电极在KOH溶液中的极化
25℃时,从开路电位正向扫描到第一个峰之间为活性溶解区。此时电极上的Zn被氧化成Zn2+离子,电极正常溶解,产生氧化电流,无钝化现象。峰对应的电流为氧化电流Ipa=0.00244,氧化峰对应的电位为氧化峰电位jpa= -1.2,也称为临界钝化电流、临界钝化电势。
此后,曲线出现三个峰,为过渡钝化区。电流随着电势增加,经过一番波动之后,迅速减至最少。这是因为在金属表面产生了一层电阻高,耐腐蚀的钝化膜(ZnO或Zn(OH)2)。而产生波动的原因是刚开始生成的Zn的氧化物不致密,容易脱落,电极表面在重复生成钝化膜和脱落的过程,最后,随着电势的增加,生成了致密的氧化膜,使电流迅速下降至最小。
电势继续增加,电流基本不变地保持在一个很小的数值上,该区为钝化稳定区,该电流称为钝化电流。
由于扫描的终止电压定得比较小,所以并没有看到过度钝化区。过度钝化区是随着电势的继续增大,电流再次随着电势上升而增大,表示阳极又发生了氧化过程,可能是高阶金属离子产生,也可能是水分解放出氧气。
3.1.2 45℃下,Zn电极在KOH溶液中的极化
在45℃下的曲线与25℃同理。但因为在温度高是氧化过程更容易进行,使电极表面一开始钝化时,就产生了致密的钝化膜,而在过渡钝化区看不到波动,只有一个峰。
3.2 Zn电极在ZnCl2溶液中,不同温度下的阳极极化分析(如图2)
3.2 Zn电极在ZnCl2溶液中,不同温度下的阳极极化分析
3.2.1 25℃下,Zn电极在ZnCl2溶液中的极化
随着电势的增加,电流一直在上升。此时电极上的Zn被氧化成Zn2+离子,电极正常溶解,产生氧化电流,无钝化现象。因为Zn电极在ZnCl2溶液中不会钝化,所以没有出现氧化峰,一直处于活性溶解区。
3.2.2 45℃下,Zn电极在ZnCl2溶液中的极化
与25℃下同理。
3.3对比25℃和45℃下,Zn电极在KOH溶液中的极化
对比45℃下和25℃下的氧化峰对应的电流,明显可以看出,两者都是高温下比低温下要大。因为温度越高,离子迁移速率越快,浓差极化越小;电化学反应速率加快,电化学极化变小,所以临界钝化电流增大。
4.根据不同温度下氧化峰面积的大小,比较温度对氧化电量的影响。
以图1为例,对图1的两条曲线的氧化峰积分得, S45℃= 6.5936285*10-4,S25℃= 4.6644505*10-4,S45℃> S25℃,由于S表示了U*I/v(扫描速度)=I*t=Q,所以对于相同电极,相同电解质而言,温度越高,氧化电量越大。
五、参考文献
覃奇贤,刘淑兰 . 电极的极化和极化曲线(Ⅰ).天津大学 化工学院,天津 300072
覃奇贤,刘淑兰 . 电极的极化和极化曲线(Ⅱ).天津大学 化工学院,天津 300072
第二篇:电极的极化和极化曲线_电极的极化
?28?Jun.2008 PlatingandFinishing Vol.30No.6SerialNo.183
文章编号:1001-3849(2008)06-0028-03
电极的极化和极化曲线(Ⅰ)
——电极的极化
?
覃奇贤, 刘淑兰
(天津大学化工学院,天津 300072)
摘要:对金属表面处理技术中遇到的有关电极电位、电极过程的速度控制步骤及电极的极化等基本概念,做了深入浅出的解释。重点介绍了电极极化产生的原因,极化的分类,标准电极电位、平衡电极电位和稳定电位之间的区别和联系,电极电位的测量及标度,极化曲线在电镀中的应用举例,以及在测量中经常遇到的一些问题,如正确选用参比极化,参比电极的制做,液体接界电位及其消除等。
关 键 词:电极电位;电化学极化;电镀;极化曲线中图分类号:TQ153 文献标识码:B
PolarizationofElectrodeandPolarization
Curve(Ⅰ)
——PolarizationofElectrode
QINQi-xian,LIUShu-lan
引 言
在金属表面处理工艺的研究和生产实践中,经常会遇到电极电位、极化及电极电位与电流密度之间的关系等基本概念,例如电沉积合金的基本条件,必须考虑合金组分的标准电极电位和阴极极化的大小。选择晶粒细化剂及光亮添加剂等,要考查阴极电极电位(或过电位)与阴极电流密度之间的关系[2]。研究镀层的耐蚀性要测量腐蚀电流及腐蚀电位等等。有些电极电位的数据如水溶液中一些电极的标准电极电位
[4]
[3]
[1]
1 电极电位
1.1 电极与溶液界面间的电位差
在电镀槽内阴极与阳极间有电流通过时,均有电极反应发生(包括主反应和副反应),其反应速度大小的重要决定因素之一,是界面间存在电场的作用,这个电场是由界面间存在的双电层给出的,电极反应的速度与双电层的电位有密切的关系。但是,迄今为止电极与溶液界面间的绝对电位差是无法测量的,也不能精确计算。因此,为了解决电化学问题,都是采用相对电位差的概念。即用参比电极与某待测电极组成原电池,测量原电池的电动势,用这一数值来描述某待测电极界面间电位差的相对大小。目前国际上均采用标准氢电极作参比电极来测量某待测电极的相对电位差。
和几种常见参比电极的电极电
位可以从手册上查到。而绝大多数数据都是靠实验测量,要使查到或测量获得的数据正确、可靠,能指导科研工作和生产实践,必须弄清楚有关的基本概念,并掌握正确的测量方法。
?
20xx年6月 电镀与精饰 第30卷第6期(总183期) ?29?
2)阳极极化 电流通过阳极时,电极电位向正方向移动,即EA比EA,e正,叫阳极极化。
3)过电位 当电极上有电流通过时,电极电位(EK或EA)将偏离平衡电极电位(EK,e或EA,e),二者
之差值叫过电位,以?E表示。
?E=E-Ee
阴极极化时,EK<EK,e,故?E<0阳极极化时,EA>EA,e,故?E>02.3 稳态极化曲线
稳态是指电极上通过的电流以及电极电位不随时间改变的状态。
在稳态下,测量得到的电流密度与电极电位(或过电位)之间的关系曲线叫做极化曲线。图1和图2为典型的稳态阴极极化曲线和阳极极化曲线。
1.2 电极电位的概念
1)氢标电极电位 氢标电极电位是一个特殊原电池的电动势,原电池中的正极是某待测电极[例如M?M
Z+
,a(M
+
Z+
)],负极是标准氢电极[Pt,H2(P=
+
100kPa)?H,a(H)=1],该原电池的电动势称做某待测电极的氢标电极电位,简称电极电位。
2)平衡电极电位 某电极反应的氧化态和还原态处于平衡状态下的氢标电极电位,以Ee表示。
3)标准电极电位 某电极反应的氧化态活度与还原态活度均为1时的平衡电极电位,以E0表示。
2 电极的极化
2.1 问题的提出
将两个可逆电极浸在装有同一种溶液的电解槽中,当电极上无电流通过时,两电极反应是可逆的,此时V=EA,e-EK,e,式中V为槽电压,EA,e和EK,e分别
为阳极的平衡电极电位和阴极的平衡电极电位。当有一定电流I通过电解槽时,则V′=EA-EK+IR,式中的R为电解液的欧姆电阻,EA和EK分别为有电流I通过时的阳极电极电位和阴极电极电位。因为I>0,故IR>0,则V′一定大于EA,e-EK,e,若这个差值全部是由IR引起的,则V′-(EA,e-EK,e)=IR,实际上V′的增加值超过了IR,表明,电解槽中有电流通过时,EA≠EA,e,EK≠EK,e,即两个电极的电极电位均偏离了平衡电极电位,而且通过电极的电流不同,EA和EK的变化也不一样,这样就引出了电极的极化这一概念。
电镀槽的槽电压V在生产中需要经常测量,它可以计算电镀生产中电能的消耗,还可以判断电镀生产是否正常。但是,槽电压是一个多种因素综合的数据,它的变化不能反映出是哪一项发生了变化。为了针对性地解决问题,必须弄清每一项的变化情况。其中镀液的欧姆压降IR,I是已知的,R可通过镀液电导率的测量得到。而阴极和阳极电极电位随I的变化必须分别进行测量,这就是下面即将讨论的电极的极化,为了消除电极面积对电极电位的影响,采用单位面积上通过的电流,即电流密度。
2.2 电极的极化
当有电流通过电极时,电极电位偏离平衡电极电位的现象叫电极的极化。
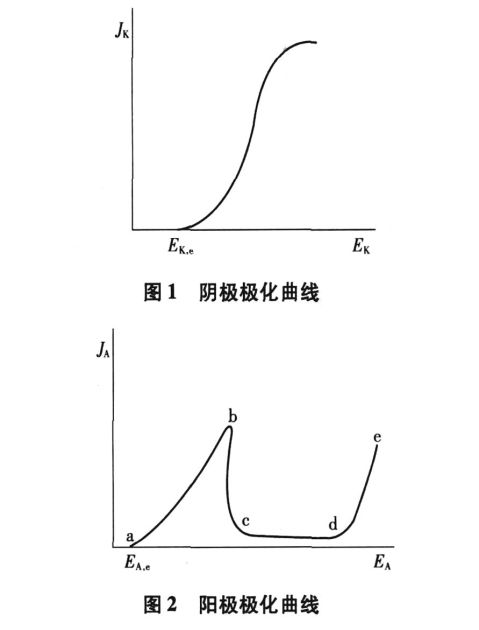
1)阴极极化 电流通过阴极时,电极电位向负2.4 电极过程的速度控制步骤
电极过程是由几个不同的单元步骤组成的,有时还可能有平行的步骤存在。最简单也是最基本的电极过程应包括三个接续进行的步骤,以电沉积金属的阴极过程为例,三个必不可少的接续进行的步骤为:1)欲沉积的金属离子自主体溶液向阴极表面附近液层输送,即液相传质步骤;2)金属离子在阴极与溶液界面间得电子还原为金属原子,叫做电子转移步骤;3)还原的金属原子进入晶格形成金属晶体,叫做新相生成步骤。在相同的推动力下,几个接续进
?30?Jun.2008 PlatingandFinishing Vol.30No.6SerialNo.183
步骤接续进行时,在稳态下,整个电极过程的速度由速度最慢的那个单元步骤控制,电极过程的速度由它决定,这个控制着整个电极过程速度的最慢的单元步骤就叫做速度控制步骤。2.5 电化学极化和浓度极化2.5.1电化学极化
1)交换电流密度 将金属M浸入含有M
z+
镀层,这是因为铁、钴及镍的电极反应的J0小,产生比较大的电化学极化。而与它们的J0相差几千倍的锌及铜等,若采用简单盐电镀液,则需加入添加剂,或者采用络合物电解液,以增大电化学极化,获得合格的镀层。2.5.2浓度极化
离子1)什么叫浓度极化 浓度极化又叫做浓差极化,有些电极反应的交换电流密度很大,也即是电子转移步骤的阻力很小,液相传质步骤成为控制步骤,由于液相传质困难,使得电极电位偏离平衡电位的现象叫浓度极化。
2)极限电流密度 某金属离子还原为金属的电极过程,若液相传质为控制步骤时,随着阴极电流密度的增加,紧靠电极表面附近液层中反应物的浓度将逐渐减小,极限情况下降到0,此时的电流密度最大,叫做极限电流密度,以Jd表示。
在电镀工艺规范中,一般都给出阴极电流密度的上限和下限值,其中下限值是为了保证一定的沉积速度,而上限值则是为了避免金属电沉积发生浓度极化,因为浓度极化控制下得到的是疏松多孔或海绵状镀层,毫无实用价值。通常生产中采用阴极移动、机械搅拌、空气搅拌及镀液循环等措施来减小液相传质的阻力,增大允许使用的电流密度上限值。但是金属电沉积的另一个特例,即电化学方法制取金属粉末,则是要在液相传质步骤控制下进行,使电极反应在极限电流密度下进行。参考文献:
[1] 覃奇贤,郭鹤桐,刘淑兰,等.电镀原理与工艺[M].天
津:天津科学技术出版社,1993.234.
[2] 郭鹤桐,覃奇贤.电化学教程[M].天津:天津大学出
版社,2000.92,325-328.
[3] DobosD.ElectrochemicalData[M].NewYork:
ElserierScientificPublishingCompany,1975.250.
[4] 朱元保,沈子琛,张传福,等.电化学数据手册[M].长
沙:湖南科学技术出版社,1985.230-232.
的溶液中,在两相界面间便发生了物质的转移和电荷的转移,最后建立了物质平衡和电荷平衡,其电极电位即为平衡电极电位。此时界面间金属离子的还原速度等于金属的氧化速度,以电流密度J0表示,叫做交换电流密度。
2)电化学极化 以金属电沉积的阴极过程为例,当对镀液进行强烈搅拌,使液相传质步骤无任何困难,将处于平衡状态下的阴极通以外电流,此时电极与镀液界面间的还原反应速度一定大于氧化反应速度,由于电子转移步骤存在着阻力,还原反应不能将外电源输送的电子全部消耗,电极表面负的剩余荷增加,使得电极电位向负方向移动,即产生了极化。这种由于电子转移步骤的阻力引起的电极的极化叫做电化学极化。
3)交换电流密度与电化学极化的关系
交换电流密度J0是描述电极处于平衡状态的参量,但是它与平衡电极电位Ee不同,Ee是热力学函数,而J0是动力学函数。两个Ee相同的电极,其J0可以相差几千倍。J0大的电极,当有外电流通过时,电极反应比较容易进行,则电极电位相对于Ee的移动数值小,即电化学极化小。相反,J0小的电极,当有外电流通过时,电极反应的阻力大,电极电位相对于Ee的移动数值大,即电化学极化大。J0的数值可以从手册上查出,也可以实验测量。J0与电极反应的本性、温度及反应物的浓度有关。
在电镀中,无论哪种使用场合的镀层,都要求结构致密,表面光滑平整,这样的镀层只能在电化学极化比较大的条件下完成。分析一下生产中沿用多年的电镀液可以发现,只有电镀铁、钴和镍能够从不加添加剂的简单盐镀液中获得结晶细致、平整光滑的
(待续)
《实用电铸技术》
由刘仁志编著、化学工业出版社出版的《实用电铸技术》已于20xx年9月在全国各地新华书店发行。化学工业出版社 机械电气分社 金属材料编辑部 Tel:010-64982530,地址:(100029)北京市朝阳区惠新里3号:...
