稀溶液法测定偶极矩
一、实验目的
(1)掌握溶液法测定偶极矩的主要实验技术
(2)了解偶极矩与分子电性质的关系
(3)测定正丁醇的偶极矩
二、实验原理
2.1偶极矩与极化度
分子结构可以近似地看成是由电子云和分子骨架(原子核及内层电子)所构成。由于空间构型的不同,其正负电荷中心可能重合,也可能不重合。前者称为非极性分子,后者称为极性分子。
1912年,德拜提出“偶极矩”的概念来度量分子极性的大小,其定义是
 (1)
(1)
式中,q是正负电荷中心所带的电量;d为正负电荷中心之间的距离; 是一个矢量,其方向规定为从正到负,的数量级是10-30C·m。
是一个矢量,其方向规定为从正到负,的数量级是10-30C·m。
通过偶极矩的测定,可以了解分子结构中有关电子云的分布和分子的对称性,可以用来鉴别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩指向某个方向的机会均等。所以偶极矩的统计值等于零。若将极性分子置于均匀的电场E中,则偶极矩在电场的作用下,趋向电场方向排列。这时称这些分子被极化了。极化的程度可以用摩尔转向极化度Pμ来衡量。Pμ与永久偶极矩μ的平方成正比,与绝对温度T成反比。
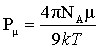 (2)
(2)
式中,k为波兹曼常数;NA为阿弗加德罗常数;T为热力学温度;μ为分子的永久偶极矩。
在外电场作用下,不论极性分子或非极性分子,都会发生电子云对分子骨架的相对移动,分子骨架也会发生形变。这称为诱导极化或变形极化。用摩尔诱导极化度P诱导来衡量。显然,P诱导可分为两项,即电子极化度Pe和原子极化度Pa,因此
P诱导 = Pe + Pa (3)
如果外电场是交变场,极性分子的极化情况则与交变场的频率有关。当处于频率小于1010HZ的低频电场或静电场中,极性分子所产生的摩尔极化度P是转向极化、电子极化和原子极化的总和。
P = Pμ+ Pe +Pa (4)
介电常数实际上是在107HZ一下的频率测定的,测得的极化度为 Pμ+ Pe +Pa。若把频率提高到红外范围,分子已经来不及转向,此时测得的极化度只有Pe和Pa的贡献了。所以从按介电常数计算的P中减去红外线频率范围测得的极化,就等于Pμ,在实验上,若把频率提高到可见光范围,则原子极化也可以忽略,则在可见光范围:
Pμ =P -( Pe +Pa) ≈ P - Pe (5)
2.2 摩尔极化度的计算
摩尔极化度P与介电常数 ε 之间的关系式。
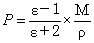 (6)
(6)
式中,M为被测物质的摩尔质量;ρ 为该物质的密度;ε 是介电常数。
但式(6)是假定分子与分子间没有相互作用而推导得到的。所以它只适用于温度不大低的气相体系,对某种物质甚至根本无法获得气相状态。因此后来就提出了用一种溶液来解决这一困难。溶液法的基本想法是,在无限稀释的非极性溶剂中,溶质分子所处的状态和气相时相近,于是无限稀释溶液中的溶质的摩尔极化度可以看作是式(6)中的P。
在稀溶液中,若不考虑极性分子间相互作用和溶剂化现象,溶剂和溶质的摩尔极化度等物理量可以被认为是具有可加性。因此,式(6)可以写成:
 (7)
(7)
式中,下标1表示溶剂;下标2表示溶质;x1表示溶剂的摩尔分数;x2表示溶质的摩尔分数;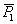 表示溶剂的摩尔极化度;
表示溶剂的摩尔极化度; 表示溶质的摩尔极化度。
表示溶质的摩尔极化度。
对于稀溶液,可以假设溶液中溶剂的性质与纯溶剂相同,则
 (8)
(8)
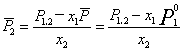 (9)
(9)
Hedestrand 首先推导出经验公式,指出在稀溶液中溶液的介电常数和密度可以表示为
 (10)
(10)
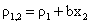 (11)
(11)
因此

 (12)
(12)
做ε1,2-x2图,根据式(7)由直线测得斜率a,截距ε1;作ρ1,2 -x2图,并根据式 (11)由直线测得斜率b,截距ρ1,代入式(12)得
2.3由折光度计算电子极化度Pe
电子极化度可以使用摩尔折光度R代替,即
 (13)
(13)
根据测量的溶液折射率n1,2作图n1.2-x2,由斜率求出c,就可以按照式(13)计算出Pe 。
2.4介电常数的测定
介电常数是通过测定电容计算而得的。如果在电容器的两个板间充以某种电解质,电容器的电容量就会增大。如果维持极板上的电荷量不变,那么充电解质的电容器两板间电势差就会减少。设C0为极板间处于真空时的电容量,C为充以电解质时的电容量,则C与C0的比值ε称为该电解质的介电常数:
ε = (14)
法拉第在1837年就解释了这一现象,认为这是由于电解质在电场中极化而引起的。极化作用形成一个反向电场,因而抵消了一部分外加电场。
测定电容的方法一般有电桥法、拍频法和谐振法,后两者为测定介电常数所常用,抗干扰性能好,精度高,但仪器价格昂贵。本实验中采用电桥法。实际所测得的电容C'样品包括了样品的电容C样品和电容池的分布电容Cx两部分,即
C'样品 = C样品 + Cx (15)
对于给定的电容池,必须先测出其分布电容 Cx。可以先测出以空气为介质的电容,记为C'空 ,再用一种已知介电常数的标准物质,测得其电容C'标 。
C'空 = C空 + Cx
C'标 = C标 + Cx
又因为
ε标 = ≈
可得
Cx = C'空 - (16)
C0 = (17)
计算出 Cx 、C0 之后,根据式(6)和式(15)可得样品的介电常数:
ε溶 = (18)
2.5偶极矩的计算
通过上述步骤分别计算出 、
、 之后,根据式(2)可得:
之后,根据式(2)可得:
 (19)
(19)
三、仪器与试剂
3.1仪器
电容测量仪器、25mL容量瓶、移液管、电子天平、阿贝折射计、滴管、烧杯、洗耳球、干燥器等
3.2试剂
正丁醇(分析纯),环己烷(分析纯),丙酮(分析纯)
四、实验步骤
4.1室温的测定
25.6℃
4.2 溶液配制
将4个干燥的容量瓶编号,称量并记录空瓶重量。在空瓶内分别加入0.5mL、1.0mL、1.5mL和2.0mL的正丁醇再称重。然后加环己烷至刻度线,称重。操作时应注意防止溶质、溶剂的挥发以及吸收极性较大的水汽。为此,溶液配好以后应迅速盖上瓶塞,并置于干燥器中。实验数据见表1.
4.3折射率的测定
用阿贝折射仪测定环己烷及配制溶液的折射率,注意测定时各样品需加样两次,读取数据,计算时取平均值。实验数据见表2.
4.4介电常数的测定
本实验采用环己烷作为标准物质,其介电常数的温度公式为:
ε环 = 2.023-0.0016(t-20) (20)
式中,t为温度,℃。
打开电容测量仪,待读数稳定后,记录空气的电容值。分别测量纯环己烷和配制的4个样品溶液的电容,记录测量的数据。每个样品测量两次,计算时取平均值。测量一个样品后,需用滤纸把残留样品吸干,用吹风机吹干样品池后才能继续测量。注意,用吹风机吹样品池的时候不能用热风,以防样品池温度放生改变带来误差。实验数据见表4.
五、数据记录与处理
5.1溶液配制数据及计算摩尔分数x2
表1.溶液配制数据记录

5.2折射率的测定数据记录
表2.折射率的测定数据记录

5.3绘制折射率n1,2和溶液摩尔分数x2的工作曲线
表3. n1,2-x2数据记录表

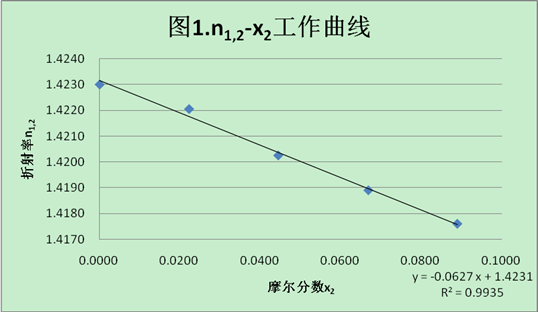
由工作曲线可知,斜率c为-0.0672。
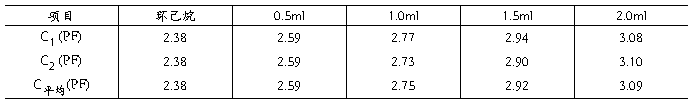
5.4电容的测定数据记录以及相关常数值、电容值的计算
表4.电容的测定实验数据
测得空气电容C空‘:-0.11PF 温度t:25.6℃
根据环己烷的介电常数温度公式(20),求得环己烷的介电常数为
ε标 = 2.023-0.0016(t-20)= 2.01404
本实验采用环己烷作为标准物质,其电容值为C标‘=2.38PF
由式(16)求得电容池的分布电容Cx = C'空 - =-2.57PF
由式(17)求得极板处于真空时的电容C0 = =2.46PF
根据式(18)ε溶 = ,求得各浓度乙酸乙酯样品的介电常数
表5.各摩尔分数乙酸乙酯样品液的介电常数

根据表5,绘出介电常数工作曲线ε与摩尔分数x2的工作曲线。

由工作曲线可得,斜率a=3.0565,截距ε1=2.0304.
5.5绘制溶液密度ρ1,2与摩尔分数x2的工作曲线
表6. 溶液密度ρ1,2与摩尔分数x2的数据记录表

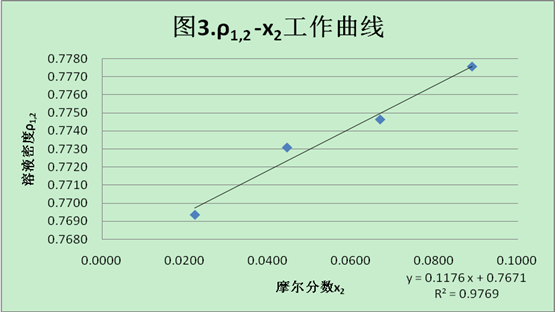
根据工作曲线,可得直线斜率b=0.1176,截距ρ1=0.7671.
5.6摩尔极化度 的计算
的计算
根据式(12),得乙酸乙酯的摩尔极化度为
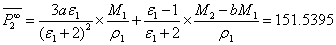
5.7电子极化度Pe的计算
根据式(13),得电子极化度
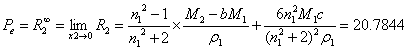
5.8偶极矩μ的计算
根据式(19),的乙酸乙酯的偶极矩为

六、分析与讨论
稀溶液法测定乙酸乙酯的偶极矩,涉及的参数很多,每一个参数的测定都必然会带入误差。若果要保证实验最终结果的准确性,则每一步都必须按照实验章程,避免操作失误,把系统误差降至最低。
实验的第一步是溶液的配制,与常规的溶液配制不同,本次实验中,溶液的配制与溶液的称重是同时进行的。使用吸量管吸取一定量的乙酸乙酯要保证读数准确,于容量瓶中定容时必须保证刻线与凹液面相切。容量瓶要提前贴好标签,乙酸乙酯是挥发性的液体,往容量瓶中加液后,要立刻盖上容量瓶盖。定容后,无需摇匀,否则后使乙酸乙酯挥发速度加快。挥发强度大的时候可观察到分析天平示数一直下降,称量时要关好分析天平的玻璃门以降低空气流速。所有仪器都必须干燥,不能接触水,洗后要烘干后才可以使用,水是极性分子,会影响到乙酸乙酯偶极矩的测定。
实验的第二步是折射率的测定,这一步涉及阿贝折射计的使用。一般来说,往样品台滴加2~3滴溶液,基本上可以满足测量需要,但是考虑到测量的是挥发性样品,将溶液的滴加数量增加至5滴,滴加后要迅速关上样品台。读数时,要注意小数位的估读,对于同一样品前后两次测量的误差大于0.0003的情况,就应该进行第三次测量。本次折射率的测量,至少要测量15次,加上超过误差范围需要重新测量的情况,几乎要测量25次,到后期会感到明显的视觉疲劳,在一定程度上影响读数的准确性,如果时间许可,最好让眼睛稍作休息后再继续试验。
试验的第三步是介电常数的测定,这一步要借助于电容测量仪器,测量一个样品后,需要用滤纸将残留样品吸干,等样品池干燥后在继续测量,否则不同的样品互相影响,导致测量结果失实。另外要尽量保证溶液的组成不变,取完溶液后要立刻盖上容量品盖子,防止乙酸乙酯挥发。
本次实验的操作过程不长,但数据处理方面较为繁琐复杂。使用excel软件处理数据,输入相关公式可自动生成相应的结果,使用最小二乘法得出工作曲线图。
查阅相关文献,关于本实验的改进方法包括电容测量仪器的改造,以及数据处理方法上应用Matlab,SPSS等专业的数据处理软件,以简化数据处理过程,但对软件使用的技术要求较高。或者应用Guggenheim-Smith提出的简化和改进方法,用质量分数对折射率和介电常数作图,可以省去测量溶液密度的步骤。
七、参考文献
[1]何广平,南俊民等.物理化学实验[M].北京:化学工业出版社,2008,134-139.
[2] 史振民,张竹莲等.溶液法测定偶极矩实验的误差分析及其改进[J]. 延安大学学报( 自然科学版),1996,15(1):83-87.
[3] 张力. 影响偶极矩测定因素分析及解决方法[J]. 希望月报,2007
第二篇:溶液法测定极性分子的偶极矩实验报告
结构化学实验报告
——溶液法测定极性分子的偶极矩
一、实验目的
1.用溶液法测定正丁醇的偶极矩
2.了解偶极矩与分子电性质的关系
3.掌握溶液法测定偶极矩的实验技术
二、实验原理
1.偶极矩与极化度
(1)两个大小相等方向相反的电荷体系的偶极矩定义为:
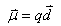
(2)极化程度可用摩尔定向极化度P定向来衡量:
P定向=4/3πNA*μ02/(3kT)=4/9πNA*μ02/(kT)
(3)极性分子所产生的摩尔极化度P是摩尔定向极化度、摩尔电子诱导极化度和摩尔原子诱导极化度的总和:
P=P定向+P诱导=P定向+P电子+P原子
2.偶极矩的测定方法(溶液法测定偶极矩)
(1)无限稀释时溶质的摩尔极化度的公式:
P=P2∞=3αε1/(ε1+2)2 * Μ1/ρ1 + (ε1-1)/(ε1+2) * (Μ2-βΜ1)/ρ1
(2)习惯上用溶质的摩尔折射度R2表示高频区测得的摩尔极化度,因为此时P定向=0,P原子=0,推导出无限稀释时溶质的摩尔折射度的公式:
P电子=R2∞=n2-1/(n12+2) * (Μ2-βΜ1)/ρ1+6n12Μ1γ/[(n12+2)2*ρ1]
(3) 近似公式:
ε溶=ε1(1+α* x2)
ρ溶=ρ1(1+β*x2)
n溶=n1(1-γ*x2)
(4) 永久偶极矩的获得
考虑到摩尔原子诱导极化度通常只有摩尔电子极化度的5%-15%,而且P定向又比P原子大得多,故常常忽略P原子,可得P定向=P2∞-R2∞=4/9πNA*μ02/(kT)
μ0=0.0128*[(P2∞-R2∞)*T]1/2
(5)介电常数的测定:用空气与一已知介电常数ε溶的标准物质分别测得电容C/空 ,C/标
C/空=C空+Cd= C0+Cd C/标=C标+Cd
则通过上两式可求得C0=(C/标-C/空)/(ε标-1) Cd=C/空-C0=C/空-(C/标-C/空)/(ε标-1)
ε溶= C溶/ C0=(C/溶- Cd)/ C0
三、仪器和试剂
仪器:阿贝折光仪1台;比重管1只;电容测量仪一台;电容池一台;电子天平一台;电吹风一只;25ml容量瓶4支;25ml、5ml、1ml移液管各一支;滴管5只;5ml针筒一支;针头一支;吸耳球一个;
试剂:正丁醇(分析纯);环己烷(分析纯);蒸馏水;丙酮
四、实验步骤
1.溶液的配制
配制4种正丁醇的摩尔分数分别是0.05、0.10、0.15、0.20的正丁醇-环己烷溶液。操作时应注意防止溶质和溶剂的挥发以及吸收极性较大的水气,为此溶液配好后应迅速盖好瓶盖,并置于干燥箱中。
2.折光率的测定
在恒温(25±0.10C)条件下用阿贝折光仪测定环己烷和各配制溶液的折光率。测定时注意各样品需加样三次,每次读取一个数据,取平均值。
3.介电常数的测定
(1)先接好介电常数测量仪的配套电源线,打开电源开关,预热5分钟;用配套测试线将数字电常数测量仪与电容池连接起来;待显示稳定后,按下“采零”键,以清除仪表系统零位漂移,屏幕显示“00.00”。
(2)电容C0 和Cd 的测定:本实验采用环己烷为标准物质,其介电常数的温度公式为: ε标=2.203-0.0016(t-20)
式中t为实验室温度(0C)。用电吹风将电容池加样孔吹干,旋紧盖子,将电容池与介电常数测量仪接通。读取介电常数测量仪上的数据。重复三次,取平均值。用移液管取1ml纯环己烷加入电容池的加样孔中,盖紧盖子,同上方法测量。倒去液体,吹干,重新装样,用以上方法再测量两次,取三次测量平均值。
(3)溶液电容的测量:测定方法与环己烷的测量方法相同。每个溶液均应重复测定三次,三次数据差值应小于0.05pF,所测电容读数与平均值,减去Cd,即为溶液的电容C溶。由于溶液易挥发而造成浓度改变,故加样时动作要迅速,加样后迅速盖紧盖子。
4.溶液密度的测定
取干净的比重管称重m0。然后用针筒注入已恒温的蒸馏水,定容,称重,记为m1。用丙酮清洗并吹干。同上,测量各溶液,记为m2 。则环己烷和各溶液的密度为:
ρ溶=(m2-m0)/(m1-m0) *ρ水 ,ρ25℃水=0.99707g/mL
5.清洗、整理仪器
上述实验步骤完成后,确认实验数据的合理性。确认完毕,将剩余溶液回收,容量瓶、比重管、针筒洗净、吹干。整理实验台,仪器恢复实验前的摆放。
五、数据记录和处理
1. 溶液的配制

2.折光率的测定
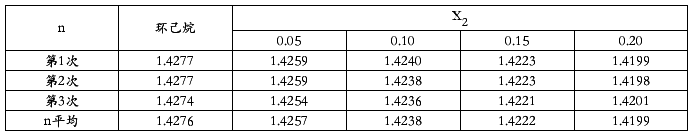

由上图可知:n1=1.4276
γ=0.0378/1.4276=0.0265
3.介电常数的测定

t=17.8℃ ε标=2.203-0.0016(t-20)=2.207
C0=(C/标-C/空)/(ε标-1)=(5.48-5.24)/(2.207-1)=0.199
Cd=C/空-C0=5.24-0.199=5.04
由ε溶=(C/溶- Cd)/ C0 ,可算出:
ε(环己烷)=2.207
ε(0.05)=2.66
ε(0.10)=2.56
ε(0.15)=3.16
ε(0.20)=2.86

由上图可知:ε1=2.3282
α=3.612/2.3282=1.551
4.溶液密度的测定
m0=25.0273
m1=28.4069
m2(环己烷)=27.6384
m2(0.05)=27.6410
m2(0.10)=27.6457
m2(0.15)=27.6470
m2(0.20)=27.6491
由ρ溶=(m2-m0)/(m1-m0) *ρ水,可算出:
ρ(环己烷)=0.7726
ρ(0.05)=0.7734
ρ(0.10)=0.7748
ρ(0.15)=0.7752
ρ(0.20)=0.7758

由上图可知:ρ1=0.7727
β=0.0164/0.7727=0.0212
5.求P2∞、R2∞
P2∞=3αε1/(ε1+2)2 * Μ1/ρ1 + (ε1-1)/(ε1+2) * (Μ2-βΜ1)/ρ1
=91.71
R2∞=(n12-1)/(n12+2) * (Μ2-βΜ1)/ρ1 + 6n12Μ1γ/[(n12+2)2*ρ1]
=26.23
6.求偶极矩μ0(当时温度为17.80C)
μ0=0.0128*[(P2∞-R2∞)*T]1/2=0.0128*[(91.71-26.23)*290.8]1/2
=1.77
六、分析讨论
1.分析本实验误差的主要来源,如何改进?
答:(1)溶液的配制:移液管使用过程中量取溶液并不十分精确,会导致溶液配置的时候X2的值与要求值有一定的偏差。所以,在移液的过程中要保证移液管使用操作迅速准确。
(2)折光率的测定:折光率的线性还比较好,测量中除了取样,试剂瓶盖子应随时盖好.以免样品挥发影响溶液浓度。而且样品滴加要均匀,用量不能太少,以免测量不准确。
(3)介电常数的测定:仪器不是很稳定,而且并未用移液管移取1mL,而是用每种溶液的专用滴管吸取50滴,滴管的构造不一样,也导致了移取的样品量不一致,这是造成介电常数与浓度关系的线性很差的两个原因。应该用同一个移液管准确移取,且每次都要用丙酮洗净用待测液润洗,而且在重新装样前,为了证实电容池电极间的残余液确已除净,须先测量空气的电容值,待空气的电容值恢复到测量之前,或者在±0.05pF的误差范围内,方可进行下一次测量。
(4)溶液密度的测定:因为电子天平非常灵敏,当有电吹风在吹或稍有动静时,读数就变得很厉害,两次测量的数据都会很不一样,所以每个样品测了两次,取了比较合理的数据。减小误差的方法是确保每次装样品前比重管都要洗净吹干(内外管壁都是),溶液要装满比重管,且外壁不能沾溶液,测量的环境要尽可能安静。
2.本实验中,为什么要将被测的极性物质溶于非极性的溶剂中配成稀溶液?
答:因为溶液法的基本想法是,在无限稀释的非极性溶剂的溶液中,溶质分子所处的状态和气态时相近,于是无限稀释的溶液中就可以使用如下稀溶液的近似公式:
ε溶=ε1(1+α* x2)
ρ溶=ρ1(1+β*x2)
n溶=n1(1-γ*x2)
从而可以推导出无限稀释时溶质的摩尔极化度及摩尔折射度的公式,最终得到永久偶极矩。
3.根据实验结果,判断正丁醇的对称性(所属点群)。
答:由于正丁醇具有永久偶极矩,且只有属于Cn、Cnv(包括Cs)点群的分子才具有永久偶极矩,所以正丁醇所属点群为C1 。
