氢氧化钠的标定
201230050301 园艺三班 陈杰
一、实验目的:掌握NAOH的基本标定原理和方法
二,实验用品
1.电子天平 2.称量纸
3.锥形瓶 4.滴定管
5.滴管 6.邻苯二甲酸氢钾 (potassium biphthalate,KHP)
7.酚酞指示剂 8.水
9.氢氧化钠溶液 10.量筒
三,实验原理:
本实验对氢氧化钠的标定采用邻苯二甲酸氢钾 (potassium biphthalate,KHP) 为一级标准。因为氢氧化钠易与空气中的二氧化碳结合形成碳酸钠,造成碳酸根误差。 若有HCl溶液,可加入少量酸及碱,直到使其变色所需NaOH的量为最小时,则可得较正确之终点。当然,所用酸的体积要记录,由酸碱比值可求出碱的校正体积和浓度。
四,实验步骤:
(1)以电子天平精确秤取邻苯二甲酸氢钾 (KHP) 约0.4~0.6克。
(2)取一锥形瓶,将秤取的邻苯二甲酸氢钾完全倒入瓶中,并加入约50ml的水。
(3)待溶解完后(可能极微量不溶,忽视之,近滴定终点会自然溶解),在锥形瓶中滴入三滴酚酞,当做指示剂。
(4)滴定管先润洗过后,加入氢氧化钠溶液。以NaOH溶液滴定之。
(5)滴定至溶液变成粉红色,而且颜色可维持30秒以上不褪去即滴定完成。
五,数据处理
邻苯二甲酸氢钾重量(纯)
NaOH浓度=─────────────────
所耗氢氧化钠溶液毫升数×校准剂毫克当量
C (NaOH)=m/[(V1-V2)*0.2042]
式中:C(NaOH)—氢氧化钠标准溶液的浓度,mol/L;
m—邻苯二甲酸氢钾的质量,g;V1—氢氧化钠溶液的用量,ml;
V2— 空白试验氢氧化钠的用量,ml。
0.20##—与1.00ml 氢氧化钠标准溶液[C (NaOH)=1.000mol/L]相当的以克表示的邻苯二甲酸氢钾的质量。
六,问题讨论
1、为什么氢氧化钠溶液的浓度需要时常重新标定?
是为了精确计算酸碱滴定的浓度。
需要标定的原因如下︰
(1)因为氢氧化钠在空气中容易潮解 ,在秤取氢氧化钠固体配置氢氧化钠溶液的过程中,容易产生误差。
(2)配置好的氢氧化钠溶液 ,即使已经标定过 ,经过一段时间不使用 ,也会因为空气中的二氧化碳易溶于水中 形成碳酸 ,碳酸会和氢氧化钠反应 ,降低氢氧化钠的浓度 ,因此使用前仍须重新标定一次,以确认浓度。
2、为何KHP可用来标定氢氧化钠浓度?
KHP是个固体单质子酸.选择KHP作氢氧化钠浓度的标定剂最主要的原因是它的分子量大,配出来的标准液精确度会比较高。
3、为什么使用KHP前要先烘干呢??
因为KHP在室温下会潮解,所以要先放烘箱干燥,秤的时候也要快速,否则会影响实验结果 。
4、造成碳酸根误差的可能原因?
碳酸根误差是指在进行NaOH滴定过程中,空气中的CO2会与NaOH结合,形成Na2CO3,因为二个NaOH才形成一个 Na2CO3,若以酚酞当做指示剂而进行滴定,当溶液变无色时,每个Na2CO3只结合一个氢离子,使加入的HCl量相对减少一半,误差于是产生。
第二篇:氢氧化钠浓度的标定
氢氧化钠浓度的标定
一.实验目的
1 练习分析天平的使用方法并掌握减量称量法
2 掌握滴定操作并学会正确判断终点;
3 学会配制和标定碱标准溶液的方法。
二.实验原理:
1、氢氧化钠标准溶液不能准确配制的原因;
NaOH易吸湿,不是基准物质,故不能准确配制NaOH标准溶液,需用邻苯二甲酸氢钾标定,属于强碱滴定弱酸。
2、标定氢氧化钠溶液的工作基准试剂,滴定反应到达化学计量点时溶液的pH值;
工作基准试剂是:邻苯二甲酸氢钾。
C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O
计量点时pH=9.0
3、选用何种指示剂,终点时的颜色;
选用酚酞作指示剂,终点是溶液由无色变为淡红色,且0.5min内不退色。
如何选择指示剂?
强碱滴定强酸时,随着NaOH溶液的加入,溶液pH值发生变化,以pH对NaOH的加入量作图得滴定曲线,计量点前后NaOH溶液由不足到过量0.02mL(0.1%);
溶液pH的突然变化称滴定突跃,突跃的pH范围称滴定突跃范围;
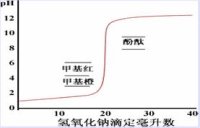
酸碱指示剂、指示剂的变色范围 酸碱指示剂本身是弱酸或弱碱:HIn = H+ + In-,HIn与In-有不同的颜色,pH=pKa(HIn)+lg[In-]/[HIn],当[In-] =[HIn],pH=pKa为理论变色点;[In-]/[HIn]≤ 0.1看到酸色,≥10,看到碱色,变色范围的pH=pKa±1,但实际观测到的与理论计算有差,因人眼对各种颜色的敏感度不同,加上两种颜色互相掩盖,影响观察。如酚酞pKa=9.1,变色pH范围为8.0~9.6。不同的人的观察结果也不同。
指示剂的选择 使指示剂的理论变色点处于滴定突跃范围。
4、计算公式
C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4)
M(KHC8H4O4)V(NaOH) 204.22* V(NaOH)
三.主要仪器与试剂
主要仪器:电子天平,分析天平,250m烧杯(4个),表面皿(4个),滴定管,称量瓶,玻璃棒,干燥器,量筒。
主要试剂:NaOH(S)、邻苯二甲酸氢钾、酚酞
四.操作步骤: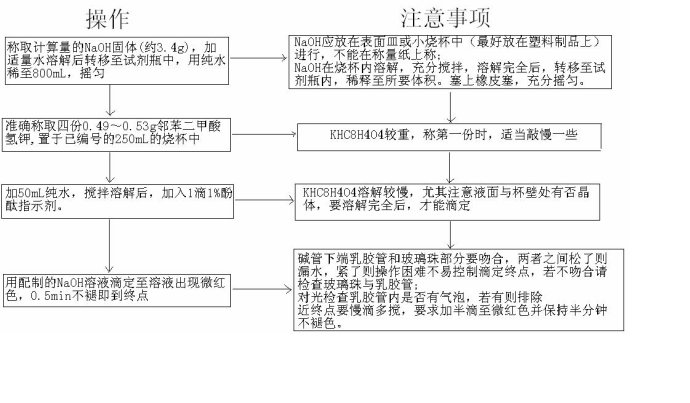
五.实验结果及分析
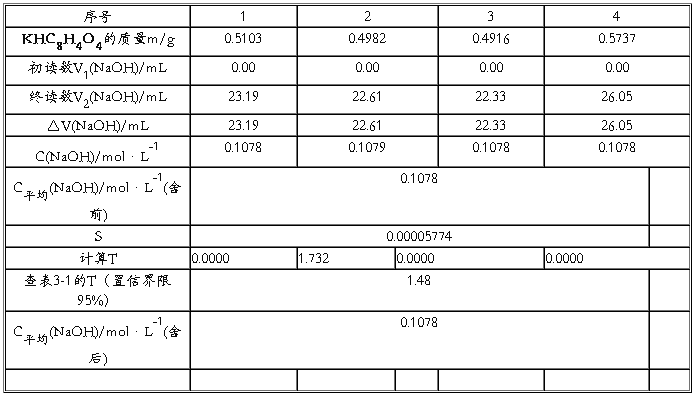
用到的计算公式:
1. C(NaOH)= m(KHC8H4O4) = m(KHC8H4O4)
M(KHC8H4O4)V(NaOH) 204.22* V(NaOH)
2.平均值的计算: =(X1+X2+X3+……+Xn)/n
3.标准偏差计算: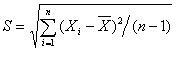
4:统计量计算式为:Tn=(Xn- ) /S
六.问题及思考题
★思考题
1.计算配置500mL 0.1mol·L-1氢氧化钠溶液所需要氢氧化钠固体质量,如何称取固体氢氧化钠?
答:m = 500×10-3×0.1×40 = 2 g
因氢氧化钠有腐蚀性,所以不能在称盘或称量纸上直接称量,需放在已知质量的小烧杯内或表面皿上称量。若用表面皿称量,需先将氢氧化钠固体转移到烧杯中再溶解
2盛氢氧化钠溶液的试剂瓶应用何种质地的塞子,塞子如何洗净?怎样选择合适的塞子?
答: ①用橡皮塞。因氢氧化钠与玻璃的成分之一SiO2作用会使塞子与瓶口粘结而打不开。橡皮塞耐碱腐蚀,但易被酸侵蚀,它与有机液体、有机蒸气接触容易发生溶胀,引起有机溶剂污染。②橡皮塞在使用前可以用洗涤剂或去污粉刷洗,若仍洗不干净,则将塞子放在6mol·L-1氢氧化钠溶液中加热,小火煮沸一段时间后,再用自来水冲洗干净,纯水荡洗后备用。
塞子的大小要与瓶口大小相匹配。塞子伸入瓶颈部分不得少于塞子本身长度的1/3,也不能多于2/3。
3.计算标定0.1mol·L-1的氢氧化钠溶液所需要的邻苯二甲酸氢钾的质量。
答:0.1×25×10-3×204.22 = 0.51g
(假设滴定用的氢氧化钠约25mL)
4.滴定中酚酞的用量对实验结果是否有影响?
答:有影响。指示剂用量太多了,变色不敏锐,而且指示剂本身也是弱酸或弱碱,会消耗一些滴定剂,带来误差。
5.下列操作是的是否正确:
①每次洗涤液从吸管的上端倒出;
②为了加速溶液的流出,用洗耳球把吸管内溶液吹出;
③吸取溶液时,吸管末端伸入溶液太多,转移溶液时,任其临空流下。
答:以上操作均不正确
①从上端到处时,溶液会沾在管口,不便于食指按住管口的移液操作,要是待测液还会带来移液量的误差。
②吸管要是没有“吹”或“快”字,是不能吹的,吸管的容量本来就没有计算管尖的那滴液体的体积,要是吹下,会使移取的液体体积偏大。
③吸管伸入液面下过多,则管外沾附的溶液也多,会使它带到接受溶液的容器中,使移液量增多。
临空流下速度慢,而且容易溅出。
★问题:
1.以酚酞为指示剂标定氢氧化钠溶液时,终点为微红色,0.5 min不褪色,如果经过较长的时间后微红色慢慢褪去,为什么?
答: 在放置的过程中,溶液吸收了空气中的二氧化碳,使pH值降低,红色褪去。
2.草酸(H2C2O4·2H2O)能否用来标定氢氧化钠?
答:工作基准试剂草酸可以标定氢氧化钠溶液。草酸(H2C2O4·2H2O)在相对湿度为5~95%时不会风化而失水,将草酸保存在磨口试剂瓶中即可。草酸固体状态比较稳定,但溶液状态的稳定性较差,空气能使草酸慢慢氧化,光线以及Mn2+的存在能促使其氧化,草酸的水溶液久置能自动分解放出CO2和CO,故草酸溶液不能长期保存
草酸是二元酸,由于两个解离常数值接近,不能分步滴定,只能一步滴定。
七.注意事项与讨论:
除邻苯二甲酸氢钾外,还有工作基准试剂可以标定氢氧化钠溶液吗?
答:工作基准试剂草酸可以标定氢氧化钠溶液。
草酸(H2C2O4·2H2O)在相对湿度为5~95%时不会风化而失水,将草酸保存在磨口试剂瓶中即可。草酸固体状态比较稳定,但溶液状态的稳定性较差,空气能使草酸慢慢氧化,光线以及Mn2+的存在能促使其氧化,草酸的水溶液久置能自动分解放出CO2和CO,故草酸溶液不能长期保存。
草酸是二元酸,由于两个解离常数值接近,不能分步滴定,只能一步滴定。
怎样溶解邻苯二甲酸氢钾?
答:邻苯二甲酸氢钾溶解速度比较慢,还会浮在水面上,尤其是接近液面的杯壁处。因此称好试样回到实验室后,分别在四个烧杯中,洗杯壁后加50mL纯水,放入玻棒,搅拌后,盖好表面皿,然后准备滴定管,使样品有足够的溶解时间。
在滴定前,先检查一号烧杯内试样溶解情况,特别注意接近液面的烧杯壁处,如还有未溶解的试样,则搅拌直至完全溶解,当滴定完第一份试样后,再检查二号烧杯内试样的溶解情况,搅拌全溶后滴定。依次重复至全部滴定好。
在邻苯二甲酸氢钾溶液中,加入1滴酚酞溶液后,为什么局部会出现白色浑浊?
答:酚酞是有机物质,在水中的溶解度小,因此1%酚酞溶液是将1g酚酞溶于100mL90%乙醇中配制成的(严格地讲酚酞的质量浓度应该称为
10g·L-1)。当1滴酚酞乙醇溶液加到水溶液中后,酚酞由于溶解度降低而析出,局部出现白色浑浊,一经搅拌,酚酞又分散到溶液中溶解,白色浑浊消失。
洗涤碱管时,为什么要将乳胶管连同细嘴玻璃管取下?
答:因乳胶管内有玻璃珠,两者结合起旋塞的作用,阻止溶液流出,因此取下乳胶管,可减少滴定管刷刷洗时的阻力。
为什么终点的微红色在30s后会褪去?
答:在放置的过程中,溶液吸收了空气中的二氧化碳,使pH值降低,红色褪去。
带进天平室的物品:
4个250mL烧杯编号盖上表面皿(不放玻棒);干燥器;称量瓶与纸带(放干燥器内);记录笔、实验报告本。
减量法称量的要点?
Ø 称出称量瓶质量,按去皮键TAR,倾倒试样后称量,所示质量是“—”号;
Ø 再按去皮键称取第二份试样;
Ø 本实验连续称取四份试样。
Ø 注意事项(减量法称量的注意点)
Ø 盛有试样的称量瓶除放天平盘、干净的纸或表面皿上,或用纸带拿在手中外,不得放其它地方(为什么);
Ø 纸带放洁净、干燥的地方;请保存好以便以后再用;
Ø 取出或套上纸带时,不要碰到称量瓶口
Ø 要在承接容器的上方打开(或盖上)瓶盖,以免使粘附在瓶口、瓶盖上的试样失落在容器外,粘在瓶口的试样应尽量敲入烧杯或称量瓶内;
Ø 若倒入试样量不够时可重复再倒,但要求2~3次内倒至规定量(为什么)。如倒入量大大超过,弃去,洗净烧杯后重称。
怎样溶解试样?
答:⑴取下表面皿,用洗瓶吹洗烧杯壁,将杯壁上可能有的粉末试样洗至杯底,放入玻棒。
⑵用量筒取50mL纯水,沿玻棒(玻棒下端要靠杯壁)或沿杯壁缓缓加入到烧杯中。现烧杯上均有容量刻度,但体积数不准,不要使用。
⑶用玻棒不断搅拌使所有的固体溶解,但不碰杯壁以免发出响声。注意已放入的玻棒不能离开烧杯,更不能放在烧杯以外的地方,以免烧杯中的试样损失。
注意事项
Ø 量筒量取纯水,沿杯壁加入,或玻棒引入,玻棒下端紧靠杯壁;每只烧杯内放一根玻棒,放入后不再取出;
Ø 搅拌时不碰杯壁以免发出响声;
Ø 试样完全溶解后再滴定,重做时更要做到此点。
滴定过程中,如何控制好滴定的速度?
Ø 答: ⑴滴定开始时,可快。由于离终点远,滴落点颜色无明显变化,此时的滴定速度为10mL/min,即每秒3~4滴,呈“见滴成线”,但不能成“水线”,以免溶液溅出。
⑵滴落点颜色有变化或消失慢时,滴定放慢。随着终点的接近,改为滴1滴搅几下(一滴多搅),或控制滴加速度为加1滴,经搅拌后溶液颜色稳定,下1滴正好滴下。
⑶近终点:先洗玻棒、杯壁,微移旋塞,使溶液悬在下口形成半滴,用玻棒下端靠下(注意玻棒只能接触液滴,不要接触管尖),快速搅动溶液。
为什么近终点时要洗杯壁,洗涤水的量要不要控制?
答: ⑴滴定过程中,可能有溶液溅在杯壁,因此近终点时要洗杯壁。
⑵只能用少量水洗杯壁。在盐酸标准溶液的标定中,变色点pH=3.9,因纯水pH=6,多加洗涤水,会多消耗盐酸,从而引进误差。因此终点时加少量纯水,对终点没有影响;加多了不行。
▲示教:
碱式滴定管的使用,着重讲解:
洗涤;乳胶管和玻璃珠部分的配合; 挤压方法、部位;
乳胶管内和末端玻璃管内气泡的排除
◆标定四份即通过的同学,再标定二份HAc溶液的浓度。
