微量凯氏定氮法
姓名:周超
学号:201100140067
班级:11级生命基地
同组者:刘炳煜
时间:20##年6月4日
【实验目的】
1、掌握凯氏定氮法测定蛋白质含量的原理和方法。
2、学会使用凯氏定氮仪。
【实验原理】
凯氏定氮也称克氏定氮。样品与浓硫酸共热,含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。然后经强碱碱化使硫酸铵分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度,即可计算的样品之含氮量,若以甘氨酸为例,其反应式如下:
NH2CH2COOH+3H2SO4→2CO2+3SO2+4H2O+NH3 (1)
2NH3+H2SO4→(NH4)2SO4 (2)
(NH4)2SO4+2NaOH→2H2O+Na2SO4+2NH3↑ (3)
反应(1)(2)在凯氏烧瓶内完成,反应(3)在凯氏蒸馏装置中进行(如图1),其特点是将蒸汽发生器、蒸馏器及冷凝器三个部分融为一体。由于蒸汽发生器体积小,节省能源,本仪器使用方便,效果良好。
为了加速消化,可以加入CuSO4作催化剂,及硫酸钾以提高溶液之沸点,收集氨可用硼酸溶液,氨与溶液中的氢离子结合生成铵离子,使溶液中氢离子浓度降低,指示剂颜色发生改变,然后用强酸滴定,所用无机酸的量即相当于被测样品中氨的量,本法适用范围约为0.2~1.0mg/mL氮。
凯氏定氮法常用于测定天然有机物(如蛋白质,核酸及氨基酸等)的含氮量。

图1 微量凯氏定氮蒸馏装置
【实验试剂】
实验仪器
1、 微量凯氏定氮蒸馏装置
2、 100ml锥形瓶 6个
3、 5ml移液管
4、 10ml量筒
5、 电炉
6、 铁架台
7、 酸式滴定管
8、 沸石
实验材料
1、 牛奶
2、 浓硫酸
3、 K2SO4·CuSO4混合物
4、 双氧水
5、 0.3mg N/ml的标准硫酸氨
6、 硼酸
7、 30%的NaOH溶液
8、 0.0093mol/L的HCl溶液
9、 甲基橙指示剂
10、 蒸馏水
【实验步骤】
1、 将凯氏定氮仪器的装置仪器安装好。
样品的消化:牛奶:水=1:1的样品2ml,加入4ml H2SO4,再加入200mg K2SO4?CuSO4 催化剂,加热,消化至消化液由褐色变淡直至淡黄色,冷却,加入双氧水数滴,继续加热至消化液至浅蓝色,冷却定容至100ml,备用。
2、 空白的制备:样品部分换成水,其他的操作与操作2相同。
3、 仪器的洗涤:在蒸气发生器内加入5mL浓硫酸和2滴甲基橙,并加蒸馏水总量加至容器容积的2/3,接收瓶内加入5mL混合指示剂,加热;如果接收瓶内指示剂不变色则表明洗净,关闭电炉,在小漏斗内加入蒸馏水,打开止水夹,将水放入,将废液倒吸出。
4、 标准硫酸氮含量测定: 接收瓶内加入5mL硼酸,反应室内加入1ml(NH4)2SO4(样品测定时,加入2ml样品),10ml 30%NaOH溶液,加热;待混合指示剂变为淡绿色时计时3min,然后使液面离开冷凝管口约1cm,并用少量去离子水洗涤冷凝管口,继续蒸馏1min。然后用标准盐酸进行滴定,平行测定三次。
5、 样品的测定:相同的方法测定,空白测二组,样品平行测三次。
【实验结果】
(一)实验数据
1、标准硫酸铵含量测定

2、样品含量测定

空白滴定均为0
(二)数据处理
1、标准硫酸铵含量测定计算
消耗盐酸的平均体积为2.48ml
标准盐酸的浓度为0.0093mol/L
氮含量=2.48×10-3 ×0.0093×14×1000=0.323mg/ml

2、样品含量计算
消耗盐酸的平均体积为1.63ml
标准盐酸的浓度为0.0093mol/L
氮含量=1.63×10-3 ×0.0093×14/2×50×100=0.530g/100ml
蛋白质含量=0.530×6.25=3.313g/100ml
【思考讨论】
(一)结果分析
本次实验结果比实际值(2.9g/100ml)偏大,原因可能是
1、滴定操作导致的误差,在用标准硫酸铵进行滴定练习时,计算的含量比正常值大,因此可能是滴定不规范造成盐酸过量,导致误差。
2、可能是盐酸长期暴露在空气中挥发,导致其实际浓度比原标定浓度偏小,最终导致滴定的盐酸体积大于实际的,最终导致蛋白含量偏高。
3、微量凯氏定氮法测得的氮不全是蛋白质中的氮,也可能是牛奶包含的其他物质中的氮,因此导致蛋白质含量偏高。
4、本实验是根据含氮量间接求出蛋白质的含量,是根据蛋白质的平均含氮比值计算的,并不是本实验样品中蛋白质的准确含氮量。
5、蒸气发生瓶里的液体酸度不够,在碱性条件水中游离氨蒸出,使结果偏大。
(二)注意事项
1、 定氮仪各连接处应使玻璃对玻璃外套橡皮管绝对不能漏气。蒸馏时需控制火力以避免样液倒吸。
2、 消化时,若样品含糖高或含脂及较多时,注意控制加热温度,以免大量泡沫喷出凯氏烧瓶,造成样品损失。
3、 消化时,若有泡沫产生,则等泡沫消失后再使电压达到220V,否则泡沫太多,硫酸不能完全将样品消化。
4、 蒸馏时,一定要在蒸气发生瓶里加入沸石,防暴沸。沸石晾干后可循环使用,每次开始蒸馏前一定要加入新的沸石。
5、 蒸馏时,加入的氢氧化钠必须过量,并且动作还要迅速,以防止氨的流失。
6、 蒸气发生瓶内的水装至2/3体积并且保持酸性(在蒸气发生瓶内的水中加入稀硫酸,使之呈酸性,内加甲基橙指示剂数滴,水应呈橙红色,如变黄时,应该补加酸),以防止在碱性条件水中游离氨蒸出,使结果偏大。
7、 蒸馏时,蒸气要均匀、充足,蒸馏中不得停火断气,否则,会发生倒吸。操作时,应先将冷凝管下端提高液面并清洗管口,再蒸1min 后关掉热源。
8、 变为绿色后开始计时3分钟,然后使冷凝口离开液面1cm,用蒸馏水洗涤冷凝口,继续蒸馏1min
9、 对仪器进行洗涤时,要用蒸馏水洗三遍。
10、 滴定时,液体变微红,且30s不褪色即到达滴定终点。
(三)思考讨论
微量凯氏定氮法的优缺点:
优点:适用范围广,可用于动植物的各种组织,器官及食品等成组复杂样品的测定,只要细心操作都能得到精确的结果。
缺点:操作比较复杂,含有大量碱性氨基酸的蛋白质测定结果偏高。普通实验室中的空气中常含有少量的氨,会影响结果,要尽可能快地对硼酸吸收液进行滴定
第二篇:山大生化实验报告 实验十 菲林试剂热滴定糖
费林试剂热滴定糖
姓名:周超
学号:201100140067
班级:11级生命基地
同组者:刘炳煜
时间:20##年5月21日
【实验目的】
1、初步掌握费林试剂热滴定定糖法的原理和方法。
2、正确掌握滴定管的使用方法和热滴定的终点。
【实验原理】
1. 还原糖
还原糖(reducing sugar ):羰基碳(异头碳)没有参与形成糖苷键
能够还原斐林(H.von Fehling)试剂或托伦斯(B.Tollens)试剂(银氨溶液)的糖称为还原糖,所有的单糖(除二羟丙酮和五碳糖,即核糖和脱氧核糖),不论醛糖、酮糖都是还原糖。大部分双糖也是还原糖,蔗糖例外。斐林试剂是含 Cu2+络合物的溶液,被还原后得到砖红色 Cu2O的沉淀。托伦斯试剂被还原后(银镜反应)能生成单质银,在试管壁上可看到“银镜”。分子结构中含有还原性基团(如游离醛基`半缩醛羟基或游离羰基)的糖,叫还原糖。如葡萄糖、果糖、麦芽糖、乳糖。 一般情况下,单糖的还原能力主要来自它的醛基,如葡萄糖,而多糖则大多因为半缩醛羟基的存在。还原后,自己会变成糖酸。如葡萄糖就会变成葡萄糖酸。
2. 菲林试剂
菲林试剂由氢氧化钠的质量分数为 0.1 g/mL 的溶液和硫酸铜的质量分数为 0.05 g/mL 的溶液,还有酒石酸钾钠配制而成的。它与可溶性的还原性糖(葡萄糖、果糖和麦芽糖)在加热的条件下,能够生成砖红色的氧化亚铜沉淀。因此,斐林试剂常用于鉴定可溶性的还原性糖的存在与否。
3. 实验方法
本实验采用费林试剂热滴定法,费林试剂是氧化剂,由甲、乙两种溶液组成。甲液含硫酸铜和次甲基蓝(氧化还原指示剂);乙液含氢氧化钠,酒石酸钾钠和亚铁氰化钾。当甲、乙两溶液混合时,硫酸铜与氢氧化钠反应生成天蓝色的氢氧化铜沉淀。在碱性溶液中,酒石酸钾钠与沉淀的氢氧化铜作用形成可溶性的络合物。
【实验试剂】
实验仪器
1、 移液管(2ml、5ml、10ml)
2、 100 毫升容量瓶
3、 水浴锅
4、 铁架台
5、 碱式滴定管
6、 分析天平
7、 烧杯
8、 玻璃棒
9、 100ml锥形瓶
实验材料
1、 面粉
2、 酚酞试剂
3、 菲林试剂(甲、乙液)
4、 10%氢氧化钠
5、 标准葡萄糖(1mg/ml)
6、 6M HCl
7、 碘液
【实验步骤】
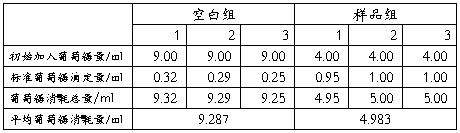
1、总糖的提取
准确称取面粉1.0005克,加入6mol/L盐酸10毫升,加入蒸馏水15毫升,混匀。沸水浴30分钟后,取出几滴水解液用碘化钾-碘溶液检查水解是否完全,若水解完全,则不呈现蓝色。冷却后用10%氢氧化钠中和至中性溶液,定容至100毫升。准确吸取该溶液10ml,移入100ml容量瓶内并定容至刻度,即为测定总糖的样品液。
2、空白测定
吸取费林甲、乙液各5ml,加5ml蒸馏水,放入100毫升的锥形瓶中,再用滴定管加入8ml的标准葡萄糖液,混匀后电炉加热至沸腾,用标准葡萄糖以每滴4-5秒的速度滴定至蓝色消失。记录葡萄糖消耗总量,平行测定三次。
3、样品测定
准确吸取样品液 5ml 放于 100ml 锥形瓶内,加入费林甲液、乙液各 5ml,向锥形瓶内加入 4ml 的标准葡萄糖液,然后按测定空白同样操作进行滴定(控制流速,使滴定时间与空白滴定的时间基本一致),记下耗用标准葡萄糖的毫升
数。平行测定三次。
4、计算

【实验结果】
实验数据记录表
结果计算:
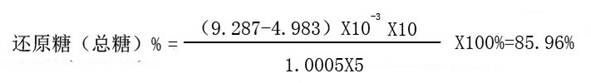
本次实验面粉中总糖含量为85.96%
【思考讨论】
1、 结果分析:
本次实验结果在正常范围之内,实验较成功。
2、 注意事项:
(1)菲林试剂一般应现配现用,因为斐林试剂甲和斐林试剂乙混合后会因酒石酸有一定的还原性而自发地缓慢产生氧化亚铜沉淀。
(2)用酚酞作指示剂时用10%氢氧化钠调PH至7,应先计算大概需加入氢氧化钠溶液的体积,然后在接近拐点处应一滴一滴甚至半滴半滴的加,这样可以避免加入加入过量的氢氧化钠。
(3)全部滴定过程必须在沸腾状态下快速进行,避免不断的还原、氧化使滴定终点延后。
(4)滴定速度应保持在4-5秒每滴,因为反应时间较慢,变色速度慢,保持慢速滴入有利充分反应变色,避免加入量过多,造成实验结果误差太大。
(5)平行实验时,应尽量保持每次的滴定速度一致并且滴定时间相当,这样几次平行实验的误差不会太大,实验数据才有可参考价值。
(5)滴定速度不能太快,但是滴定时间要控制在3min之内,这需要正式滴定前进行预实验,摸索出适当的初始加入的葡萄糖量。
3、 讨论
1)误差分析:可能有以下几点造成实验误差
(1)定容后没有充分摇匀,导致局部浓度过高或者过低。
(2)滴定过程没有完全在沸腾的情况下进行,导致不停地被氧化还原,拖后了滴定终点。
(3)平行实验中各组的滴定速度和滴定时间相差太大,导致空气中的氧气对实验产生干扰。
(4)滴定速度太快,反应终点判断不准确。
(5)提取总糖时,面粉未完全水解为葡萄糖。
2)在检测还原性糖时,可以采用斐林试剂或班氏试剂。两者的相同点是都是二价铜与醛基在沸水浴加热条件下反应而生成砖红色的沉淀,两者反应现象一样。但两者的配方,保存方式不同,实验原理也略有差异:
(1)利用斐林试剂鉴定时,斐林试剂甲和斐林试剂乙直接反应生成酒石酸络铜离子 。酒石酸络铜离子和可溶性还原糖在加热条件下反应产生砖红色沉淀。费林试剂适合测植物类糖的含量。
(2)班氏试剂中反应原理如下:柠檬酸钠作为络合剂,由碳酸钠提供碱性。CuSO4与柠檬酸钠溶液和Na2CO3溶液混合时生成柠檬酸络铜离子,柠檬酸络铜离子与葡萄糖中的醛基反应生成砖红色沉淀。
