一、实验目的
1.掌握测定平衡常数的一种方法。
2.用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理
NH4COONH4 → 2NH3 + CO2
有上式的方程式得:(平衡常数) KP = P 2NH3*PCO2
由于固体NH2COONH4产生的分压很小,可以忽略不计,又因为体系中的NH3和CO2全部是由氨基甲酸铵分解产生的,所以
P=PNH3+PCO2
由反应方程式可知: PNH3=2PCO2
所以 PNH3=2/3P , PCO2=1/3P
即可以得到 Kp0=4/27(P/p0)3
因为 d(lnKP0)/dT =△rH0m/RT2
所以 lnKp0= -△rH0m/RT+C
若以lnKp0对1/T作图,应为一直线,其斜率为-△rH0m/R,由此可以求出△rH0m。
再根据△rGm0=-RTlnKp0,△rS0m=(rH0m-rG0m)/T可求出△rG0m、△rS0m。
三、实验装置图

1-缓冲瓶;2-减压瓶;3-测压仪;4-等压计;5-样品管;6-加热器;7-搅拌器;
8-水银接触温度计; 9-1/10刻度温度计; 10、11、12-活塞;
四、仪器与药品
仪器:循环水泵,低真空数字测压仪,等压计,恒温槽1套,样品管。
药品:氨基甲酸铵,液体石蜡。
五、实验步骤
1.由特制的小漏斗将氨基甲酸铵粉末小心装入干燥的球状样品管中,与已装好液体石蜡的等压计连好(注意不要让液体石蜡进入样品管)
2.开动循环水泵,旋转活塞10与体系相通,旋转活塞11与减压瓶2想通,旋转活塞12至三个方向都相通,此时观察到的测压仪数字应不断减小,至低真空测压仪示数为-90℃KPa以下时,关闭活塞11,检查体系的气密性。
3.恒温槽中加水至没过样品管和等压计,调节恒温槽水温为25℃。
4.旋转活塞11,抽吸大约1min,把样品管中的空气抽走,然后关闭活塞11。慢慢旋转活塞13,缓慢放入空气进入体系,使U型等压计液面水平(注意不可使空气进入过快,避免空气进入样品管)。
5.若5min内保持液面水平不变,记下低真空测压仪的读数,即为氨基甲酸铵分解的平衡压力。然后关闭活塞13,再重复一次,如果二次结果相差在0.1KPa之内,则可改变温度,继续进行实验;若二次结果偏差较大,说明第一次空气没抽净,应再重复一次。若平衡保持不住,可检查是否有漏气的地方。
6.用同样的方法测25℃、30℃、35℃、40℃、45℃的分解压力。
7.实验完成后,关闭活塞13,使活塞12与样品管断开,以保护剩余的氨基甲酸铵。将测压仪的NH3和CO2抽净,关闭活塞11,使活塞10放空后方可关泵。
六、注意事项
1、体系必须达平衡后,才能读取数字压力计的压力差。
2、恒温槽温度控制到±0.1℃。
3、玻璃等压计中封闭液一定要选用粘度小,密度大,蒸气压低并且与反应体系不发生作用的液体。
七、数据记录及处理
室温:20.8℃ 大气压:101.47 KPa
1.不同温度下氨基甲酸铵的分解压及分解反应的Kp0。

表1
2.lnKp0_1/T图。

由图可知该直线的斜率:—ΔrH? m/R=(-4.370+8.564)/(0.003143-0.003354)=—19.877×103 即得 ΔrH? m=19.877×103 ×8.314=165.26 kJ/mol
3.氨基甲酸铵分解反应的ΔrGm0和ΔrSm0

表2
八、实验结果及讨论
1、从表1不同温度下氨基甲酸铵的分解压及分解反应的Kp0可知,随着温度的升高,
第二篇:6液相反应平衡常数的测定实验报告
华 南 师 范 大 学 实 验 报 告
学生姓名 学 号
专 业 化学(师范) 年级、班级
课程名称 物理化学实验 实验项目 液相反应平衡常数的测定
实验类型 :□验证□设计□综合 实验时间 年 月 日
实验指导老师 孙艳辉 实验评分
【实验目的】
①利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子液相反应的平衡常数。
②通过实验了解热力学平衡常数与反应物的起始浓度无关。
【实验原理】
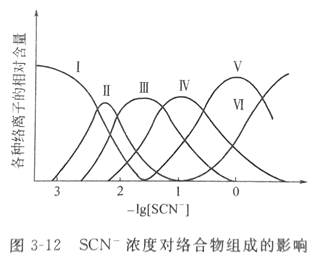
Fe3+与SCN-在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。当SCN-的浓度增加时,Fe3+与SCN-生成的络合物的组成发生如下的改变,而这些不同的络离子的溶液颜色也不同。
Fe3+ +SCN- →Fe(SCN)2+→Fe(SCN) 2+ →Fe(SCN)3→Fe(SCN)4-→Fe(SCN)52-
由图3-12可知,Fe3+与浓度很低的SCN-(一般应小于5×10-3 mol/L)只进行如下反应。
 Fe3+ +CNS2+=Fe[CNS]2+
Fe3+ +CNS2+=Fe[CNS]2+
即反应被控制在仅仅生成最简单的FeSCN2+。其平衡常数表示为

 Kc=
Kc=
由于Fe[CNS]2+是带有颜色的,根据朗伯一比尔定律,消光值与溶液浓度成正比,实验时,只要在一定温度下,借助分光光度计测定平衡体系的消光值,从而计算出平衡时Fe[CNS]2+的浓度[FeCNS2+]e,进而再推算出平衡时Feo+和CNS-的浓度[Fe3+]e和[CNS-]e。根据式(3-14)一定温度下反应的平衡常数Kc可求知。
实验时配置若干组(共4组)不同Fe3+起始浓度的反应溶液,其中第一组溶液的Fe3+是大量的,当用分光光度计测定反应液在定温下消光值Ei时(i为组数),根据朗伯-比尔定理
E1=K[FeCNS2+]l,e(K为消光系数)
由于1号溶液中Fe3+大量过量,平衡时CNS全部与Fe3+络合(下标O表示起始浓度),对一号溶液可认为
[FeCNS]i,e=[CNS-]0
则 E1 =K[CNS- ]0
对其余组溶液 Ei =K[FeCNS2+]i,e
 两式相除并整理得
两式相除并整理得
[FeCNS2+]i,e= [CNS- ]始
达到平衡时,在体系中
[Fe3+ ] i,e = [Fe3+]0 - [FeCNS2+ ]i,e (3-17)
[CNS- ]i,e=[CNS- ]0 - [FeCNS2+ ]i,e (3-18)
将式(3-17)和式(3-18)代入式(3-14),可以计算出除第1组外各组(不同Fe3+起始浓度)反应溶液的在定温下的平衡常数Ki,e值。
【仪器与试剂】
(1) 实验仪器
721型(或722型)分光光度计 1台 超级恒温槽 1台
50mL容量瓶 8个 l00mL烧杯(或锥瓶) 4个
刻度移液管 l0mL(2支)、5mL(1支) 25mL移液管 1支
50mL酸式滴定管 1支 吸球、洗瓶等
(2) 实验试剂
1×10-3mol/L KCNS(由A.R级KCNS配成,用AgNO3容量法准确标定)
0.1mol/L Fe(NH4)(SO4)2 由A.R级Fe(NH4)(SO4)2·12H2O配成,并加入HNO3使溶液中的H+浓度达到0.1mol/L,Fe3+的浓度用EDTA容量法准确标定]
1mol/L HNO3 (A.R) 1 mol/L KNO3(A.R)
【实验步骤】
①取8个50mL容量瓶,编好号,按表3-9提示的内容,计算好所需4种溶液的用量(注意,在这4个容量瓶中,溶液的氢离子均为0.15mol/L,用HNO3来凋节;溶液的离子强度均为0.7,用KNO3来调节)。
表3-9 所需用4种溶液的用量

②取4个标记好的50mL容量瓶,按表3-9中计算结果,将除KSCN溶液外的三种溶液分别取所需的体积按编号加入,并用蒸馏水冲置刻度(该溶液为测消光值时的对比液)。
③再取另外4个标记好的50mL容量瓶,按表3-9中计算结果,将4种溶液分别取所需的体积按编号加入(KCNS溶液最后加),并用蒸馏水冲至刻度(该溶液为液相反应体系)。
④调整722分光光度计,将波长调至450nm,分别测定4组反应溶液的消光值。每组溶液要重复测三次(更换溶液),取其平均值。
【数据处理】
将所得数据填入表1。
条件:室温 26.5 ℃ 湿度59.0% 大气压1018.1Hpa
[H+]=0.15mol/L 总离子强度I=0.7 波长=450nm
表1 实验数据记录表
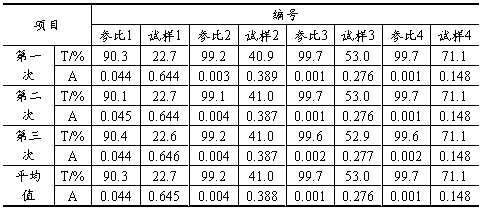
表2 数据处理结果记录表

【提问与思考】
①当Fe3+、CNS-浓度较大时,能否用式(3-16)计算FeCNS2+络离子生成的平衡常数?
答:当Fe3+、CNS-浓度较大时,Fe3+与CNS-生成的络合物组成复杂,而这些不同的络离子的溶液颜色也不同。
②平衡常数与反应物起始浓度有无关系?
答:平衡常数与反应物起始浓度无关,只与温度有关。
③测定Kc时,为什么要控制酸度和离子强度?
答:平衡常数受氢离子的影响,因此,要控制酸度。另外,本实验为离子平衡反应,离子强度对平衡有很大影响,实验时,应加硝酸钾作为辅助介质,降低离子浓度。
④测定消光度时,为什么需空白对比液?怎么选择空白对比液?
答:因为溶液也有吸光度,而且溶液的吸光度会随着波长变化。如果不用空白溶液校正,扣去溶液的吸光度,会有较大误差。一般选用标准溶液或蒸馏水作为空白对比液。
