采用分光光度法测定弱电解质的电离常数实验报告
一、 实验目的
1、 了解一种测定弱电解质电离常数的方法。
2、 掌握分光光度计的测试原理和使用方法。
3、 进一步熟练掌握pH的原理和使用方法。
二、 实验原理
根据朗伯-比耳定律,溶液对单色光的吸收,遵守下列关系式:
 ①
①
式中,A为吸光度; I/I0为透光率T;k为摩尔吸光系数它是溶液的特性常数;C为溶液浓度;l为溶液的厚度。
在分光光度分析中,将每一种单色光,分别依次地通过某一溶液,测定溶液对每一种光波的吸光度,以吸光度A对波长λ作图,由图可以看出,对应于某一波长有一个最大的吸收峰用这一波长的入射光通过该溶液就有最佳的灵敏度。
从①式可以看出,对于固定长度吸收槽,在对应的最大吸收峰的波长λ)下测定不同浓度c的吸光度,就可以做出线性的A~C,就是光度法的定量分析的基础。
以上讨论是对于单组份溶液的情况,对于含有两种以上组分的溶液,情况就要复杂一些。
1. 若两种被测定组分的吸收曲线彼此不相重合,这种情况就很简单,就等于分别测定两种单组分溶液。
2. 若两种被测定组分的吸收曲线相重合,且遵守贝尔-郎比定律,则可在两波长λ1及λ2时(λ1、λ2是两种组分单独存在时吸收曲线最大吸收峰波长)测定其总吸光度,然后换算成被测定物质的浓度。
根据贝尔-郎比定律,假定吸收槽长度一定时,则

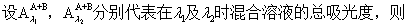
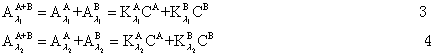

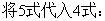
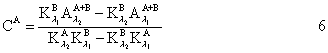
本实验是用分光光度法测定弱电解质(甲基红)的电离常数,犹豫甲基红本身带有颜色,而且在有机溶剂中电离度很小,所以用一般的化学分析法或者其它物理方法进行测定都有困难,但用分光光度法可不必将其分离,且同时能测定两组分的浓度。甲基红在有机溶剂中形成下列平衡:

甲基红的电离常数:
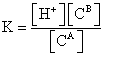
或  7
7
由7式知,只要测定溶液中[B]与[A]的浓度及溶液的pH值,即可求得甲基红的电离常数。
三、 实验仪器及试剂
仪器:722型分光光度计1台;pHs-3D型酸度计1台;容量瓶(100mL)7只;量筒(100mL)1只;烧杯100mL,4只);移液管(10mL,刻度)2支;洗耳球1只
试剂:酒精(95%,化学纯);HCl(0.1mol/L);HCl(0.01mol/L);醋酸钠(0.04mol/L);甲基红溶液
四、 实验内容
1、 制备溶液
(1) 甲基红溶液 将1g甲基红加300mL95%的乙醇,用蒸馏水稀释至500mL容量瓶中。
(2) 甲基红标准溶液 取10mL上述溶液,加入50mL95%乙醇,用蒸馏水稀释至100mL容量瓶中。
(3) 溶液A 取10.00mL甲基红标准溶液,加入0.1mol/L盐酸10mL,用蒸馏水稀释至100mL容量瓶中。
(4) 溶液B 取10mL甲基红标准溶液,加入0.04mol/L醋酸钠25mL,用蒸馏水稀释至100mL容量瓶中。
溶液A的pH约为2,甲基红以酸式存在。溶液B的pH约为8,甲基红以碱式存在。将溶液A、B和空白液(蒸馏水)分别放入三个洁净的比色皿内,测定吸收光谱曲线。
2、 吸收光谱曲线的测定
(1)用752分光光度计测定溶液A和溶液B的吸收光谱曲线并求出最大吸收峰的波长。波长从360nm开始,每隔20nm测定一次(每改变一次波长都有先用空白溶液校正),直至620nm为止。
由所得的吸光度A与λ作A-λ曲线,从而求得溶液A和溶液B的最大吸收峰波长λ1和λ2。
(2)求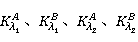 。将A溶液用0.01mol·L-1HCl稀释至开始浓度的0.75、0.50、0.25倍。B溶液用0.01mol?L-1NaAc稀释至开始浓度的0.75、0.50、0.25倍。并在溶液A、溶液B的最大吸收峰波长λ1、λ2处测定上述各溶液的吸光度。如果在λ1、λ2处上述溶液符合朗伯-比耳定律,则可得四条A—c直线,由此可求出
。将A溶液用0.01mol·L-1HCl稀释至开始浓度的0.75、0.50、0.25倍。B溶液用0.01mol?L-1NaAc稀释至开始浓度的0.75、0.50、0.25倍。并在溶液A、溶液B的最大吸收峰波长λ1、λ2处测定上述各溶液的吸光度。如果在λ1、λ2处上述溶液符合朗伯-比耳定律,则可得四条A—c直线,由此可求出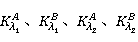 。
。
3、 混合溶液的总吸光度及其pH的测定
(1) 配制四个混合液
1) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+50mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
2) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+25mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
3) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+10mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
4) 10mL标准溶液+25mL0.04 mol·L-1 NaAc+5mL0.02 mol·L-1HAc,用蒸馏水稀释至100mL。
(2) 条件允许,可用超级恒温水浴25℃恒温5min后在进行测量。
(3) 用λ1、λ2的波长测定上述四个溶液的吸光度。
(4) 测定上述四个溶液的pH值。
五、 实验内容数据处理与处理结果
吸光度A—波长λ表


由图得,溶液A的最大吸收峰波长λ1=520,溶液B的最大吸收峰波长λ2=420。
波长为λ1时溶液A、B的吸光度表
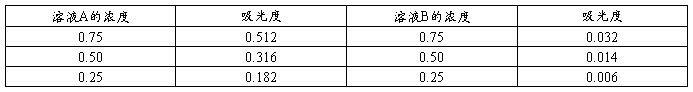
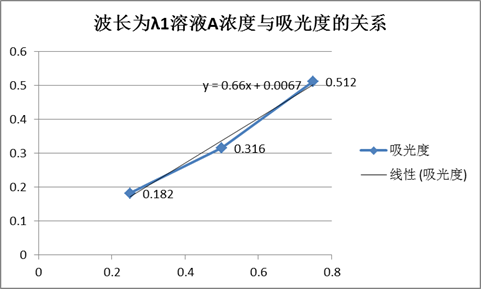
由图得,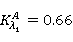 。
。
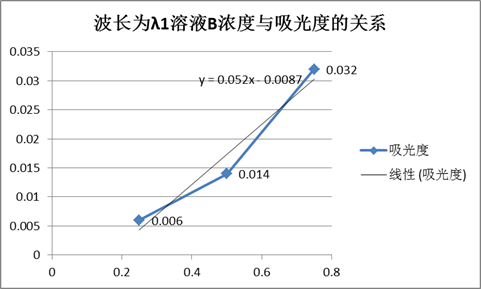
由图得, 。
。
波长为λ2时溶液A、B的吸光度表
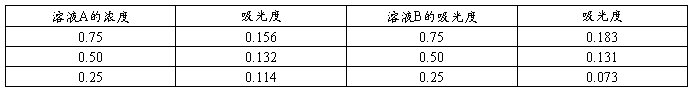
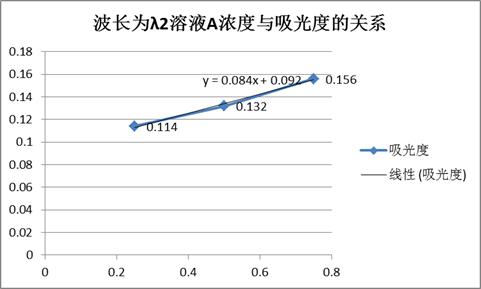
由图得,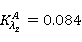
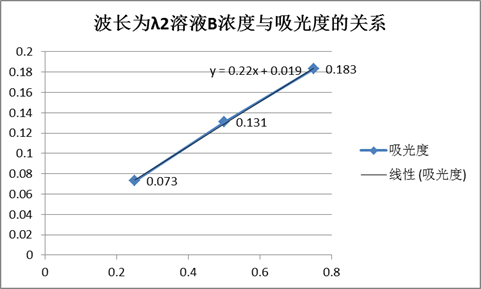
由图得,
混合溶液数据记录表

组别1:


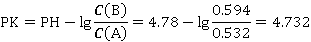
同理得,
组别2:
C(A)=0.524 C(B)=0.772 pK=4.912
组别3:
C(A)=0.288 C(B)=1.342 pK=4.922
组别4:
C(A)=0.114 C(B)=1.342 pK=5.059
六、 讨论
1、 为什么NaAc加入甲基红会变黄?
甲基红在有机溶剂中形成下列平衡:

由平衡关系可以看出,增大溶液酸度,甲基红以HMR结构形式存在,溶液显红色;降低溶液的酸度,甲基红以MR-离子结构形式存在,溶液显黄色。NaAc溶液为弱碱性溶液,加入甲基红中,导致溶液酸度降低,但酸度降低较小,溶液颜色在红、黄之间,呈橙色。
2、 醋酸的电离常数的测定。
1) 不同浓度的HAc溶液的配制
用酸式滴定管分别取5.00mL,10.00mL,25.00mL已标定好的HAc溶液于三个洁净的50mL容量瓶中,再用蒸馏水稀释至刻度,摇匀,并计算每份HAc溶液的准确浓度。
2) HAc溶液pH的测定
用四只洁净干燥的50mL烧杯,分别取20mL左右上述溶液的HAc溶液及一份未稀释的HAc标准溶液。按由稀到浓的顺序在pH计上分别测定它们的pH和实验温度并将pH换算成c(H+)。
将数据代入下式公式:
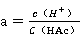
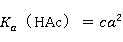
第二篇:用分光光度法测定弱电解质的电离常数






