无机化学性质实验报告
课程名称:无机化学实验实验名称 :铜银锌镉汞
一.实验目的。
1. 了解ds 区元素单质及化合物的结构对性质的影响。
2. 掌握ds区元素单质的氧化物或氢化物的性质。
3. 掌握ds区元素单质的金属离子形成配合物的特征。
4. 掌握Cu(Ⅰ)与Cu(Ⅱ)的相互转化条件。
5. 学习ds区元素离子的鉴定。
二.实验原理。
铜银锌镉汞皆是周期系ds区元素。在化合物中,铜银锌镉汞常见的氧化物通常是+2,其中铜和汞也有+1;银的氧化数通常是+1.
1. 蓝色的Cu(OH)2具有两性。Ag+与适量的NaOH反应只能得到Ag2O沉淀,因AgOH极其不稳定,在室温下即可脱水生成Ag2O 。 Ag++2O H -===Ag2O+H2O
铜二价与过量的氨水作用可生成深蓝色的四氨合铜配离子,银离子与适量的氨水作用可生成氧化银沉淀,过量时生成无色Ag(NH3)2+配离子。
Hg2+ 、Hg22+与过量氨水反应时,首先生成难溶于水的白色氨基化合物,在没有大量NH4+存在的条件下,氨基化合物不宜形成氨配离子。在有大量NH4+存在的条件下,氨基化合物可溶于氨水形成配离子。
Cu2能在中性或弱碱性环境中与K4[Fe(CN)6] 反应生成红棕色的Cu2【Fe(CN)6】沉淀,可以利用这个反应来鉴定Cu2。
2.锌的氧化物和氢氧化物均显两性。
3镉的氧化物和氢氧化物均显碱性。
4汞一价二价的氧化物和氢氧化物均显碱性。
5.Cu2+ 、Ag+、Zn2+、Cd2+、Hg22+ 、Hg2+溶液中通入H2S都可生成相应的硫化物沉淀,其中ZnS的KSPθ较大,通入H2S是必须控制溶液的pH值。HgS沉淀极难溶,但可溶于过量的Na2S。通常,在实验室中用王水溶解HgS。Hg2S沉淀不稳定,见光即分解为HgS和Hg。
6.在水溶液中 具有一定的氧化性,能氧化I-和SCN-等,白色的Cu2I2 能溶于过量的KI或KSCN溶液中生成[CuI2]-或【Cu(SCN)2】配离子,这两种离子在稀释时由沉淀为 Cu2I2 和 Cu(SCN)2。
在加热的碱性溶液中, Cu2+能氧化醛或糖类,并生成砖红色的Cu2O.
7,在水溶液中银离子有一定的氧化性。在盐溶液中加入过量的氨水,在加热时,能将醛类或某些糖类氧化,本身被还原成银单质,应用这个反应来制备银镜。
8.Zn2+在强碱性溶液中与二苯硫腙反应生成粉红色的螯合物,Cd2+与饱和溶液反应能生成黄色的CdS沉淀。

三.思考题集讨论。
1. 氢氧化铜的性质; ①热稳定性较碱金属的氢氧化物差得多,受热易分解,加热至253k 时脱水转变为CuO;②氢氧化铜溶于氨水可形成铜氨配离子;③氢氧化铜略显两性,即可溶于酸又可溶于浓碱溶液中。
铜主要有+1和+2 两种氧化态,气态时,Cu+的化合物较稳定,在水溶液中中,Cu2+较稳定。
3.银的卤化物的溶解性从氯到碘逐渐减小。氯化银很好溶于氨水中,溴化银很好溶于硫代硫酸钠溶液,碘化银可以溶于KCN溶液中。
4.锌与少量氨水反应生成白色沉淀,与过量氨水生成配合物【Zn(NH3)4】+而显无色。镉与氨水只生成氢氧化镉。
6.在水溶液中,由铜的电势图 EAθ/V Cu2+0.153 Cu+ 0.521 Cu 可知,Eθ右> Eθ左,Cu+转化为Cu2+的趋势很大,经行的很彻底。使Cu2+ 转化为Cu+时,除了还原剂的存在外,还必须有Cu+的沉淀剂或配位剂,以降低溶液中Cu2+的浓度,使之成为难溶物或难解离的化合物,易于转化。
7.用氨水,可由上面实验1、2得到。
第二篇:无机化学实验二十一 ds区元素(铜银锌镉汞)的性质
实验11 ds区元素(铜、银、锌、镉、汞)的性质
一、实验目的
1、掌握铜、锌氢氧化物的酸碱性;
2、掌握铜、银、锌、汞的配合物的生成和性质;
6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理
IB IIB
Cu Zn Cu(+2,+1) Zn(+2)
Ag Cd Ag(+1) Cd(+2)
Au Hg Au(+1,+3) Hg(+2,+1)
蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。AgOH在常温下极易脱水而转化为棕色的Ag2O。Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg2O(I)。
易形成配合物是这两副族的特性,Cu2+、Ag+、Zn2+、Cd2+与过量的氨水反应时分别生成[Cu(NH3)4]2+、[Ag(NH3)2]+、[Zn(NH3)4]2+、[Cd(NH3)4]2+。但是Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子。如:
HgCl2 + 2NH3 = Hg(NH2)Cl↓白+ 2 NH4Cl
Hg2Cl2 + 2NH3 = Hg(NH2)Cl↓白+ Hg↓黑+NH4Cl (观察为灰色)
Cu2+具有氧化性,与I-反应,产物不是CuI2,而是白色的CuI:
Cu2+ + I- = 2CuI↓白 + I2
将CuCl2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl2]-的溶液。将溶液稀释,得白色CuCl沉淀:
Cu + Cu2+ + 4Cl- = 2[CuCl2]-
[CuCl2]-←稀释→CuCl↓白 + Cl-
卤化银难溶于水,但可利用形成配合物而使之溶解。例如:
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
红色HgI2难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:
HgI2 + 2I- = [HgI4]2-
黄绿色Hg2I2与过量KI反应时,发生歧化反应,生成[HgI4]2-和Hg:
Hg2I2+ 2I- = [HgI4]2-+ Hg↓黑
三、实验内容
1、 氧化物的生成和性质
(1) Cu2O的生成和性质
Cu2+ + 2OH- =Cu(OH)2↓ 蓝色
Cu(OH)2 + 2OH- = [Cu(OH)4]-2- 蓝色
2[Cu(OH)4]2-+ C6H12O6 (葡萄糖) =Cu2O↓(红) + 4OH-+C16H12O7+2H2O
或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)
分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。由于制备方法和条件的不同,Cu2O晶粒大小各异,而呈现多种颜色黄、橙黄、鲜红或深棕。
红色沉淀Cu2O离心分离后,分为两份:
一份加酸:Cu2O + H2SO4 = Cu2SO4 + H2O= CuSO4 + Cu + H2O
一份加氨水:Cu2O+4NH3?H2O=2[Cu(NH3)2]+ (无色溶液)+ 3H2O+2OH-
2[Cu(NH3)2]++4NH3?H2O+1/2O2 =2[Cu(NH3)4]2+ (蓝色溶液)+2OH-+3H2O
(2)Ag2O的生成和性质
2Ag+ + 2OH- = Ag2O↓(棕色)+ H2O
Ag2O + 2HNO3 = 2AgNO3 + H2O
Ag2O + 4NH3H2O = 2[Ag(NH3)2]OH + 3H2O
(3)HgO的生成和性质
Hg2+ + 2OH- = HgO↓(黄色) + H2O
HgO + 2HCl = HgCl2 + H2O
HgO + NaOH= 不反应 (HgO碱性)
Hg22++2OH-=Hg↓+HgO↓+H2O (歧化反应)
2、氢氧化物的生成与性质
(1) Cu2+ + 2OH- = Cu(OH)2↓(蓝色絮状)
加热:Cu(OH)2 = CuO↓ (黑色)+ H2O
加酸:Cu(OH)2 + 2H+= Cu2+ + 2 H2O
加浓碱 :Cu(OH)2 + 2OH- (6M) = [Cu(OH)4]2-
Cu(OH)2两性偏碱,所以需强碱使之生成配离子
(2)Zn2+ + 2OH- = Zn(OH)2↓ (白色)
Zn(OH)2 + 2H+ = Zn2+ + 2 H2O
Zn(OH)2 + 2OH- = Zn(OH)42-
Cd2++2OH-=Cd(OH)2↓白色
Cd(OH)2+H2SO4 = CdSO4 + H2O (沉淀溶解)
Cd(OH)2 + NaOH (6M)= 不反应 (Cd(OH)2碱性)
3、硫化物的生成与性质
铜、银、锌、镉、汞的硫化物的生成(与饱和硫化氢溶液反应)和溶解性(ZnS白色能溶于稀盐酸,CdS黄色溶于浓盐酸,CuS黑色和Ag2S灰色溶于浓硝酸。HgS黑色溶于王水。
3HgS+12Cl-+2NO3-+8H+=3[HgCl4]2-+3S+2NO+4H2O
4、配合物的生成与性质
(1)Ag的配合物
Ag+ + Cl- →AgCl ↓(白)
Ag++ Br- →AgBr ↓(淡黄)
Ag+ + I- →AgI ↓(黄)
AgCl + NH3 = [Ag(NH3)2]+ + Cl- AgCl+ S2O32- →[Ag(S2O3)2]3- + Cl-
AgBr + S2O32- = [Ag(S2O3)2]3- + Br-
(2)Hg的配合物
① Hg2+ + 2I- = HgI2 (红色沉淀)
HgI2+ 2I- = HgI42- (无色溶液)
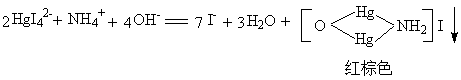 ②
②
③ Hg22++ 2I- = Hg2I2 (黄绿色沉淀)
Hg2I2+ 2I- = HgI42- + Hg(黑色粉末)
5、CuX的生成与性质
(1)CuCl的生成与性质
Cu + Cu2+ + 4Cl- =加热= 2[CuCl2]- 深棕色
[CuCl2]- =稀释=CuCl↓白 + Cl-
注:CuCl2在很浓的溶液中显黄绿色(CuCl4-配离子),浓溶液中显绿色,在稀溶液中显蓝色(Cu(H2O)62+配离子)。
一份:CuCl + 2NH3=2[Cu(NH3)2]+ + Cl-
2[Cu(NH3)2]+ + 4NH3?H2O+1/2O2 = 2[Cu(NH3)4]2++2OH-+3H2O
另一份:CuCl+ Cl-(浓) = [CuCl2]- 深棕色 若稀释又生成沉淀
(2)CuI的生成与性质
Cu2+ + I- = 2CuI↓白 + I2(棕色)
消除I2干扰:I2 + 2 S2O32- = 2I- + S4O62- (注意应严格控制S2O32-的用量)
CuI + I-(饱和) = [CuI2]- 刚好使沉淀溶解,加水稀释时反应逆转又析出CuI。
CuI + KSCN === CuSCN↓(白色或灰白色)+ KI
CuSCN + SCN- === [Cu(SCN)2]- 加水稀释时反应逆转又析出CuSCN。
6、Hg(II)和Hg(I)的转化
Hg2+ + Hg=Hg22+ (注意Hg的取用,回收)
Hg22+ + Cl- = Hg2Cl2↓(白色)
Hg2(NO3)2 + 2 NH3H2O = HgNH2NO3↓(白色) + Hg↓(黑色)+ NH4NO3 + 2H2O
Hg2+和Hg22+与过量氨水反应时,如果没有大量的NH4+存在,并不生成氨配离子
7、离子鉴定
(1)Cu2+离子的鉴定
(弱酸性或中性介质)
2Cu2+ + [Fe(CN)6]4- = Cu2 [Fe(CN)6] ↓ (红棕色沉淀)
Cu2 [Fe(CN)6] +8NH3 = 2[Cu(NH3)4]2++ [Fe(CN)6]4-
(2)Ag+的鉴定
Ag+ + Cl- = AgCl(白色沉淀)
AgCl + 2 NH3H2O = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2] Cl + 2HNO3 = AgCl↓+ 2NH4NO3
(3)Zn2+的鉴定
① 中性或弱酸性介质下
Zn2+ + Hg(SCN)42- = Zn[Hg(SCN)4] (白色沉淀)
②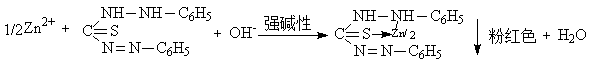 (4)Hg2+的鉴定
(4)Hg2+的鉴定
2HgCl2 + SnCl2 = SnCl4 + Hg2Cl2↓(白色沉淀)
Hg2Cl2 + SnCl2 = SnCl4 +2Hg↓(黑色沉淀)
四、注意事项
1、 本实验涉及的化合物的种类和颜色较多,需仔细观察。
2、 涉及汞的实验毒性较大,做好回收工作。
五、思考题:
1.Cu(I)和Cu(II)稳定存在和转化的条件是什么?
Cu(I)在水溶液中不稳定,Cu2+ 0.158 Cu+ 0.522 Cu,易歧化。在有机溶剂和生成沉淀或某些配合物时可以稳定存在。
Cu2+ + I- = 2CuI↓白 + I2
CuI + I-(饱和) = [CuI2]-
转化:Cu(I)-Cu(II):水中歧化Cu2O+4H+ = Cu2+ + Cu
Cu(II)-Cu(I):加入沉淀剂或配位剂
Cu + Cu2+ + 4Cl- = 2[CuCl2]-
Cu2+ + I- = 2CuI↓白 + I2
2.在AgNO3中加入NaOH为什么得不到AgOH?
AgOH不稳定,易失水变成Ag2O
3.用平衡移动原理说明在Hg2(NO3)2溶液中通入H2S气体会生成什么沉淀?
Hg22+ = Hg2++Hg 歧化反应
加入H2S气体,会发生 Hg2+ + H2S=HgS + 2 H+ Ksp(HgS)=4×10-53 ,会促进歧化反应的进行。
