一、选择题(每题有1或2个正确答案)
1. 下列状态的物质,既能导电又属于电解质的是( )
A. MgCl2 晶体 B. NaCl 溶液 C. 液态氯化氢
D. 熔融的KOH
2. 下面关于电解质电离的叙述正确的是( )
A. CaCO3在水中溶解度很小,其导电能力很弱,所以 CaCO3是弱电解质
B. CaCO3在水中溶解度很小,但溶解的 CaCO3全部电离,所以 CaCO3是强电解质
C. 氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D. 水难电离,纯水几乎不导电,水是非电解质
3. 下列物质中,导电性能最差的是( )
A. 石墨棒 B. 盐酸溶液 C. 熔融的氢氧化钠 D. 固体氯化钾
4. 下列物质的水溶液能导电,但其本身属于非电解质的是( )
A. 乙酸 B. 酒精 C. 食盐 D. 氨气
5. 正确书写离子方程式时,下列各项中,应使等式两边相等的是( )
①离子数目相等 ②粒子总数相等 ③原子数目相等 ④阳离子所带正电荷总数跟阴离子所带负电荷总数相等 ⑤分子数目相等 ⑥各元素原子数目相等
A. 只有①⑤ B. 只有②④ C. 只有③⑥ D. 只有④⑥
6. 向饱和石灰水中不断通入二氧化碳,其溶液导电性的变化是( )
A. 由弱变强 B. 由强变弱
C. 由强变弱,再变强 D. 由弱变强,再变弱
7. 下列各组中的离子,相互间不发生离子反应的是( )
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、CO32-、NO3-
C. Cu2+、K+ 、SO42-、NO3- D. Na+、HCO3-、OH-、Ca2+
8. 电解质在人体内的作用是十分广泛和十分重要的,当电解质紊乱时,人体就要出现一系列不适症状,甚至会危及生命。为维持人体内电解质平衡,在大量出汗后应及时补充的离子是( )
A. Mg2+ B. Ca2+ C. Fe 3+ D. Na+
9. 下列离子方程式中正确的是( )
A. 稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ +H2↑
B. 硫酸钠与氯化钡溶液混和:SO42- + Ba2+ = BaSO4↓
C. 硝酸滴在石灰石上:CaCO3+ 2H+= Ca2+ +H2CO3
D. 氧化铜与硫酸混和: Cu2+ + SO42-= CuSO4
10. 下列叙述正确的是( )
A. NaOH 溶液能导电,所以 NaOH 溶液是电解质
B. 固体KCl 不导电,但KCl 是电解质
C. 氯化氢的水溶液能导电,所以HCl 是电解质
D. CO2 的水溶液能导电,所以CO2 是电解质
二、填空题
11. 在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由
(1)CH3COONa溶液与HCl溶液混和_________________________
(2)Ca(OH)2 的澄清溶液与Na2SO4稀溶液混和____________________
(3)Ca(OH)2 的澄悬浊液与Na2SO4浓溶液混和____________________
(4)CuCl2 溶液与H2SO4溶液混和__________________________
12. (1)向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式
____________________________
(2)在上述溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________
_____________________
13. 将HCl、H2SO4、Ba(NO3)2 三种溶液,按一定顺序滴入到Na2CO3溶液中至恰好完全反应有
以下现象:
(1)加入A时有白色沉淀;
(2)往(1)中沉淀里加入B时沉淀溶解,并有气体逸出;
(3)往(2)中溶液里加入C时,又有白色沉淀生成。 根据以上现象判断A、B、C分别是HCl溶液、H2SO4溶液、Ba(NO3)2溶液中的哪种?
A_________________,B_______________,C__________________. 写出B使沉淀溶解的离子方程式____________________________________________.
14. A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。
(1)若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1)(2)实验事实可推断它们的化学式为:
A. _________;B. _________;C. _________;D. ___________。
15. 有五瓶溶液分别为a、b、c、d、e,它们可能是AgNO3、BaCl2、HCl、K2CO3、K2SO3.现做如下实验:a与b混合;a与c混合;a与d混合;c与d混合;e与d混和;e与a混合,都有白色沉淀生成,b与c混合有无色无味气体生成,则五种溶液是a________;b_________;c________;d_________;e_________。
16. 工业食盐含Ca2+、Mg2+、SO42- 等杂质,要想精炼成精盐,请回答下列问题:
(1)精炼过程所发生的离子方程式为
①_______________________________;
②_______________________________;
③_______________________________。
(2)除去SO42-,必须添加钡试剂,该钡试剂可以是___________
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________.
A. 先加NaOH,后加Na2CO3,再加Ba2+试剂
B. 先加NaOH,后加Ba2+试剂,再加Na2CO3
C. 先加Ba2+试剂,后加NaOH,再加Na2CO3
17. 有A、B、C、D、E、F六种化合物,它们之间的反应关系如
下:
①A +B → C + E
②C +NaOH→蓝色沉淀D + F
③D → A +E
④F +Ba(NO3)2 →白色沉淀 +NaNO3
(1)试写出它们的化学式:
A___________;B___________;C__________;D__________;
E_________;F_________.
(2)写出反应①、④的离子方程式。
①___________________________________;
④___________________________________。
18. 现有一包白色粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4,进行如下实验①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,据上述实验现象推断:一定不存在___________,一定存在_____________,可能存在_________,对于可能存在的物质应如何近一步检验?写出简要的步骤和有关的离子方程式。
参考答案
一、选择题
1. D 2. B 3. D 4. D 5. D 6. C 7. C 8. D 9. B
10. BC
二、填空题
11.(1)CH3COO- + H+ =CH3COOH
(2)这里不能发生离子反应,理由是:在澄清的Ca(OH)2 溶液,Na2SO4 溶液中Ca(OH)2.Na2SO4 都溶解且电离。假设Ca(OH)2与Na2SO4 进行离子交换,则对应的“新物质”NaOH易溶易电离,CaSO4是微溶物质,它在稀溶液中也是易溶解且完全电离,假设不能成立,即没有离子反应发生。
(3)Ca(OH)2 +SO4 2-= CaSO4↓+2OH-
(4)这里不能发生离子反应,理由是:氯化铜、硫酸均是易溶易电离的物质。假设氯化铜与硫酸发生离子交换,则对应的“新物质”是硫酸铜和盐酸,而硫酸铜和盐酸也是易溶易电离的物质,假设不能成立,即没有离子反应发生。
12. (1)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(2)SO42-+Ba2+=BaSO4↓
13. Ba(NO3)2 溶液; HCl 溶液; H2SO4 溶液
BaCO3+2H+=Ba2++CO2↑+H2O
14. BaCl2;AgNO3;CuSO4;Na2CO3
15. a: AgNO3 b: HCl c: K2CO3 d: BaCl2 e: K2SO3
16. (1)①Ba2+ +SO4 2- = BaSO4↓
②Ca2+ +CO32- = CaCO3 ↓
③Mg2+ +2OH- = Mg(OH)2↓
(2)AC
(3)BC
17. (1)CuO;H2SO4;CuSO4;Cu(OH)2;H2O;Na2SO4
(2)①CuO+2H+=Cu2++H2O
④Ba2+SO42-=BaSO4↓
18. CaCO3、CuSO4、Na2SO4;Na2CO3;NaCl
取无色溶液少量放于试管中,滴加足量的稀HNO3,待气泡放尽后,滴加AgNO3 试剂,看是否产生白色沉淀。若有,则含有NaCl,反之则无。
CO32- +2H+ =CO2↑+H2O Ag+ +Cl- = AgCl↓
第二篇:高一化学电解质测试1
电解质1
知识回顾
1、电解质和非电解质的区别
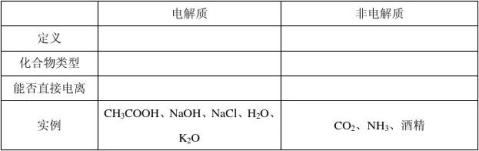
2、电离:化合物或时,能够的过程。电离时,生成的 的化合物称为酸;生成的 的化合物称为碱;能生成 和 的化合物称为盐。
写出下列化合物的电离方程式: H2SO4: KOH: BaCl2:
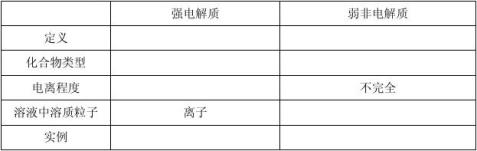
3、强电解质和弱电解质的区别
4、电解质按照其在水溶液中能否完全电离分为 弱电解质溶液的导电能力,电解质溶液的导电能力取决于溶液中的自由移动的离子浓度的大小。溶液中的自由移动的离子浓度越大,其导电性 ;浓度越小,其导电性 。如:硝酸是强电解质,但如果浓度很小,溶液中自由移动的离子浓度就很小,其导电性就 较浓的醋酸溶液。
1、下列物质中含有自由移动的Cl-的是( ) A、KClO3溶液
B、液态HCl
C、KCl溶液
D、NaCl晶体
2、下列物质中,导电性能最差的是( ) A、熔融氢氧化钠
B、石墨棒
C、盐酸
D、氯化钾固体
3、BaSO4在熔化状态下能导电,其本质原因是 ( )
A、是电解质 B、存在自由移动的离子 C、存在电子 D、存在离子 4、下列叙述正确的是( )
A、在水溶液中能自身电离出自由移动的离子的化合物是电解质
B、凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质
C、能导电的物质一定是电解质
D、某物质若不是电解质,就一定是非电解质
5、下列电离方程式中,正确的是( )
A、NH3·H2O=NH+-
4+OH
B、KClO3=K++Cl-+3O2-
C、H2S=2H++S2-
D、NaOH=Na++OH-
6、下列化合物中,只有在溶液中才能导电的电解质是( )
A、NaCl B、酒精 C、H2SO4 D、KCl
7、某无色溶液中,可大量共存的离子组是( )
A、Na+、HCO3-、SO42-、Br-
B、Cu2+、NO3-、Cl-、SO42-
C、H+、Cl-、Na+、CO32-
D、Na+、Mg2+、SO42-、OH-
8、下列物质的水溶液能导电,但本身属于非电解质的是 ( )
A、Cl2 B、 NH3 C、HCl D、KCl
9、下列说法正确的是 ( )
A、电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离
B、强电解质与弱电解质的本质区别是其水溶液导电性的强弱
C、酸、碱和盐类都属于电解质,其他化合物都是非电解质
D、常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是弱电解质
10、下列物质中既不属于电解质,也不属于非电解质,但其水溶液能导电的是(
A、C12 B、Na C、Na2CO3 D、C2H5OH
11、某化合物易溶于水,但其水溶液不导电,则该化合物是( )
A、弱电解质 B、强电解质 C、非电解质 D、不能确定
12、分别向下列各溶液中加入少量NaOH固体,溶液的导电能力变化最小的是(
A、水 B、盐酸 C、醋酸溶液 D、NaCl溶液
13、下列关于酸、碱、盐元素组成的说法中,正确的是( )
A、酸、碱一定含氢,盐一定不含氢
B、酸、碱、盐可能都不含金属元素
C、碱、盐可能含氧,酸一定含氧
D、盐一定含金属元素,酸、碱不一定含金属元素
14、下列离子方程式正确的是( ) ) )
A、碳酸钙与盐酸反应:CO32-+H+ = H2O+CO2↑
B、铁跟稀硫酸反应:2Fe+6H+ = 2Fe3++3H2↑
C、醋酸与氢氧化钡反应:OH-+H+ = H2O
D、二氧化碳与过量的氢氧化钠反应:CO2+2OH- =CO32-+H2O
15、无论在酸性还是碱性溶液中,都能大量共存的离子组是( )
A、K+、SO32-、S2-、SO42-
B、Na+、Cu2+、SO42-、Cl-
C、Br-、Ba2+、Cl-、K+
D、Ca2+、K+、CO32-、NO3-
16、现有以下物质:①NaCl晶体②液态SO2③液态醋酸④汞⑤固体BaSO4⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3。请回答下列问题。(填相应序号)
(1)以上物质能导电的是
(2)以上物质属于电解质的是
(3)以上物质属于非电解质的是
(4)以上物质中溶于水后形成的水溶液能导电的是。
17、写出下列物质在水溶液中的电离方程式
(1)Ba(OH)2
(2)NH4HSO4
(3)NaHCO3
(4)H2SO4
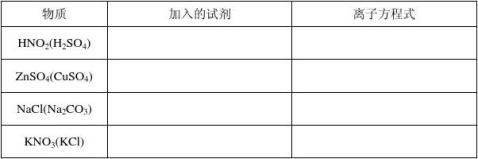
18、除杂(括号里的物质为杂质)
19、有下列离子:K+、Mg2+、Ba2+、Na+、SO42-、OH-、NO3-、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是 ,
20、(1)向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,写出反应的离子方程式:
(2)在以上中性溶液中,继续加入Ba(OH)2溶液至沉淀完全,此步的离子方程式为:
