20##-2015学年度高二化学新授学案
课题:水溶液 (课时三)电解质在水溶液中的存在形态
顺序号:18 命制人:高爱军
学习目标:1、掌握强弱电解质的定义、常见的强弱物质
2、掌握强弱电解质的电离方程式
【知识梳理】:
1、电解质与非电解质的概念:
电解质:在 能够导电的 称为电解质。常见电解质 、
、
非电解质:在 下都不能导电的 称为非电解质。常见非电解质 、
2、 称为强电解质;常见强电解质 、 、
称为弱电解质,常见弱电解质 、
【注意:】
1、电解质、非电解质所属物质范围是 且是 ,单质和混合物既不是电解质也不是非电解质。
2、判断电解质与非电解质的标准:
(1)SO2、SO3、NH3的水溶液 导电,但其导电原因是与水作用后生成的生成物(H2SO3、H2SO4、NH3?H2O)电离所致,并非自身电离出 ,所以SO2、SO3、NH3等为 ___________,而H2SO3、H2SO4、NH3?H2O则是 __。
(2)有些物质由于很难溶解,致使电离产生的离子浓度太小,测不出导电性能,但却是电解质,甚至是强电解质,如CaCO3、BaSO4等。这是因为这类化合物在水溶液被溶解的部分是完全电离的;且在熔化时,也是完全电离的。
(3)某些离子型氧化物,如Na2O、CaO、Na2O2等。它们虽然溶于水后电离出来的自由离子不是自身的,但在熔化时却可自身电离,且完全电离,故属于强电解质。
3、能导电的物质、 是电解质,电解质 能导电;
导电的前提条件是:
溶液导电能力的强弱与 有关。离子浓度 ,导电能力强;离子浓度 ,导电能力弱。
4、强电解质导电能力 强,弱电解质导电能力 弱:
如果是在同温、浓度相等的强、弱电解质,强电解质的导电能力强,弱电解质的导电能力弱;如果某强电解质溶液浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度很小,但如果浓度较大时,该溶液的导电能力也可以较强。
【反馈练习】:现有下列物质:⑴Cl2 ⑵SO2 ⑶石墨 ⑷HCl ⑸盐酸 ⑹铜 ⑺BaSO4
⑻CH3COOH ⑼氨水 ⑽NH3?H2O ⑾Na2O ⑿CH3CH2OH ⒀Ba(OH)2
⒁Na2SO4溶液 ⒂NH3 ⒃H2O
(1)能导电的物质有: ;
(2)属于电解质的有: ;
(3)属于非电解质的有: ;
(4)属于强电解质的有: ;
(5)属于弱电解质的有: 。
2、电离方程式的书写:
(1)强电解质:
H2SO4 ;KOH ;Ba(OH)2 ;
NaHSO4(水溶液) ;(熔融) ;
KAl(SO4)2 ; NaHCO3 。
(2)弱电解质:
H2O ; CH3COOH ; NH3?H2O ;
H2CO3 ______________________________;Fe(OH)3 _____。
H3PO4 _______________________________________________________________。
3:强弱电解质的比较:
1、强弱电解质与结构的关系:

20##-2015学年高二化学一日一练:序号:
1、在pH=9的NaOH和pH=9的CH3COONa溶液中,设由水电离产生的C(OH―)分别为x、y(单位为mol/L),则x和y的关系为( )
A、x>y B、x=10-4y C、y=10-4x D、x=y
2、下列四种溶液中:①pH为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的NaOH溶液;④pH为11的NaOH溶液,由水电离生成的C(H+)之比依次为( )
A、0:1:12:11 B、14:13:12:11
C、14:13:2:11 D、1:10:100:1000
3、常温下,在0.1mol/LCH3COOH溶液中,水的离子积是( )
A、1×10-14 B、1×10-13 C、1.32×10-14 D、1.32×10-15
4、下列操作中,能使电离平衡H2O H++OH―向右移动,且溶液呈酸性的是( )
H++OH―向右移动,且溶液呈酸性的是( )
A、向水中加入NaHSO4溶液 B、向水中加入Al2(SO4)3溶液
C、向水中加入Na2CO3溶液 D、将水加热到100℃,使pH=6
5、将100ml 0.1mol/LK2CO3溶液与pH=13的Ba(OH)2溶液等体积混合,要使其滤液的pH=7,应加入1mol/L盐酸的体积为( )
A、10ml B、20ml C、40ml D、60ml
6、下列说法正确的是( )
A、pH=2与pH=1的硝酸中C(H+)之比为1:10
B、Na2CO3溶液中C(Na+)与C(CO32―)之比为2:1
C、0.2mol/L与0.1mol/L醋酸中C(H+)之比为2:1
D、NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
7、1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A、9.0 B、9.5 C、10.5 D、11.0
8、pH=2和pH=12的两种溶液等体积混合后溶液的pH是( )
A、>7 B、<7 C、=7 D、无法确定
9、甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L时,甲酸中的C(H+)约为乙酸中C(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次是a、乙酸、b,由此可知( )
A、a的浓度必小于乙酸的浓度 B、a的浓度必大于乙酸的浓度
C、b的浓度必小于乙酸的浓度 D、b的浓度必大于乙酸的浓度
10、常温时,纯水中由水电离的C(H+)=a,pH=1的盐酸中由水电离的C(H+)=b,0.2mol/L的盐酸与0.1mol/L的氢氧化钠溶液等体积混合后,由水电离的C(H+)=c,则a、b、c的关系正确的是( )
A、a>b=c B、a>c>b C、c>b>a D、b>c>a
11、室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离的C(OH―)的数据分别为:甲:1.0×10―7mol/L;乙:1.0×10―6mol/L;丙:1.0×10―2mol/L;
丁:1.0×10―12mol/L。其中你认为正确的数据是( )
A、甲、乙 B、乙、丙 C、丙、丁 D、乙、丁
12、下列说法正确的是( )
A、HCl溶液中无OH―,NaOH溶液中无H+
B、溴的四氯化碳溶液中无H+
C、NaCl溶液中既有OH―也有H+,且两者之积在任何条件下都不变
D、常温下,任何物质的稀的水溶液中都有H+和OH―,且Kw=[H+]?[OH―]= 10―14(mol/L)2
13、在下列各种叙述中,正确的是( )
A、在任何条件下,纯水的pH=7 B、在任何条件下,纯水都呈中性
C、在100℃时,纯水的pH<7 D、在100℃时,纯水的C(H+)<1×10-7mol/L
14、若在100℃时,水的离子积为1×10―12,若该温度下某溶液中[H+]=1×10-7mol/L,则该溶液( )
A、呈碱性 B、呈酸性 C、呈中性 D、[OH―]=100[H+]
15、已知25℃时Kw=1×10―14(mol/L)2,如果100℃时Kw=1×10―12(mol/L)2,这说明( )
A、100℃时水的电离程度较小
B、前者[H+]较后者大
C、水的电离过程是一个吸热过程
D、100℃时0.1mol/LDCl的重水溶液中水的电离程度一定是室温时电离程度的10倍
16、水的电离过程为H2O H++OH―,在不同温度下其离子积常数为
H++OH―,在不同温度下其离子积常数为
K(25℃)=1×10―14(mol/L)2,K(35℃)=2.1×10―14(mol/L)2。则下列叙述中正确的是( )
A、C(H+)随着温度的升高而降低 B、在35℃时,C(H+)> C(OH―)
C、水的电离程度α(25℃)>α(35℃) D、水的电离是吸热的
17、下列溶液一定呈中性的是( )
A、pH=7的溶液 B、[H+]=[OH―]的溶液
C、由强酸、强碱等物质的量反应得到的溶液 D、非电解质溶于水得到的溶液
18、在25℃时,某溶液中由水电离出的[H+]=1×10―12mol/L,则该溶液的pH可能是( )
A、12 B、7 C、6 D、2
高二化学一日一练 顺序号:
19、pH=2和pH=4的两种稀硫酸,等体积混合后,下列结论正确的是( )
A、 C(H+)=1.0×10―3mol/L B、C(OH―)=2.0×10―12mol/L
C、pH=2 D、pH=3
20、将25ml pH=10的KOH溶液跟5ml pH=10的Ba(OH)2溶液混合,所得溶液的pH为( )
A、9.7 B、10 C、10.3 D、10.7
21、中和相同体积、相同pH的硫酸、盐酸、醋酸三种溶液,所用相同浓度的氢氧化钠溶液的体积依次为V1、V2、V3,则这三者的关系是( )
A、V1>V2>V3 B、V1<V2<V3 C、V1=V2>V3 D、V1=V2<V3
22、往纯水中加入下列物质,能使水的电离平衡发生移动的是( )
A、蔗糖 B、NaOH C、酒精 D、CH3COOH
23、某溶液在25℃时由水电离出氢离子的浓度为1×10―12mol/L,下列说法正确的是( )
A、HCO3―、HS―、HPO42―等离子在该溶液中不能大量共存
B、该溶液的pH可能为2
C、向该溶液中加入铝片后,一定能生成氢气
D、若该溶液中的溶质只有一种,它一定是酸或者是碱
24、25℃,NaOH溶液pH为a,某酸溶液pH为b,a+b=14,a≥11。将两种溶液按等体积混合,下列说法正确的是( )
A、混合溶液的pH必定为7
B、混合溶液的pH≤7
C、向混合溶液中加入MgCl2溶液,可能生成Mg(OH)2沉淀
D、混合溶液中可能有两种溶质
25、在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯同时加入质量不等的锌粒,反应结束后得到等量的氢气,下列说法正确的是( )
A、甲烧杯中放入锌粒的质量比乙烧杯中放入锌粒的质量大
B、甲烧杯中酸过量
C、两烧杯中参加反应的锌相等
D、反应开始后,乙烧杯中的[H+]始终比甲烧杯中的[OH―]小
26、为更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg([H+]/[OH―]),则下列叙述正确的是( )
A、在25℃时,若溶液呈中性,则pH=7,AG=1
B、在25℃时,若溶液呈酸性,则pH<7,AG<0
C、在25℃时,若溶液呈碱性,则pH>7,AG>0
D、在25℃时,溶液中pH与AG的换算公式为AG=2(7-pH)
27、重水(D2O)的离子积为1.6×10-15,可以用与pH一样的定义来规定pD=-lg[D+],以下关于pD的叙述正确的是( )
A、中性溶液的pD=7
B、含0.01mol的NaOD的D2O溶液1L,其pD=12.0
C、溶解0.01ml的DCl的D2O溶液1L,其pD=2.0
D、在100ml 0.25mol/L的DCl溶液中,加入50ml 0.2mol/L的NaOD的重水溶液,
其pD=1.0
28、将纯水加热至较高温度,下列叙述正确的是( )
A、水的离子积变大、pH变小、呈酸性
B、水的离子积不变、pH不变、呈中性
C、水的离子积变小、pH变大、呈碱性
D、水的离子积变大、pH变小、呈中性
29、向25℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的[H+]是( )
A、1×10-2mol/L B、1×10-8mol/L C、1×10-12mol/L D、1×10-4mol/L
30、在一定体积的PH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液的体积之和,则Ba(OH)2溶液和NaHSO4溶液的体积比是( )
A、1:9 B、1:1 C、1:2 D、1:4
 31、pH=1的A、B两种酸溶液,A、B各1ml,分别加水稀释到1000ml,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
31、pH=1的A、B两种酸溶液,A、B各1ml,分别加水稀释到1000ml,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
A、A、B两种酸溶液的物质的量浓度一定相等
B、稀释后,A酸溶液的pH大于B酸溶液的pH
C、若a=4,则A是强酸,B是弱酸
D、若1<a<4,则A、B都是弱酸
32、25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、
pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b, 请填写下列空白:
(1)a值可否等于3 (填“可”或“否”),其理由是 __________________。
(2)a值可否等于5 (填“可”或“否”),其理由是 __________________。
(3)a的取值范围为 。
33、请就25℃时酸与碱混合的有关问题填空:
(1)若1体积的某强酸与10体积的某强碱混合后,溶液呈中性,则混合前,强酸的pH与强碱的pH之间满足的关系是 ____________。
(2)若强酸与强碱的pH之和为13,混合后溶液呈中性,则两者体积比为 。
(3)若强酸与强碱的pH之和为14,且等体积混合,则混合后溶液呈 性。
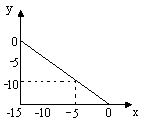 34、某温度下的溶液中c(H+)=1.0×10xmol/L,c(OH-)=1.0×10ymol/L,x与y的关系,如图所示:
34、某温度下的溶液中c(H+)=1.0×10xmol/L,c(OH-)=1.0×10ymol/L,x与y的关系,如图所示:
(1) 求该温度下,中性溶液的PH
(2) 求该温度下,0.01mol/LNaOH溶液的PH
(3) 该温度下,PH=a的醋酸与PH=b的NaOH
溶液等体积混合,恰好完全反应,求此醋酸
溶液中醋酸的电离度(已电离的醋酸与总醋酸的百分比)
第二篇:高二化学选修4(人教版)练习第四节 难溶电解质的溶解平衡
高二化学选修4(人教版)练习题
第四节 难溶电解质的溶解平衡
【典型例题】
1. 下列说法中正确的是( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s)Ag(aq)+Cl(aq),往其中加入少量NaCl +-
粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的Ca2、Mg2、HCO3、SO24,加热煮沸可以完全除去其中的 ++--
Ca2、Mg2 ++
解析:A项中温度升高,Ca(OH)2溶解度降低,碱性减弱,pH减小,A项错误;B项中加入NaCl,虽然平衡左移,但加入了NaCl粉末会使溶液中离子的总浓度会增大,B项错误;沉淀总是向溶解度更小的方向转化,C项中现象说明AgI的溶解度小于AgCl,对于同类型(阴、阳离子个数分别相等)的难溶物,Ksp
++越小,溶解度越小,C项正确;D项加热煮沸,只能降低Ca2、Mg2的浓度,而不可能完全除去,D项错
误。
答案:C
2.下列说法正确的是( )
2A.向Na2SO4溶液中加入过量BaCl2溶液,则SO24沉淀完全,溶液中只含Ba、 -+
Na和Cl,不含SO24 +--
B.Ksp小的物质的溶解能力一定比Ksp大的物质的小
C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
D.洗涤沉淀时,洗涤次数越多越好
解析:生成BaSO4沉淀后的溶液中仍然存在Ba2和SO2因为有BaSO4的沉淀溶解平衡存在,A不正确;4,
同类型物质的Ksp数值越小,溶解能力越小,不同类型的物质则不能直接比较,B不正确。从减小BaSO4沉淀损失的角度而言,用稀H2SO4洗涤效果好,因为H2SO4可以抑制BaSO4的溶解,C正确。洗涤沉淀一般2~3次即可,次数过多会使沉淀溶解而减少。 +-
答案:C
3.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是
( )
- A.温度一定时,Ksp(SrSO4)随c(SO24)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
1
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
解析:A项,Ksp只与温度有关,与浓度的大小无关;283 K时对比线上所有的点为饱和溶液,而a点在此温度下是不饱和溶液。D项,283 K下的SrSO4饱和溶液升温到363 K后,因363 K时的Ksp小于283 K时的Ksp,故溶液变为过饱和溶液。
答案:B
4.往含I和Cl的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。
--则原溶液中c(I)/c(Cl)的比值为(
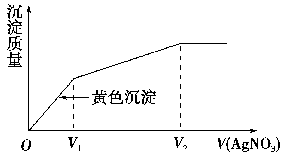
) --
A.(V2-V1)/V1
C.V1/(V2-V1)
-+ B.V1/V2 D.V2/V1 -+解析:根据I+Ag===AgI↓(黄色),Cl+Ag===AgCl↓(白色),结合图示,可知
I、Cl消耗AgNO3溶液的体积分别为V1、(V2-V1),因此在原溶液中c(I)/c(Cl)=V1/(V2-V1)。 答案:C
5.已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊
液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化为黑色固体的离子方程式:
________________________________________________________________________。
(2)简要说明白色固体转化为黑色固体的原因。
解析:由于AgCl的溶解度远大于Ag2S的溶解度,即Ksp(AgCl)>Ksp(Ag2S),当在AgCl与水的悬浊液中加
+-+-入Na2S(aq)时,对Ag2S来说Qc>Ksp,所以2Ag+S2===Ag2S↓,使

AgCl(s) Ag+Cl溶解平衡向右
移动,最终转化成Ag2S。
答案:(1)2AgCl+S2===Ag2S+2Cl ------
(2)因为Ag2S的溶解度比AgCl的溶解度小,根据平衡移动原理,沉淀溶解平衡向离子浓度减小的方向移动
6. 与c(H)·c(OH)=Kw类似,FeS饱和溶液中存在:

FeS(s)
c(Fe2)·c(S2)=Ksp。常温下Ksp=8.1×10+--17+-Fe2(aq)+S2(aq), +-。
(1)理论上FeS的溶解度为____________________________________________。
(2)又知FeS饱和溶液中c(H)与c(S2)之间存在以下限量关系:[c(H)]2·c(S2)=1.0×1022,为了使
++溶液中c(Fe2)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H)为______。 +-+--
解析:(1)由FeS(s)
+Fe2(aq)+S2(aq) +-c(Fe2)=Ksp=8.1×10=9×109 mol·L1 --
-即1 L溶液中可溶解9×109 mol的FeS(令所得溶液的密度为1 g·cm3) -
由(100 g+S)∶S=1 000 g∶(9×109×88)g -
2
所以S=7.92×10 g
8.1×1017K-17-+(2)c(Fe)=1 mol·L,则c(S)=mol·L1,c(H)= -=8.1×10+=c(Fe)1 mol·L--82+-12-
1.0×10-3- mol·L1。 1.11×108.1×10-
答案:(1)7.92×108 g (2)1.11×103 mol·L1 ---
【模拟试题】(答题时间:30分钟)
一、选择题
1.有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率为0
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
解析:溶解平衡为动态平衡,是沉淀生成的速率和沉淀溶解的速率达到相等而并非速率为0的状态,物质
+--的难溶是相对的,因此AgCl溶液中Ag、Cl非常少,向AgCl沉淀中加NaCl,增大c(Cl),使平衡向逆方
向移动,则溶解度减小。答案:C
2.下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
解析:本题考查了沉淀溶解平衡的建立与特征。A项:反应开始时,各离子的浓度没有必然的关系。B项正确。C项沉淀溶解达到平衡时溶液中溶质的离子浓度保持不变,但不一定相等。

D项:沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。答案:B
3.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:
+-Ba(OH)2(s)Ba2(aq)+2OH(aq)。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是
( )
A.溶液中钡离子数目减小 B.溶液中钡离子浓度减小
C.溶液中氢氧根离子浓度增大 D.pH减小
解析:在Ba(OH)2悬浊液中,加入BaO粉末,使溶液中水量减少,部分Ba2+和OH-结合为Ba(OH)2固体
+-+-析出,使Ba2、OH数目减小,但由于温度没有改变,溶解度不变,Ba2和OH的浓度不变,溶液的pH
不变。答案:A
4. 纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有
人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,NaCl的物质的量浓度会变大
解析:饱和食盐水已不再溶解食盐,但对于MgCl2并未达到饱和。NaCl(s)
-被溶解时,c(Cl)增大,平衡左移,还可得到比原来更多的食盐。答案:C Na(aq)+Cl(aq),当MgCl2+-
3
5.已知:Ksp(AgCl)=1.8×10,Ksp(AgBr)=7.8×10
入足量浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主 -10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加
解析:在AgCl和AgBr两饱和溶液中,前者c(Ag)大于后者c(Ag),c(Cl)>c(Br)。当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化:生成AgBr沉淀。当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多。答案:C
6.大理石可以用作墙面、地面和厨房桌面,其主要成分是碳酸钙。食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙。下列能正确解释此现象的是( )
A.食醋中的水使碳酸钙溶解
B.食醋中的醋酸将碳酸钙氧化
C.食醋中的醋酸与碳酸钙反应并放出大量的二氧化碳气体
D.食醋中的醋酸与碳酸钙发生了复分解反应
解析:CaCO3难溶于水,但能与比碳酸酸性强的酸发生复分解反应,如醋酸的酸性就比碳酸强,又由于食醋中含醋酸的浓度很低,所以几滴食醋与大理石反应不可能放出大量的CO2,本题实际也是对难溶性物质的转化考查,一般来说,强酸可以与弱酸盐反应,生成相应的强酸盐和弱酸的规律,从溶解平衡角度看,由于生成了更弱的酸,而导致平衡向溶解的方向移动。答案:D
7.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )
A.c(Ba2)=c(SO24) +-++--
1/2B.c(Ba2)=c(SO24)=[Ksp(BaSO4)] +-
2C.c(Ba2)≠c(SO2c(SO24),c(Ba)·4)=Ksp(BaSO4) +-+-
2D.c(Ba2)≠c(SO2 c(SO24),c(Ba)·4)≠Ksp(BaSO4) +-+-
2解析:BaSO4饱和溶液中存在溶解平衡,c(Ba2)=c(SO2c(SO24)且c(Ba)·4)=Ksp(BaSO4)。加入
+2-2-Na2SO4(s),Na2SO4溶于水中电离出SO4使c(SO4)增大,溶解平衡逆向移动,使c(Ba2)减小,但达
+-到平衡时溶度积不变,仍然有c(Ba2)·c(SO24)=Ksp(BaSO4)。 +-+-
答案:C
8.在100 mL 0.01 mol·L1 KCl溶液中,加入1 mL 0.01 mol· L1 AgNO3溶液,下列说法正确的是(已知
-AgCl的Ksp=1.8×1010)( ) --
A.有AgCl沉淀析出
C.无法确定 B.无AgCl沉淀析出 D.有沉淀但不是AgCl
100-+----解析:Qc=c(Cl)·c(Ag)=0.01 mol·L10.01/101 mol·L1≈106×1.8×1010=Ksp,故有AgCl101
沉淀生成。
答案:A
9.已知25℃时,Ka(HF)=3.6×104,Ksp(CaF2)= -
1.46×10
是( ) -10。现向1 L 0.2 mol·L1 HF溶液中加入1 L 0.2 mol·L1 CaCl2溶液,则下列说法中,正确的--
4
A.25℃时,0.1 mol·L HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化 C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
c(H)·c(F)[c(F)]2--解析:两溶液混合后,c(HF)=0.1 mol·L,则有==3.6×104,[c(F)]2=3.6×10
c(HF)0.1
-5-1-2-6-2+2+
。c(Ca)=0.1 mol·L。[c(F)]·c(Ca)=3.6×10>1.46×1010,体系中有CaF2沉淀析出。
+
-
-
-1
-1
答案:D
10. 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
-
A.Mg2+2HCO3+2Ca2+4OH===Mg(OH)2↓+2CaCO3↓+2H2O
+
-
+
-
B.Cu2+H2S===CuS↓+2H
+
+
C.Zn2+S2+2H2O===Zn(OH)2↓+H2S↑
+
-
D.FeS+2H===Fe2+H2S↑
+
+
解析:因为溶解度:Zn(OH)2>ZnS,溶液中离子反应往往是生成更难溶的物质,则Zn2和S2结合时
+-
更容易生成ZnS,Zn2+S2===ZnS↓,C项错误。
+
-
答案:C 二、非选择题
11.已知25℃时,Ksp[Cu(OH)2]=2×10
+
-20
。
(1)某CuSO4溶液里c(Cu2)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L1 CuSO4溶液中Cu2沉淀较为完全(使Cu2浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
-
+
+
解析:(1)根据题意:当c(Cu)·c(OH)=2×10
2+
-
2-20
时开始出现沉淀,则c(OH)=
-
2×10+= c(Cu)
2×10--+--
109 mol·L1,c(H)=105 mol·L1,pH=5,所以要生成Cu(OH)2沉淀,应调整pH≥5。 0.02
(2)要使Cu浓度降至0.2 mol·L/1 000=2×10 mol·L,c(OH)= c(H)=106 mol·L1。此时溶液的pH=6。
+
-
-
2+-1-4-1-
2×10-8-
mol·L1,-10
2×10
答案:(1)5 (2)6
12.已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在沉淀溶解平衡。当达到平衡时,溶
液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的Kw相似)。
如:AgX(s)
Ag(aq)+X(aq)
+
-
-10
+
-
Ksp(AgX)===c(Ag)·c(X)=1.8×10AgY(s)
Ag(aq)+Y(aq)
+
-
+
-
Ksp(AgY)===c(Ag)·c(Y)=1.0×10
-12
5
AgZ(s)Ag(aq)+Z(aq)
+--17+-Ksp(AgZ)=c(Ag)·c(Z)=8.7×10
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为
________________________________________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),
-则溶液中Y的物质的量浓度为________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化?________,并简述理由:_________________________________________________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?________,根据你的观点选答一项。
若不能,请简述理由:________________________________________________。
若能,则实现转化的必要条件是_________________________________________。
解析:(2)由于AgY比AgX更难溶,则向AgY的饱和溶液中加入AgX固体,发生沉淀的转化,AgX(s)
---+Y(aq)===AgY(s)+X(aq),则c(Y)减小。
(3)25℃时,AgY的Ksp=1.0×1012,即溶液达到饱和时,c(Ag)=c(Y)=1.0×106 mol·L1,而将
---0.188 g AgY溶于100 mL水中,形成的为饱和溶液(溶质还有未溶解的),则c(Y)=1.0×106 mol·L
1。 -+----
(4)由于Ksp(AgZ)<Ksp(AgY),可以实现AgY向AgZ的转化。在(3)中,c(Ag)=
1.0×106 mol·L1,当c(X)>1.8×104 mol·L-----1+时,即可由AgY向AgX的转化。
答案:(1)S(AgX)>S(AgY)>S(AgZ) (2)减小
(3)1.0×106 mol·L1 --
(4)①能 Ksp(AgY)=1.0×10
----12>Ksp(AgZ)=8.7×10-17 ②能 当溶液中 c(X)>1.8×104 mol·L1时,AgY开始向AgX转化,若要实现AgY向AgX的转化,必须保持溶液
---中的c(X)>1.8×104 mol·L1
13.水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2、Pb(OH)、Pb(OH)2、
--Pb(OH)3、Pb(OH)24,各形态的浓度分数α随溶液pH变化的关系如下图所示:
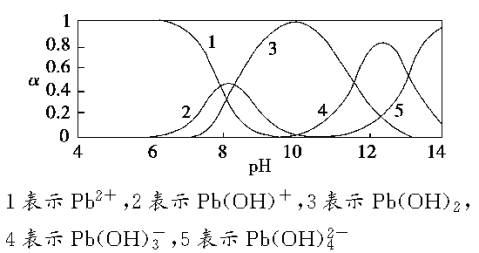
++
c(NO3)(1)Pb(NO3)2+________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,c(Pb)
-c(NO3)
+________________________________。 c(Pb)-
6
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
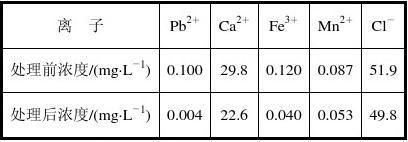
+上表中除Pb2外,该脱铅剂对其他离子的去除效果最好的是________。 +
(4)如果 该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2E2Pb(s)+2H则脱铅的最合适pH范围为( ) ++
A.4~5 B.6~7 C.9~10 D.11~12
解析:(1)根据题中铅的多种存在方式,可知Pb2易水解:Pb2+H2OPb(OH)+H,Pb(OH)+
+-+-2+H2OPb(OH)2+H??故在Pb(NO3)2溶液中c(NO3)/c(Pb)>2,当加入NH4Cl后Pb2与Cl反应
+-+先成微溶性的PbCl2使Pb2浓度降低,故c(NO3)/c(Pb2)增加。(2)由题所给图示可知当pH=8时溶
++++液中存在的阳离子为Pb2、Pb(OH)和H,而在pH=9时图中c[Pb(OH)]迅速降低,而Pb(OH)2浓
+-++度增大,故发生的反应为Pb(OH)+OH===Pb(OH)2。(3)分析比较表中所给数据可知Cu2、Mn2、
-+Cl的浓度都降低不到原浓度的1/2,而Fe3却降低为原浓度的1/3,故对 +++++
Fe3的去除效果最好。(4)由所给平衡可知,要使脱铅效果好,铅应以Pb2的形式存在,pH<7,而c(H++++)增大时2EH(s)+Pb2E2Pb(s)+2H又会向逆反应方向移动,c(H)不宜过大,所以脱铅最适宜的pH为6~7。 ++
答案:(1)> Pb2与Cl反应,Pb2浓度减少 +-+
(2)Pb2、Pb(OH)、H Pb(OH)+OH++++-Pb(OH)2
(3)Fe3 (4)B +
14.已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)
+mMn(aq)+

nAm(aq) +--Ksp=c(Mn)m·c(Am)n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
实验步骤如下:
①往100 mL 0.1 mol·L
成。 -1的CaCl2溶液中加入100 mL 0.1 mol ·L-1的Na2SO4溶液,立即有白色沉淀生②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
7
④______________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越________(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_____________________________。
(3)设计第③步的目的是________________________________________。
(4)请补充第④步操作及发生的现象:_________________________________。
解析:由Ksp表达式不难看出其与溶解度的关系,在硫酸钙的悬浊液中存在着:CaSO4

(s) SO24(aq)
2+2-2-2++Ca(aq),而加入Na2CO3后,溶液中CO3浓度较大,而CaCO3的Ksp较小,故CO3与Ca结合
-2+生成沉淀,即CO23+Ca===CaCO3。既然是探究性实验,必须验证所推测结果的正确性,故设计
了③④步操作,即验证所得固体是否为碳酸钙。 -
答案:(1)大
(2)Na2CO3+CaSO4===Na2SO4+CaCO3
(3)洗去沉淀中附着的SO24 -
(4)向沉淀中加入足量的盐酸,沉淀完全溶解
8
