目 的:通过持续稳定性考察可以检测在有效期内药品的质量,并确定药品能够在标示的贮
存条件下,符合质量标准的各项要求。
适用范围:适用于正式生产的产品、中间产品、原料、主要辅料等稳定性考察。
责 任 人:质量控制实验室负责人及有关人员对本规程的执行负责。
内 容:
1 持续稳定性考察的目的:
是在有效期内监控药品质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。
2 持续稳定性考察对象:
主要针对市售包装药品。但也需兼顾待包装产品。还应当考虑对贮存时间较长的中间产品进行考察。
3 稳定性考察方案:每个品种需要制定考察方案,考察方案应由质量受权人批准执行。
3.1 考察方案应涵盖药品有效期;
3.2 每种规格、每个生产批量药品的考察批次数;
3.3 制定考察项目、检验方法依据及合格标准;
3.4 容器密封系统的描述;
3.5 考察周期及检验频次;
3.6 贮存条件(采用与药品标示贮存条件相对应的《中华人民共和国药药典》规定的长期稳定性试验标准条件)。
4 稳定性考察留样原则及批次数量:
4.1 产品批准上市后首次生产的前三批验证产品,对不同包装材料及包装规格的销售产品均要分别留样进行长期稳定性考察。
4.2 生产第二年起各年的产品,对生产的每种规格、每种内包装形式的药品,至少每年应当留取一批进行持续稳定性考察。
4.3 有重大变更或生产和包装有重大偏差的药品应当列入稳定性考察。改变原辅料、与药品直接接触的包装材料变更、生产工艺、主要生产设备及其他影响药品质量的主要因素变更时,应当对变更实施后生产的药品留样三批进行加速试验和长期稳定性试验。
4.4 重新加工、返工或回收的批次,也应当留样进行加速试验和长期稳定性试验。
4.5 考察样品留样数量:按照取样频次、考察项目、考察期内所需的全检量。
4.6 为监控公司产品在有效期内质量所进行的持续稳定性考察批次,常规产品每年抽取1-3批。即每年生产量少于10批考察1批,产量10-25批的,考察2批,产量超过25批的考察3批。除当年没有生产外。
5 产品稳定性考察试验计划:
5.1 根据每年的生产情况,按要求填写每个品种 “稳定性试验计划”,按照计划进行稳定性试验管理。
5.2 产品稳定性考察试验计划内容包括:产品名称、批号、规格、生产日期、有效期至、取样日期、考察目的、考察周期等。
5.3 样品提取要求:
5.3.1 样品必须按照稳定性试验计划从药品稳定性试验箱和其他储存条件下按时取出,样品取样时间偏差范围:
加速试验条件:样品一般按计划取样时间取出检验。
有效期月试验点的样品:必须按计划取样时间取出检验。
长期稳定性试验及持续稳定考察试验:第三个月的试验点后的取样,可以早于或晚于2周的计划时间。
5.3.2 任何附加于计划外的试验间隔点取样,必须经由质量授权人签字批准,并登记在册,必须保证有足够的样品用于余下的稳定性考察。
5.3.3 从药品稳定性试验箱取出的稳定性试验样品应存放于适宜的贮存条件等待检验,检验应及时记录,样品应作标记,并作取样记录。
6 留样样品储存条件:
6.1 加速试验:
在温度40℃±2℃ ,相对湿度75%±5%的条件下放置6个月;对温度特别敏感的药物制剂(4℃-8℃内保存使用),在温度25℃±2℃ ,相对湿度60%±10%的条件下放置6个月;混悬剂在温度30℃±2℃ ,相对湿度65%±5%的条件下放置6个月。
6.2 长期稳定性考察试验:
在温度25℃±2℃ ,相对湿度60%±10%的条件下放置12个月,或在温度30℃±2℃ ,相对湿度65%±5%的条件下放置12个月;对温度特别敏感的药品在温度6℃±2℃的条件下放置12个月。
6.3 持续稳定考察试验:
采用与药品标示贮存条件相对应的《中华人民共和国药》规定的上述长期稳定性考察试验的标准条件放置至有效期后一年(照6.2项下长期稳定性考察试验储存条件)。
7 考察周期及检验频次:
7.1 按下列试验项目取样,除微生物限度检查为每年一次直至有效期,其他照重点考察项目进行检测。
7.2 加速试验:
共考察6个月,于第1个月、第2个月、第3个月、第6个月末分别取样一次进行检测。
7.3 长期稳定性考察试验:
前12个月,每3个月取样一次,之后于第18个月、第24个月、第36个月分别取样进行检测,将结果与0个月比较以确定有效期。
7.4 持续稳定考察试验:
批准上市后首次生产产品留样的样品,前12个月,每3个月取样一次,之后于第18个月、第24个月、第36个月直至有效期后一年,分别取样进行检测。
8 重点考察项目:
性状、含量、有关物质、崩解时限或溶出度等。
9 检验方法依据及合格标准:
各项目的检验方法按照各品种成品质量标准及检验操作规程进行。
判断标准为各品种成品内控质量标准。
10 稳定性考察结果报告:
10.1 产品在考察过程中及时统计每次考察结果,与0个月的结果进行比较,每年对考察期内的品种考察结果统计一次,定期阶段性总结报告。
10.2 每个品种根据所获得的全部数据资料,撰写总结报告,上报质量部或质量授权人,及时了解持续稳定性考察的结果,经质量授权人批准后将所有考察记录及总结报告共同存档。
10.3 在药品稳定性考察过程中,考察结果及任何不良趋势应及时上报质量部或质量授权人。
10.4 报告内容:
考察试验目的:加速试验、长期试验、持续稳定性试验;
产品信息:产品名称、剂型、批号、规格、包装形式、有效期;
样品储存条件:温度、相对湿度;
实验开始时间、考察周期;
检验项目、执行质量标准、限度要求;
各考察周期的分析数据的统计(产品质量稳定性考察汇总表);
适当的趋势分析和统计分析;
试验结果分析及结论。
11 年度趋势分析与评估:
11.1 在年度产品回顾的报告中,回顾期限内稳定性考察的结果及任何不良趋势全面统计和评估。至有效期的数据全面确认复验期或有效期,储存、包装条件的合理性。
11.2 药品的有效期应综合加速试验和长期试验的结果,进行适当的统计分析得到,最终有效期的确定一般以长期试验的结果来确定。
11.3 有效的稳定性数据和趋势分析指导企业确定药品正确的有效期、包装材料、运输/贮存条件等,并确保在市产品处于有效的质量保证状态。
12 设备要求:
用于稳定性试验样品贮存的设备(药物稳定性试验箱)应按要求进行确认,校正及定期维护,保证处于稳定的状态。温度/湿度布点测定应建议与设备确认/再确认同步进行。 监控检查正确记录温度和湿度。相关人员须接受适当培训。
13 当持续稳定性考察不在待包装产品和成品生产企业进行时,则相关各方之间应有书面协议。生产企业应保存持续稳定性考察的结果以供药品监督管理部门审查。
14 应当对不符合质量标准的结果或重要的异常趋势进行调查。对任何已确认的不符合质量标准的结果或重大不良趋势,应当考虑是否可能对已上市药品造成影响,必要时应当实施召回,调查结果以及采取的措施应当报告当地药品监督管理部门。
附 件:1 公司产品稳定性考察留样数量表(SMP09-116-01)
2 产品稳定性重点考察项目表(SMP09-116-02)
3 产品稳定性考察记录(SMP09-116-03)
4 稳定性考察试验样品取样记录(SMP09-116-04)
5 稳定性考察方案(SMP09-116-05)
6 加速试验记录(SMP09-116-06)
7 稳定性考察报告(SMP09-116-07)
8 ( 年)产品质量稳定性考察汇总表(SMP09-116-07)
变更历史:

第二篇:058稳定性考察管理制度


康美(北京)药业有限公司
稳定性考察报告
编号:ZL·SOR-078-0

报告人: 复核人
康美(北京)药业有限公司
稳定性考察报告
编号:ZL·SOR-078-0
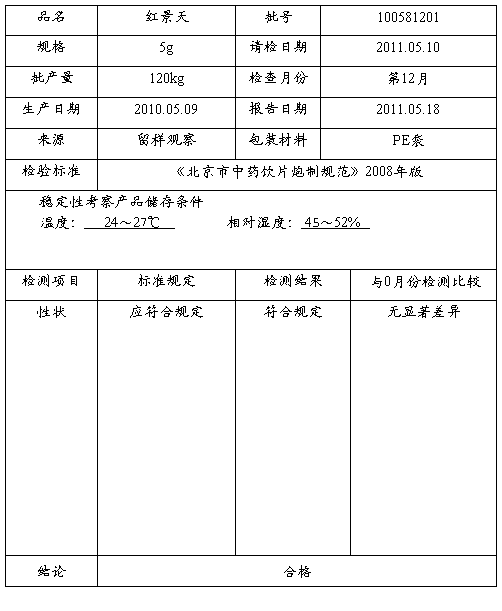
报告人: 复核人
