有机合成实验报告
所在专业:
学号/姓名:
指导老师:
实验地点:
合肥工业大学有机合成实验规则
为了保证化学实验的顺利进行,学生做实验时必须遵守下列规则:
一、 认真预习。实验前要认真预习实验内容,复习教材中的有关章节,明确实验目的和要求,弄清原理和操作步骤,了解实验的关键及注意事项,订出实验计划并初步预测实验结果,做到心中有数。动手做实验前还应检查实验用品是否齐全,装置是否正确稳妥。
二、 规范操作。实验时要听从老师指导,尊重实验室工作人员的工作,规范操作,仔细观察。要积极独立思考,及时、如实地记录观察到的现象并做出科学的解释。如遇实验结果和理论不符,应分析原因或重做实验,得出正确结论,努力提高分析、推理和联想的思维能力。
三、 注意安全。学生进实验室要穿实验服,严格遵守安全守则,弄清水、电、煤气开关、通风设备、灭火器材、救护用品的配备情况和安放地点,并能正确使用。使用易燃易爆剧毒药品,要特别提高警惕,千万不能麻痹大意。更改实验步骤或试剂用量,须征得指导老师同意。如遇意外事故,应立即报告老师采取适当措施,妥善处理。
四、 保持整洁。要保持实验室的安静、整洁,不得在实验室谈笑或高声喧哗,不得在实验室内、外闲游。仪器、药品应摆得井然有序,使用仪器器材或取用药品后,要立即恢复原状,送还原处。装置要求规范、美观;废酸、废碱应倒人废液缸,严禁倒入水槽;废纸、火柴便、碎玻璃等固体废物应丢人废物箱,不得扔在地上或丢入水槽。实验完毕,要将仪器洗净,放入柜内,擦净实验台和试剂架并关闭水、电、煤气开关。值日生应切实负责整理公用器材,打扫实验室,倒净废液缸。离开实验室前,应检查水、电、煤气的开关,关好窗户。
五、 厉行节约,爱护实验室各种仪器和设备,节约药品和其它易耗品,节约水、电。煤气。不得将仪器和药品携出室外它用。损坏仪器要填写仪器破损单,经指导老师签署意见后,凭原物向管理室换取新仪器。
六、 写好报告。实验课后应按实验记录和数据独立完成实验报告,不得拼凑或抄袭他人数据。书写实验报告要求条理清楚,结论明确,字迹端正,绘图规范并按时交指导老师批改。
实验一 乙酸丁酯的制备
一、实验目的
1. 掌握有机酸酯的制备原理和乙酸丁酯的制备方法。
2. 学习用恒沸混合物除去酯化产物中水的方法。
二、实验原理
1. 主要性质和用途
乙酸丁酯(butyl acetate)亦称乙酸正丁酯,无色液体,具有水果香味,微溶于水,能溶于乙醇、乙醚和烃类。密度0.8826(20℃),沸点126.3℃,凝固点-77℃,折光率1.3591(20℃)。
乙酸丁酯是良好的有机溶剂,可用于火棉胶、清漆、人造革、医药、塑料及香料工业,并可用作萃取剂和脱水剂。
2. 制备原理
有机酸酯通常用醇和羧酸在少量催化剂(如浓硫酸)的存在下,通过酯化反应制得:
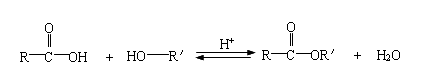
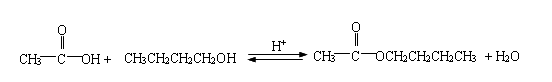
酯化反应是一个典型的酸催化可逆反应。为使反应平衡向右移动,可用过量的醇或羧酸,也可将反应中生成的酯或水及时蒸出。实验中要注意控制反应的温度、原料滴加的速度和产品蒸出速度,从而使反应进行得比较完全。在制备乙酸丁酯时,采用等摩尔的乙酸和丁醇,加入极少量的浓硫酸作催化剂,进行回流。让回流冷凝液先进入一个分水器分层,水分留在分水器中,有机液不断地流回反应器中。这样,在酯化反应进行时,生成的水可以从平衡混合物中除去,使反应几乎可进行到底,得到高产率的乙酸丁酯。反应方程式如下:
三、实验仪器和药品
电热套、三口烧瓶(250ml)、球形冷凝管、直形冷凝管、接引管、分液漏斗(125ml)、
锥形瓶(50ml、100ml)、蒸馏烧瓶(50ml)、量筒(10ml、100ml) 温度计(0℃-200℃)。正丁醇、冰醋酸、浓硫酸、碳酸钠溶液(10%)、无水硫酸镁、pH试纸。
四、实验内容
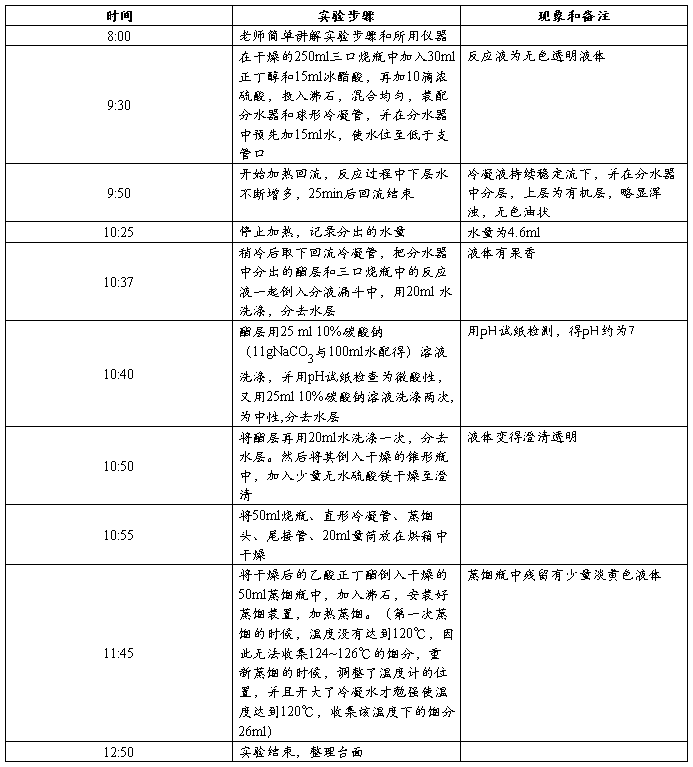
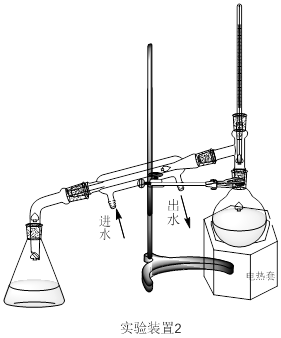
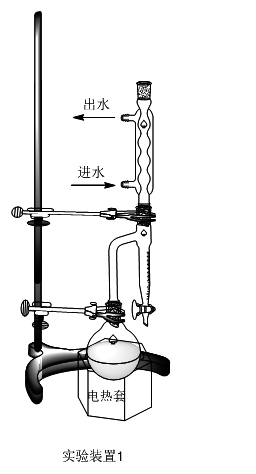
五、实验装置
六、数据处理与结果分析
数据处理:理论生成的乙酸正丁酯的量为0.263mol(与水的mol数相同,思考题中已经计算),又相对密度d(2020)为0.8826;
所以产量为:0.8826×26=22.95g
理论产量为:0.263×116=30.51g ,
产率为22.95/30.51=75.2%
结果分析:反应的产率不高,原因分析如下
(1) 反应时温度升高过快,升得过高,使得冰醋酸蒸出,与水互溶,不能回流,反应不完全;
(2) 反应时间较短。
七、注意事项
1. 浓硫酸在反应中起催化剂作用,只需加少量。
2. 本实验利用恒沸混合物除去酯化反应中生成的水。正丁醇、乙酸正丁酯和水可能形成下
表中的几种恒沸混合物:
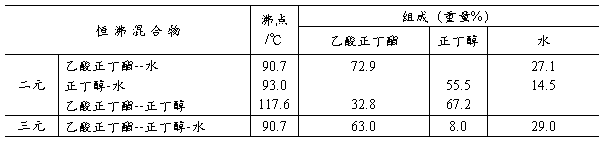
含水的恒沸混合物冷凝为液体时,分为两层,上层为含少量水的酯和醇,下层主要是水。
3. 根据分出的总水量(注意扣去预先加到分水器中的水量),可以粗略地估计酯化反应完成的程度。
八、思考题
1. 本实验是根据什么原理来提高乙酸正丁酯的产率的?
答:不断分离生成的水,使反应尽可能的向右进行。
2. 计算反应完成时应分出的水量?
答:正丁醇的物性参数:质量百分含量99.5%,密度0.808~0.811g/cm3
冰醋酸物性参数:质量百分含量99.5%,密度1.05 g/cm3
n(正丁醇)=0.810×30/74=0.34mol
n(冰醋酸)=1.05×15/60=0.263mol
所以,正丁醇过量,反应生成的水量为0.263×18=4.734g
3. 反应中生产的水是怎么分去的?
答:水密度比乙酸正丁酯的小,与乙酸正丁酯生成恒沸不互溶的溶液而分层,下层为水,通过分水器的下口即可分去。
实验二 间硝基苯胺的制备
一、实验目的
1. 学习多硝基化合物部分还原反应的原理。
2. 掌握间硝基苯胺的制备方法。
二、实验原理
1. 主要性质和用途
间硝基苯胺(meta-nitroaniline)为黄色针状晶体或粉末。微溶于水,溶于乙醇、乙醚、甲醇。熔点111.8℃,密度1.430(20℃)。
家硝基苯胺主要用作有机合成中间体,可用于制取冰染染料橙色基R和制取色酚AS-BS。
2. 制备原理
本实验利用间硝基苯还原法制备见硝基苯胺。多硝基化合物中硝基的部分还原,常采用Na2S2作还原剂(因为它的还原作用比较缓和)。用Na2S2是通过S2-2离子攻击硝基上的氮原子而实现的。由于S2-2离子的水合程度较低。被氧化后的电子构型比较稳定,因此它的还原能力比S2-离子强。
苯环上带有吸电子基团有利于硝基的还原;带有给电子基团,则阻碍反应进行。所以间硝基苯胺进一步还原,要比间二硝基苯还原难得多。需使用更强的还原剂才能使其还原。
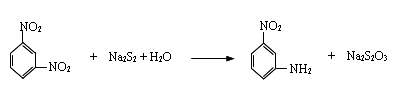
用过硫化钠作还原剂,还原间二硝基苯的反应方程式如下:
三、主要仪器和药品
三口烧瓶(250ml)\电动搅拌器、温度计(0℃~100℃)、球形冷凝管、滴液漏斗(60ml)、烧杯(250ml、500ml)、锥形瓶(250ml)、电热套、玻璃漏斗(¤90)、滴管、托盘天平。
间二硝基苯、硫化钠、硫磺粉、盐酸、氨水、PH试纸、硫酸铜试纸。
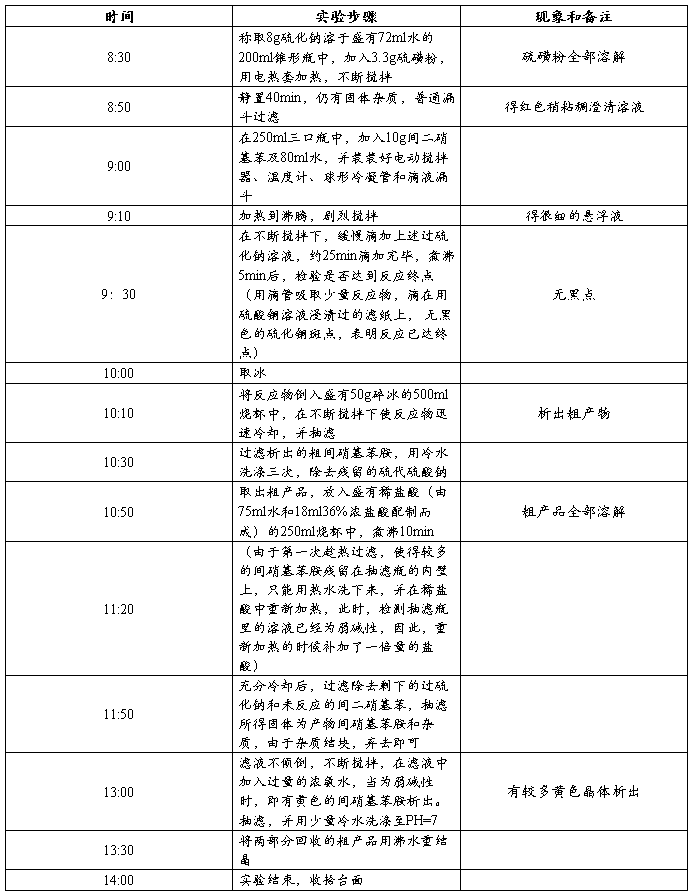
四、实验内容
五、实验装置
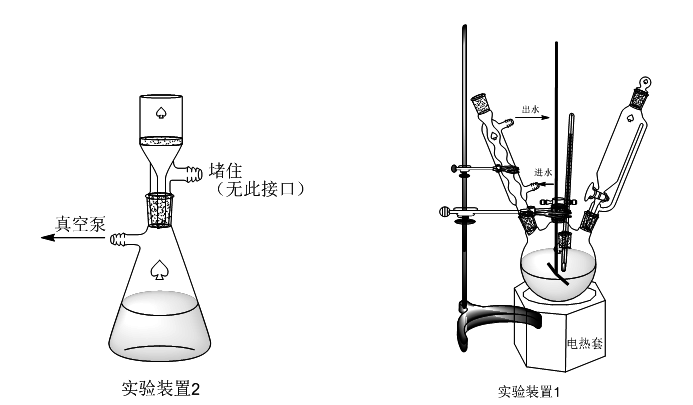
六、数据处理与结果分析
数据处理:n(间二硝基苯)=10g/168g·mol-1=0.060mol
n(硫化钠)=8g/110g·mol-1=0.073mol
n(硫磺粉)=3.3g/32g·mol=0.10mol,所以间二硝基苯少量的;
间硝基苯胺的理论产量=0.060mol×138g/mol=8.28g
产率=0.7g/8.3g=8.45%
结果分析:产率偏低,原因分析如下
(1) 硫磺粉溶解不充分,有少量固体杂质;
(2) 反应不完全(反应煮沸只进行了5分钟,但是硫酸铜试纸检测确实没有黑色);
(3) 精制的时候,由于第一次趁热过滤,使得抽滤瓶和烧杯上损失了大量的产品;
七、注意事项
间二硝基苯和间硝基苯胺有毒,须小心操作,勿接触皮肤。
八、思考题
1. 间二硝基苯制取间硝基苯胺能否采用铁粉和盐酸反应制得的初生态氢进行还原?
答:不能,还原性很强,第一步反应生成间硝基苯胺,随后会进一步将另一个硝基还原。
2. 产品中的主要杂质是什么?如何去除?
答:硫代硫酸钠,过硫化钠和间二硝基苯。
硫代硫酸钠冷水即可洗去,过硫化钠可与盐酸反应生成硫化氢气体逸出,并生成固体单质硫,同时间硝基苯胺与盐酸反应生成铵盐而溶解,间二硝基苯不溶过滤即可与上述杂质分离。
3. 为什么用稀盐酸溶解粗产品?用水可以吗?
答:Na2S2 + 2HCl =2NaCl + H2S↑ + S↓ 稀盐酸溶解可除去过硫化钠,并溶解间硝基苯胺,换做水后,过硫化钠和间硝基苯胺均溶于水,不能实现分离。
4. 制备间硝基苯胺的还原剂还有哪些?
答:Na2S2、NaHS等
实验三 抗氧剂双酚A的合成
一、实验目的
1. 掌握抗氧剂双酚A的合成原理和合成方法。
2. 熟悉重结晶的操作方法。
二、合成原理
1. 主要性质和用途
 双酚A又称二酚基丙烷,化学名称为2,2′-二对羟基苯基丙烷(2,2′—bis(p-hydro xyphenyl)propane,结构式:
双酚A又称二酚基丙烷,化学名称为2,2′-二对羟基苯基丙烷(2,2′—bis(p-hydro xyphenyl)propane,结构式:
本品为无色结晶粉末,熔点155~158℃,密度1.95(20℃)。溶于甲醇、乙醇、异丙醇、丁醇、乙酸、丙酮及二乙醚,微溶于水,易被硝化、卤化、硫化、烃化等。
抗氧剂双酚A可作为塑料和油漆用抗氧剂,是聚氯乙烯的热稳定剂,也是聚碳酸酯、环氧树脂、聚砜、聚苯醚等树脂的合成原料。
2. 合成原理
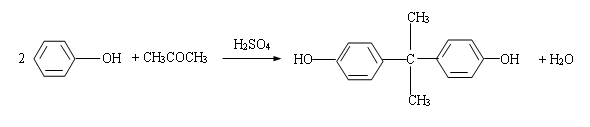 双酚A的合成方法有多种没,大都由苯酚与丙酮合成,不同之处是采用的催化剂有别。本试验采用的是硫酸法,即苯酚与过量的丙酮在硫酸的催化下缩合脱水,生成双酚A。其反应式为:
双酚A的合成方法有多种没,大都由苯酚与丙酮合成,不同之处是采用的催化剂有别。本试验采用的是硫酸法,即苯酚与过量的丙酮在硫酸的催化下缩合脱水,生成双酚A。其反应式为:
三、实验仪器和药品
分液漏斗(500ml)、布氏漏斗(φ8)、吸滤瓶(500ml)、电动搅拌器、水浴锅、电热干燥箱、 三口烧瓶(250ml)、球形冷凝管、 温度计(0℃~100℃)、烧杯(500ml)、量筒(100ml)、滴液漏斗(60ml)、托盘天平。
苯酚、丙酮、甲苯、硫酸(98%)、二甲苯、巯基乙酸。
四、实验内容
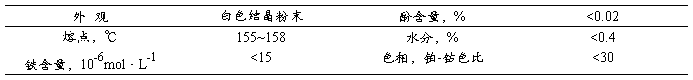
产品质量标准如下表所示:
五、实验装置
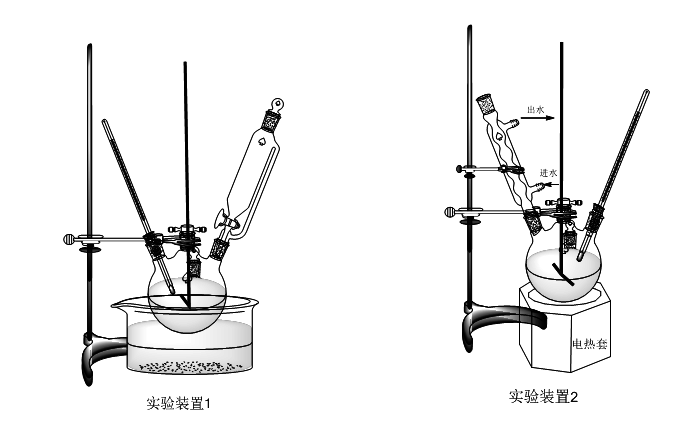
六、数据处理及结果分析
数据处理:n(苯酚)=30g/94g·mol-1=0.32mol
n(丙酮)=10g/58g·mol-1=0.17mol
反应按2:1进行,因此丙酮稍过量,间硝基苯胺的理论产量:238g·mol-1×0.32mol/2= 38g
产率为:8g/38g=21.05%
结果分析:产率偏低,粗产品为22.5g,精制后仅为8g,原因如下
(1) 搅拌、控温不当,反应不充分;
(2) 热水第一次洗涤时,下层呈乳白色浑浊,产物有少量损失;
(3) 精制时,未溶解完全;
(4) 微溶于水,趁热萃取时,有少量溶于下层水中被分离出来;
(5) 结晶不完全。
七、注意事项
洗涤反应液时切勿剧烈振荡,否则反应液发生乳化现象。
八、思考题
1. 滴加丙酮时为什么控制温度?
答:因为丙酮的沸点为56℃,需要控制在该温度以下。
2. 水洗时水温的控制依据是什么?
答:双酚A的析出温度以上。
实验四 食品防腐剂山梨酸钾的制备
一、实验目的
1. 学习山梨酸钾的性质和用途。
2. 掌握山梨酸钾制备的原理和方法。
二、实验原理
1.主要性质和用途
山梨酸钾(potassium sorbate)学名已二烯-(2, 4)-酸钾,结构式CH3CH==CHCH==CHCOOK,分子式H6H7KO2,是一种不饱和的单羧基脂肪酸,呈无色或白色鳞片状结晶或粉末。在空气中不稳定,能被氧化着色,有吸湿性,约270℃熔化分解。易溶于水,溶于乙醇。
用做食品防腐剂,用于肉、鱼、蛋、禽类制品,果蔬类保鲜,饮料、果冻、软糖、糕点类。我国规定最大使用量为0.5~2g·kg-1。
2.制备原理
山梨酸的合成工艺路线有四种:
(1)以丁烯醛(巴豆醛)和乙烯酮为原料
 CH3CH==CHCHO + CH2==C==O CH3CH==CHCH==CHCOOH
CH3CH==CHCHO + CH2==C==O CH3CH==CHCH==CHCOOH
 (2)以巴豆醛和丙二酸为原料
(2)以巴豆醛和丙二酸为原料
 CH3CH==CHCHO + CH2(COOH)2 CH3CH==CHCH==CHCOOH
CH3CH==CHCHO + CH2(COOH)2 CH3CH==CHCH==CHCOOH

 (3)以巴豆醛和丙酮为原料
(3)以巴豆醛和丙酮为原料



 CH
3CH==CHCHO +
CH
3CH==CHCHO +
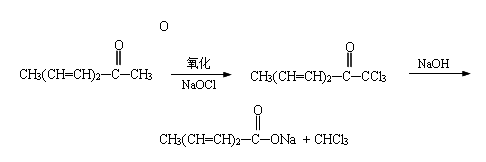
 (4)以山梨醛为原料
(4)以山梨醛为原料
实验室采用路线(2),制得的山梨酸再与氢氧化钾反应,制得山梨酸钾

三、主要仪器和药品
四口烧瓶(250ml)、烧杯(200ml、500ml)球形冷凝管、抽滤瓶(500ml)、温度计(0~100℃)、量筒(10ml、100ml) 、电动搅拌机、真空泵。
巴豆醛(化学纯)、丙二酸(化学纯)、吡啶(化学纯)、硫酸(化学纯)、乙醇(化学纯)、氢氧化钾(化学纯)、精密pH试纸、滤纸等。
四、实验内容
五、实验装置
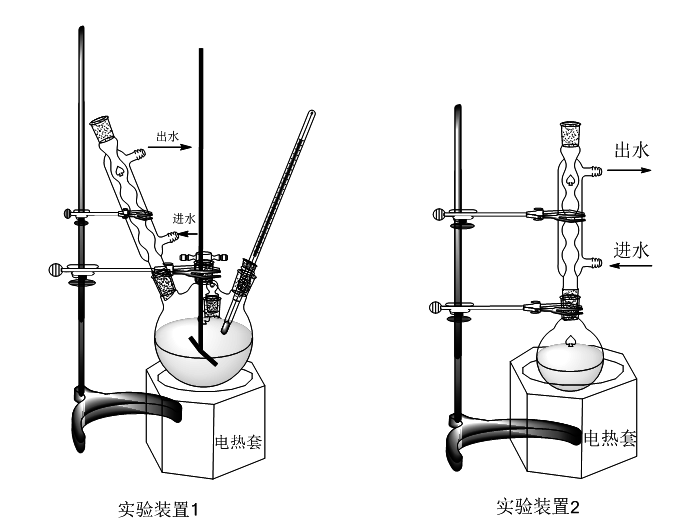
六、数据处理与结果分析
数据处理:反应生成了0.8g的山梨酸钾,计算得反应中丙二酸过量,因此按照巴豆醛的摩尔数代入进行计算:n=5g/72g·mol-1=0.0694mol
山梨酸钾的理论产量为:n×150g·mol-1=0.0694×150=10.42g
产率为:0.8g/10.42g=7.68%
结果分析:产率较低,原因如下
(1) 点板检测结果表明,反应并未完全,仍有巴豆醛存在;
(2) 山梨酸钾易溶于水,因此在用冷水冲洗时会有一定损失;
(3) 山梨酸易溶于乙醇,两次乙醇重结晶,使得损失较大;
(4) 冷却过程较难保证长时间在5℃以下,因此析晶不完全。
七、注意事项
1. 用稀硫酸调pH值时注意控温。
2. 山梨酸精品结晶时一定要控制温度在0~5℃。
八、思考题
1. 制备山梨酸精品时,加入吡啶的目的是什么?
答:吡啶为碱,作为缚酸剂,与反应生成的山梨酸结合,使得反应不断向右进行。
2. 制备山梨酸精品时,产物为什么要调pH值?产物为什么要冷冻过夜?
答:在酸性条件下,释放出与吡啶结合的山梨酸;产物冷冻过夜是为了使山梨酸更好的析出晶体。
第二篇:合工大有机合成作业2
标题:Kinetic Studies of the Ni-catalyzed Cross-coupling of Alkyl Halides and a Tosylate with Butyl Grignard Reagent in the Presence of 1,3-Butadiene 作者: Iwasaki, T (Iwasaki, Takanori ; Tsumura, A (Tsumura, Asako); Omori, T (Omori, Takehiro); Kuniyasu, H (Kuniyasu, Hitoshi); Terao, J (Terao, Jun); Kambe, N (Kambe, Nobuaki)
来源出版物: CHEMISTRY LETTERS 卷: 40 期: 9 页: 1024-1026 DOI: 10.1246/cl.2011.1024 出版年: SEP 5 2011
翻译标题:存在1,3 -丁二烯时,Ni催化伴有丁基格氏试剂的烷基卤化物和甲苯磺酸盐的交叉耦合反应的动力学研究
Abstracts:
Kinetic studies of the nickel-catalyzed cross-coupling reaction of alkyl bromides, iodides, and tosylates with butyl Grignard reagents in the presence of butadiene were performed. The reaction rate was first order with respect to the halides and the nickel catalyst. The butyl Grignard reagent, at concentrations of ca. 0.4 M or higher, had little effect on the reaction rate. The relative reactivities and activation parameters were determined for these alkyl halides and a tosylate.
翻译摘要:镍催化的烷基溴化物,碘化物和甲苯磺酸酯的交叉偶联反应的动力学研究,并伴有丁基格氏试剂在丁二烯的存在下。反应是卤化物和镍催化剂的一级反应。丁基格氏试剂,在约0.4mol/l或更高的浓度时,对反应速率的影响不大。相关的反应性和活性参数由这些卤代烷和甲苯磺酸盐确定。
文章总结:In conclusion, it was revealed that Ni-catalyzed alkyl-alkyl
cross-coupling using 1,3-butadiene obeys first-order kinetics for the alkyl halide and the Ni catalyst but the concentration of the Grignard reagents exerts little effect on the rate at concentrations higher than ca. 0.4M. The reaction rates of an alkyl tosylate, bromide, and iodide at different temperatures were measured and activation parameters for these compounds were obtained.
翻译:总之,结果表明,Ni催化烷基交叉耦合用1,3-丁二烯服从一级反应动力学的烷基卤化物和镍催化剂,但在浓度高于约0.4mol/l时,格氏试剂的浓度对速率的影响不大。甲苯磺酸烷基酯,溴化物碘化物的反应速率,可在不同的温度下测定得到这些化合物的活化参数。
全文总结:本文通过对改变格式试剂的浓度研究了格式试剂浓度对反应的影响,通过确定的反应组成改变温度探究温度对反应活性参数的影响,通过确定温度,改变某一反应物的基团,探究该基团对这个反应物活性的影响以及对整个反应的影响。
