工艺验证报告
鞍山九天制药有限公司 1
1、概述
碘酊的工艺验证是在厂房、设备、公用设施的验证合格后,按既定的验证方案,
在连续生产的三批碘酊产品中进行。现将验证工作情况作以下报告。
2、验证结果
2.0生产场所的洁净级别,温、湿度符合有关要求。见附件1
2.1收料
2.1.1目的:确认该过程不影响原辅料的质量。
2.1.2环境检查:
(1)生产场所的洁净级别,温、湿度符合要求。
(2)设备及场所具有清场合格证。
2.1.3结论:经考察记录文件齐全,符合规定,不影响药品质量。见附件2。
2.2 称量、配料工序
2.2.1 目的:该过程能够保证物料的品种、数量符合要求。
2.2.2 环境检查:
(1)生产场所的洁净级别,温、湿度符合要求。
(2)设备及场所具有清场合格证。
2.2.3 结论:经验证该过程能保证物料种类、数量准确无误。见附件3。
2.3 配制工序
2.3.1 目的:确认物料溶解混合过程含量均匀、澄清度、微生物限度能够符合标准规定。
2.3.2 环境检查:
(1)生产场所的洁净级别,温、湿度符合要求。
(2)设备及场所具有清场合格证。
2.3.3 结论:溶液澄明,含量均符合规定,按该规程操作,能够保证产品质量。见附件4。
2.4 灌装工序
2.4.1 目的:确认该过程能够获得符合内控质量标准的产品。
2.4.2 环境检查:
(1)生产场所的洁净级别,温、湿度符合要求。
(2)设备及场所具有清场合格证。
2.4.3 结论:真空度-0.08MPa能得到装量合格产品。见附件5。
2.5 封口工序
2.5.1 目的:按封口机标准操作规程操作,确保封口能够符合质量要求。
2.5.2 环境检查:
2
(1)生产场所的洁净级别,温、湿度符合要求。
(2)设备及场所具有清场合格证。
2.5.3 结论:经验证按所制定的SOP操作,封口严密、无渗漏,无焦头,微生物限度检查符合质量标准规定。见附件6。
3、物料平衡:见附件7
结论:经确认物料平衡在规定限度之内。
4、验证结论、最终评价和建议
验证过程中各项操作均按标准规程进行,生产场所的洁净级别,温、湿度均符合要求。 通过碘酊生产工艺的验证,可确定在正常条件下,本工艺能够生产出符合质量标准要求的产品。
由于物料、设备、工艺条件参数等变更时,须对生产工艺进行再验证,正常情况下,工艺验证周期为2年。
总结人: 日期:
3
第二篇:非常好的片剂工艺验证方案及报告
XXXXX工艺验证方案
YZS-G-1XX037
类别:验证管理 工艺验证方案
制定人: 制定日期: 年 月 日
审核人: 审核日期: 年 月 日
批准人: 批准日期: 年 月 日
颁发部门: 生效日期: 年 月 日
复印数: 份
目 录
1.概述
2.目的
3.产品简介
4.验证内容、方法及标准
4.1粉碎过筛
4.2配料混合
4.3压片
4.4包装
4.5成品质量
4.6各工序收率及物量平衡
5验证结果评定与结论
6.稳定性考察
7.相关文件
8.图一
9.相关记录
1.主题内容
本方案规定了XXXXX生产工艺验证的目的,步骤、标准及评价内容
2.适用范围
本方案适用于XXXXX生产工艺的验证
3.责任人
3.1工艺验证小组
组长:
组员:
3.2其他相关人员
4.验证的内容
4.1概述
XXXXX是我公司的主要产品,在以往的生产过程中,此产品生产工艺是稳定可靠的,但是为符合GMP要求,我公司新建了厂房,引进了先进的设备,因此在该产品正式投入生产前进行工艺验证,进行工艺验证的前提条件是:
1.厂房、设施、设备已经过验证并验证合格可投入使用。
2.相应的文件已批准执行。
3.物料通过供应商审计并审计合格。
4.人员已进行全面健康检查和系统培训且已有健康证和培训上岗证。
本验证方案拟在XXXXX试生产时实施
4.2目的:
本产品工艺验证方案的目的在于通过对XXXXX生产工艺的验证,证明该生产工艺可靠性和稳定性
4.3产品简介:
4.3.1处方:原辅料名称 万片的用量
4.3.2工艺流程图(见图一)
4.3.3生产、质、量管理文件
批生产指令及记录 XXXXX批生产指令及记录
生产工艺规程 XXXXX批生产工艺规程
质量标准 XXXXX质量标准及主要物料质量标准
4.3.4主要物料

4.3.5主要生产设备

4.3.6日常生产监控
粉碎、过筛、配料、总混、压片、泡罩包装、包装
4.4验证内容,方法及标准
4.4.1粉碎过筛,确认本过程工艺参数设计的合理性及准确性,同时考核工序收率及物料平衡
4.4.1.1评价方法
按粉碎过筛SOP进行操作,对粉碎过筛后的药粉取三个进行粘度检查。
4.4.1.2接受标准
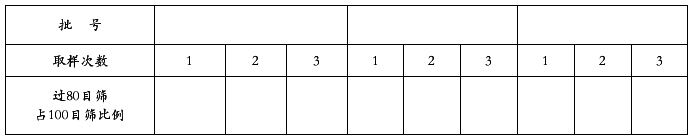
药粉全部过5号筛(80目)且过6号筛(100目)的细粉>95%,粉碎过筛收率为98.0%、-100%,粉碎,过筛物料平衡率为99.0—100%。
4.4.1.3结果记录 记录(见表01)
4.4.2.1配料,总混
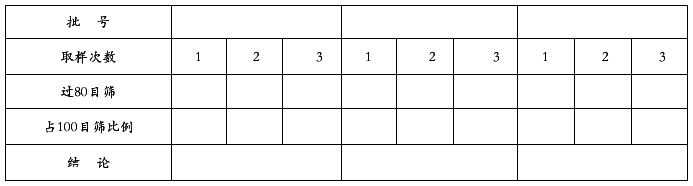
确认本过程,工艺参数设计的合理性及准确性,确保物料混合的均一性,同时考核总混收率及物料平衡。
4.4.2.2接受标准,总混收率为98.0—100%,总混物料平衡率为99.0—100.0%
4.4.2.3压片
确认本过程工艺参数设计合理性及准确性,同时考核该工序收率及物料平衡
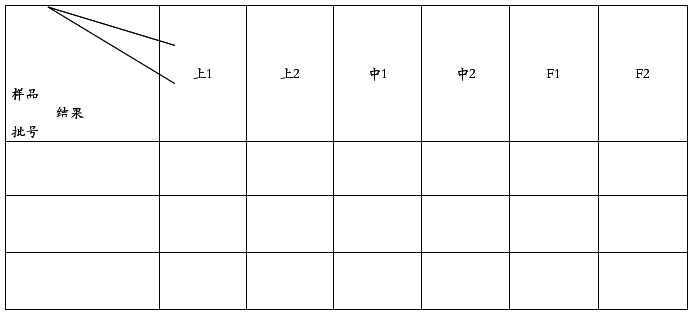
4.4.3.1评价方法 按压片岗位操作片重稳定后取样检查崩解度,然后每20分钟取样一次至60分钟,然后每60分钟取样一次,直至生产结束,检查所取片剂的外观,片重差异,同时考核该工序收率及物料平衡。
4.4.3.2按受标准 外观光洁,色泽均一,硬度适宜
重量差异≤±%,压片收率为95.0—100.0%压片工序物料平衡率为96.0—100.0%。
4.4.3.3结果记录 记录(见表03)
4.4.4泡罩包装
确认本过程工艺条件设计的合理性与准确性,同时考核该工序的收率及包装材料平衡。
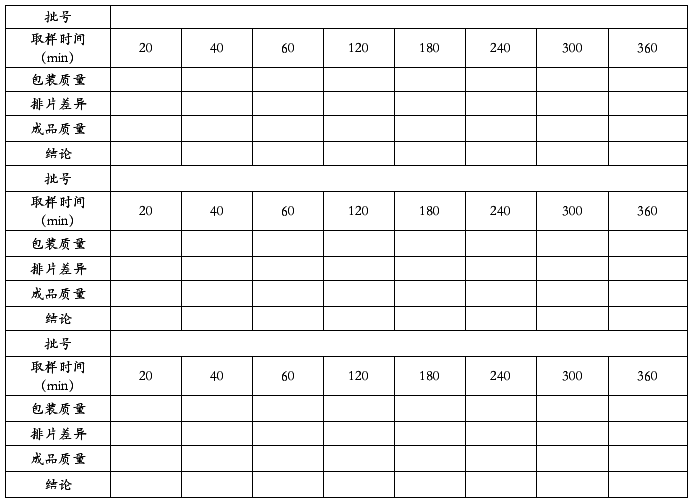
评价方法:按铝塑包装岗位标准操作规程进行操作,开始设定再20分钟进行一次检查,一直到360分钟,每次取样10板,检查压板质量。接受标准,外观检查:铝塑热封紧密,批号清晰,准确,文字正确,装量误差≤0.1%,包装收率为95.0—100.0%包装工序物料平衡为98.0—100.0%。
结果记录(见表04)
4.4.6成品质量
4.4.6.1评价方法
在每批产品生产结束后,按取样标准操作程序取样进行全检。
4.4.6.2接受标准 应符合XXXXX质量标准
4.4.6.3结果评价(见表04)
4.4.7各工序收率及物料平衡(见表05)
4.5验证结果评定与结论
4.5.1验证管理员负责收集各项验证,试验结果记录,起草验证报告,报验证领导小组
4.5.2验证领导小组,对验证结果进行综合评审,做出验证结论,颁发验证证书,确认XXXXX工艺验证周期,对验证结果的评审包括:
4.5.2.1验证试验是否有遗漏
4.5.2.2验证实施过程中,对验证方案有无修改,修改原因,依据以及是否经过批准。
4.5.2.3验证记录是否完整
4.5.2.4验证试验结果是否符合标准要求,偏差及对偏差的说明是否合理,是否需要进一步补充试验。
4.6稳定性考察
为确定性工艺系统稳定性按中国药典2000版二部附录XIXXC药物稳定性试验指导原则,对三批产品进行稳定性考察。
1、相关文件: 文件编码
《总混岗位SOP》 SO-S-1X
《压片岗位SOP》
《铝塑包装岗位SOP》
《外包装岗位SOP》
《工艺验证管理规程》
《XXXXX检验操作规程》
表01粉碎过筛质量检验结果记录
结论 记录人: 日期 审核人: 日期
表02 总混后药粉的均一性检查记录
表04包装质量及成品质量检查记录
记录人: 日期: 审核: 日期:
附表02
验证方案修改申请书及批准书
文件编码:

表03

XXXXX工艺验证报告
YZS-G-1XX037
制定人: 制定日期 年 月 日
审核人: 审核日期 年 月 日
批准人 批准日期 年 月 日
颁发部门 生效日期 年 月 日
复印数: 份
分发部门
1.概述
为证明XXXXX剂生产工艺及生产系统是否稳定,可靠,我们对片剂生产工艺进行了三批验证,验证结果表明片剂现生产系统及生产工艺能保证产品质量,是稳定可靠的
2.验证结果
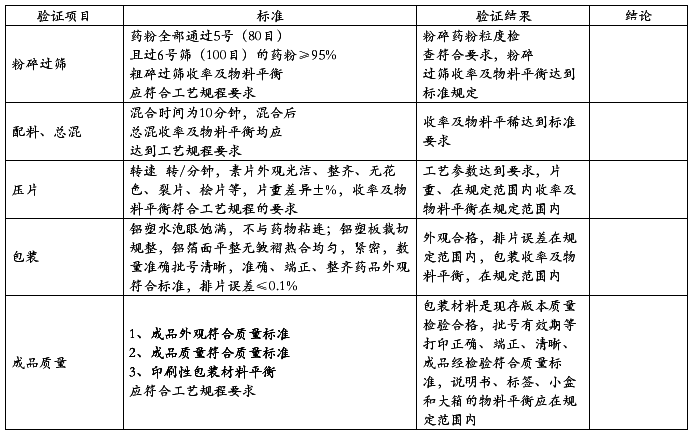

表01粉碎过筛质量检验结果记录
记录人: 日期 审核人: 日期
表02总混后药粉的均一性检查记录
工艺参数 混合时间:10分钟
记录人: 日期: 审核人: 日期
表03压片的片重差异检查记录
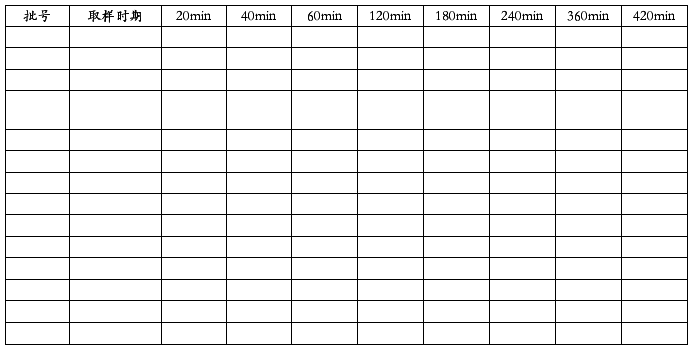
表04包装质量及成品质量检查记录
表05物料平衡及收率检查记录

附表02
验证方案修改申请书及批准书
文件编码:

附表03

