XXXX药业股份有限公司GMP文件 验证报告
美罗培南混粉工艺
验证报告
编 号:
文件类别:技术
验证品种:美罗培南/无水碳酸钠混粉
日期: 年 月 日
日期: 年 月 日
日期: 年 月 日
山东XX药业股份有限公司
无菌混粉工艺 Page:1 of11
山东罗欣药业股份有限公司GMP文件 验证报告
目 录
1、概述…………………………………………………………………………3
2、目的…………………………………………………………………………3
3、职责…………………………………………………………………………3
4、相关文件……………………………………………………………………3
5、适用范围……………………………………………………………………3
6.验证条件……………………………………………………………………4
7.混合实验……………………………………………………………………4
8、条件…………………………………………………………………………6
9、验证偏差处理………………………………………………………………6
10、验证周期 …………………………………………………………………6 验证结论及评价……………………………………………………………… 10 验证报告批准书 …………………………………………………………… 11
无菌混粉工艺 Page: 2 of 11
山东罗欣药业股份有限公司GMP文件 验证报告 1、概述
注射用美罗培南其原料粉为无菌美罗培南与无水碳酸钠按5:1比例混合均匀而成,混粉均一性是衡量混粉效果的重要指标。无菌原料的特殊性要求保证混粉操作过程中原料不受微生物污染。因此无菌原料产品的均一性及无菌的验证是无菌原料粉混合工艺验证的主要内容。
2、适用范围:适用于美罗培南与无水碳酸钠混粉工艺的验证。
3、职责
3.1 验证小组负责验证方案及报告的起草。
3.2生产车间在验证小组的指导下进行验证工作的实施。
3.3 质量管理部负责验证工作的现场监督和样品检验。
3.4 验证小组组长负责验证工作的总结评价
3.5 质管部经理、生产部经理负责验证报告的审核,验证委员会主任负责验证报

5、适用范围
适用于应用HDJ-400型混合机进行无菌美罗培南与无水碳酸钠混合工艺的验证。
无菌混粉工艺 Page: 3 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
6、条件:
6.1 HDJ-400型混合机设备确认已完成 (是□ 否□)
6.2 HDJ-400型混合机已清洁灭菌,并在有效期内
(是□ 否□) 确认人:_________, 日期: __________
6.2 所需相关工作
⑴ 验证过程中所用设备的PQ与工艺验证同步进行;
⑵ 根据生产规模下达三批试生产指令;
⑶ 密切监控各批的操作过程,对各阶段样品进行分析;
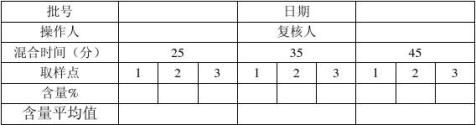
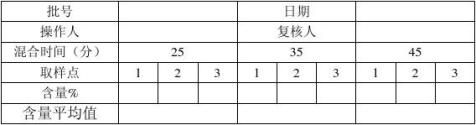
7、混合实验:
7.1混粉过程控制
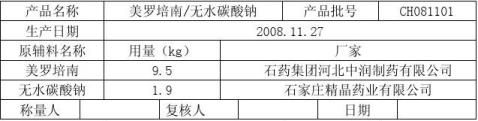
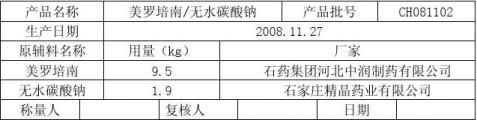
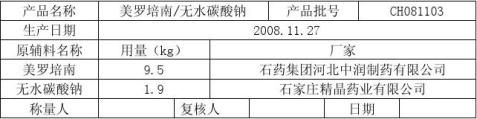
7.1.1按照处方比例称取美罗培南无菌粉、无水碳酸钠。
称量记录 所用衡器:电子台秤
称量记录 所用衡器:电子台秤
称量记录
所用衡器:电子台秤 结论:
评价人: 日期:
无菌混粉工艺 Page: 4 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
7.2 混合过程
7.2.1按混粉指令和《无菌混粉操作规程》进行混粉,混粉前需提前开启百级层流罩,并确保混粉机已清洁灭菌,并在有效期内;员工无菌服穿戴及个人卫生符合要求;所用工具、容器准备齐全并在清洁有效期内,衡器已校正并在校验有效期内;并且将物料数量进行双人核对准确。将混粉机调试好倾斜度约45度角,大口在上方,小口即(下料口)在下方并且处于关闭状态。将美罗培南纯粉与无水碳酸钠按工艺比例交叉倒入混粉机。(先将5kg美罗培南纯粉倒入混粉机内再倒入约1kg无水碳酸钠)一直这样交叉倒入。最后将不足5kg美罗培南纯粉一次倒入无水碳酸钠也如此倒入。倒料结束后,将进料口封好,打开混料开按钮进行混粉。分别在混粉后点击混料关按钮,停止混粉。
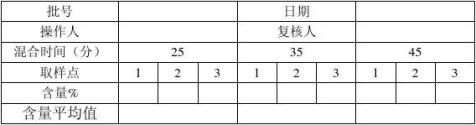
7.2.2混粉过程中分别在混粉25分钟、35分钟、45分钟时取样,每次取三个样。每次的第一个样品在取样口进行取样;第二个样品在第一个样品取完后,混粉机运行2分钟后在取样口进行取样,第三个样品在第二个样品取完后,混粉机运行2分钟后在取样口进行取样,测定各取样点原料药含量:混粉均匀度见(附表1),待检验合格后进行装桶另外请验全检,在百级层流下将混合药粉分装至小铝桶中,填写物料标示卡,做相应的岗位生产记录。工具、容器、设备、衡器清洁执行相应的清洁规程。
合格标准:同一时间各取样点原料含量差异≤±1.5%。
结论:
确认人:_________, 日期: __________
无菌混粉工艺 Page: 5 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
8.条件
[1] HDJ-400型混合机
[2]取样器
[3]检验仪器
9、验证偏差处理:在整个验证过程中,对于不合格的条项,应进行有针对性的分析,查明原因及时整改,并对该条项加倍验证,直至验证合格为止。
10、验证周期
10.1 设备或工艺发生改变时需再验证
无菌混粉工艺 Page: 6 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
附表1
混合25分钟,原辅料混合均匀度变化曲线图

混合35分钟,原辅料混合均匀度变化曲线图
混合45分钟,原辅料混合均匀度变化曲线图
无菌混粉工艺 Page: 7 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
含量测定记录
混合25分钟,原辅料混合均匀度变化曲线图


混合35分钟,原辅料混合均匀度变化曲线图
混合45分钟,原辅料混合均匀度变化曲线图
无菌混粉工艺 Page: 8 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
混合25分钟,原辅料混合均匀度变化曲线图
混合35分钟,原辅料混合均匀度变化曲线图
混合45分钟,原辅料混合均匀度变化曲线图
无菌混粉工艺 Page: 9 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
验证结论及评价报告
本报告对无菌原料药美罗培南/无水碳酸钠生产工艺的各操作步骤进行了全面的考察和验证。
整个验证报告表明对无菌原料药混粉生产工艺的各操作步骤各控制点
进行了连续操作,对每步骤的操作按已制定的工艺规程进行了生产试验和 无菌监控,尤其是混粉的均匀性,监控结果符合标准要求,达到了生产的 规定标准。
结论:车间的环境、设备、生产人员及各项生产条件具备按照规定的
工艺操作,能保证产品的质量并符合标准要求,本无菌混粉额的生产工艺 可以连续、规模化生产。
报告人:
日 期:
无菌混粉工艺 Page: 10 of 11
山东罗欣药业股份有限公司GMP文件 验证报告
报告人:
日 期:
验证报告批准书
验证项目名称:
有效期至:
无菌混粉工艺 Page: 11 of 11
山东罗欣药业股份有限公司GMP文件 验证报告

无菌混粉工艺 Page: 12 of 11
第二篇:注塑工艺验证报告1
注:
1、 本报告仅为样本,请依据公司的实际情况予以修订;
2、 修订时,请特别注意红色斜体部分;
3、 正式报告发布时请将文中的红色斜体部分删除;
4、 过程确认是一项复杂、耗时的研究工作,目的在于保证生产设备、生产工艺、检验技术
能确保提供稳定的、安全性高的产品,特别适用于一些高风险的工艺,产品性能检测成本高的过程,如灭菌过程、无菌医疗器械的封口过程等;
5、 过程确认本身是一种过程,通常应依据PDCA执行。
6、 过程确认需要判断该过程是否稳定,通常需要使用一些统计技术,如Cpk计算、控制图、
直方图、回归分析、正交表等,请依据公司的实际情况选择。

一、 验证目的:
1. 医疗器械数据传输线生产中,注塑是生产过程中影响产品质量的主要环节之一。注塑
质量影响到产品整体的性能和外观,配合等方面因此,对注塑工艺进行有效的控制并验证,以保证实现在正常的生产条件下,生产出符合标准的医疗器械产品。
2. 本报告的目的在于为评价注塑工艺参数的状况对注塑产品的外观及尺寸的影响,以确
认最佳的注塑工艺参数。
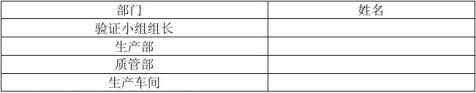
二、 报告验证小组成员:
技术部: 韦 克
品管部: 梁淑梅
模具部: 韦 敏
注塑车间:吴健先
本报告的由技术部编制,由品管部、技术部协同努力设计完成,由工程师审核批准。
三、 验证依据:产品工程图纸(GED-E-M- 11249 )和相关作业参数(SOP)。
四、 验证项目:注塑设备性能,注塑压力、温度、成型周期对产品质量的影响。
设备编号:GTL-AM-066
验证条件设置:
1.注塑区环境条件:
a) 温度:18-28 ℃
b)湿度:50-65%RH
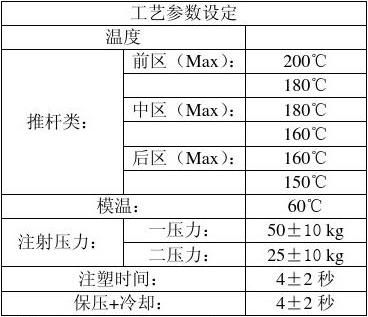
2.注塑工艺参数:
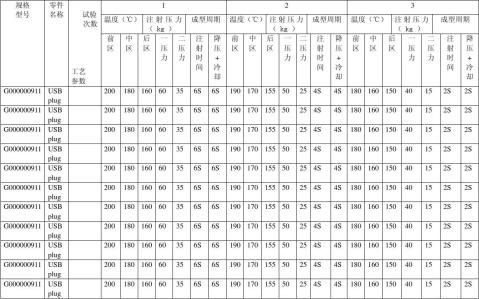
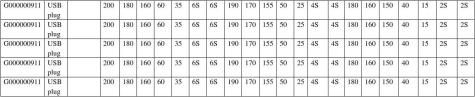
a) 温度
推杆类:前区:180℃――200℃
中区:160℃――180℃
后区:150℃――160℃
模温:55 ℃---65 ℃
b)注射压力:
一压力:50±10kg
二压力:25±10kg
注塑时间: 4±2 Sec
保压+冷却:4±2 Sec
五、 验证方法
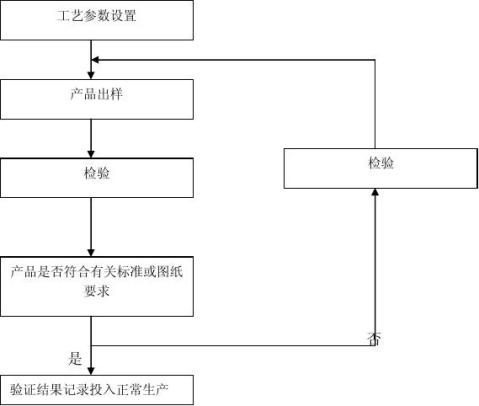
OQ:
1、参数设置:设置好各类参数: 温度、时间、压力,使机器预热升温至额定值。
2、出样:空注出模头样,手动闭模,注塑2-3模产品。
3、检验:检验产品外观及尺寸是否符合有关要求及图纸,如果全部合格,则投入正常生产,如果一项或某几项不合格,则需回到第一步,进行参数调整,重新进行验证。 PQ:
4、连续运行:在OQ取得的工艺基础上,连续运行3批,每批至少生产15模产品。 5、工艺记录:运行过程中,读取每模的工艺运行的参数,
6、产品测试:品质部对取得的全部产品按有关图纸或检验规程检验产品外观及尺寸,并做好记录。
六、 结果分析和评价:
1、运用统计技术分析工艺参数和产品性能之间的关系。确定关键工艺。并评价其稳定性。
2、经计算:
关键工艺为:
a) 温度
推杆类:前区:180℃――200℃
中区:160℃――180℃
后区:150℃――160℃
模温: 60 ℃
b)注射压力:
一压力:50±10kg
二压力:25±10kg
注塑时间:4±2 Sec
保压+冷却:4±2 Sec
3、对取得的结果进行数据分析:
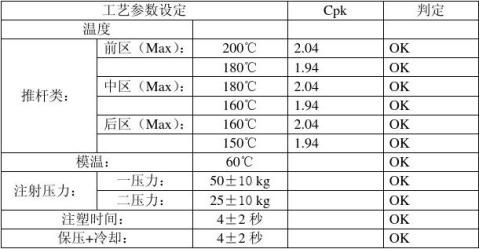

七、 结论:本次验证结果表明以下的工艺满足注塑过程的要求。
八、 最终批准:验证小组审阅上述所有结果及评价分析意见,同意验证结果,并按此结论编
制注塑工艺过程卡。
验证报告审核会签表:
九、 工艺验证流程图