20xx年医院医疗器械不良事件分析报告
20xx年,我院共收到各科室可疑医疗器械不良事件报告9例,从医疗器械不良事件涉及范围特征来看,主要是器械故障导致。其中B超室2例,妇产科2例,综合科3例,急诊科2例,手外科1例。从不良事件来源看,不良事件涉及2个类别。其中二类8例,三类1例。从产生不良事件的器械来看,主要是设备老化,人员操作熟练程度不够导致。因此,加大对有关人员的操作技能的培训势在必行。另外对设备的维护保养也要加强,要协同厂家对有问题的设备进行全面检查,杜绝不良事件隐患。
建立预防制度
经统计分析,虽然我院不良事件不是太多,但是也给患者造成不同程度的治疗困难。因此我们要针对这些事件,总结问题,建立事件预防机制,由于医疗器械材料与一些患者的体质之间存在较大的生物不相容性,因此,在给予患者使用医疗器械之前,应首先询问患者是否对某种材料的医疗器械有过敏史,凡是有过敏史者,应尽量避免使用此类医疗器械。另外,为了便于更加清楚地分析推断患者产生医疗器械不良事件的原因,应在不良事件报告表中增加医疗器械过敏史的内容,并将此作为必须填报内容予以填写。
规范说明书内容及操作
需要关注的是,部分医疗器械不良事件来自于医务人员或患者未按照医疗器械说明书进行规范操作。此外,通过对引起医疗器械不良事件的几种医疗器械的说明书、标签按照《医疗器械说明书、标签和包装标识管理规定》进行比对,涉及产品使用、产品维护、使用安全性
提示和注意事项等与患者使用安全有关的内容存在不全或不完整情况。
报表填写问题突出
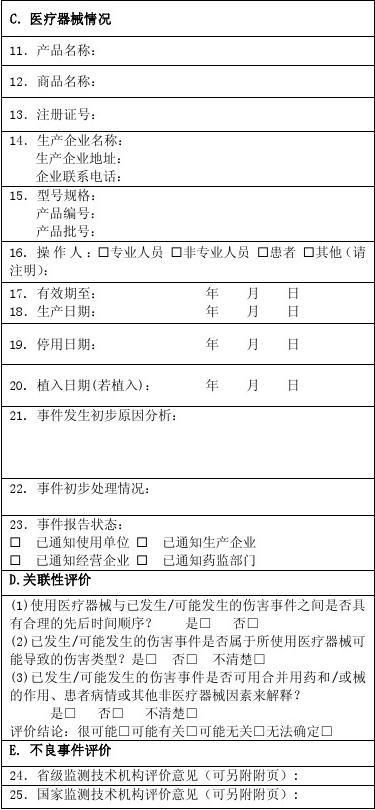
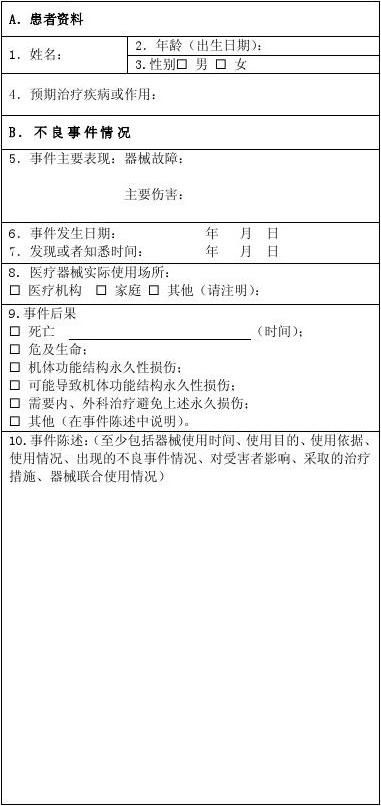
《可疑医疗器械不良事件报告表》的填写在较大程度上反应了监测单位和监测人员对这项工作的重视程度和监测水平。然而,20xx年收到的9例医疗器械不良事件报告反映出一些问题:一是事件陈述不完整,陈述至少应包括“器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况”8方面内容,然而,收到的报表存在缺少使用依据、使用目的不明确、对不良事件造成的影响描述模糊、缺少专业量化指标进行描述、使用大量非医学专业用语等。二是医疗器械信息不完整或填写错误。三是初步原因分析过于简单,由于不能得到第一手对医疗器械不良事件原因的分析,我们在上报时,填写也不详细,直接影响了报告表的上报质量。
完善监测手段
要想从根本上提升从业人员的监测意识和能力,必须从多方面入手,综合运用多种手段,为监测工作创造良好的工作氛围:
一是广大医务人员和使用单位切实提高涉械安全意识,积极提高个人业务水平,全面掌握医疗器械的安全使用方法;二是加强医疗器械不良事件的培训力度,严格按照我院建立的可疑医疗器械不良事件报告网络,收集、汇总分析和及时上报有关不良事件,为我院评价医疗器械的安全性提供真实可靠的第一手资料。从医疗器械的采购上严把质量关,尽量减少器械的不良事件发生,及时采取措施避免或减少事
件对患者的伤害,熟练填写报表中的每一项内容,对事件发生初步原因做到正确分析,保障患者用械安全,并为监测工作提供正确的、有利用价值的信息。
总之,医疗器械不良事件的监测,虽不能解决根本上的医疗事故,但是对于医疗事故的预防起着很重要的作用,所以建议广大员工积极参与进来,尤其是各科室的相关联系人,更要发挥个人身处一线的优势,积极上报医疗器械的不良事件,争取不漏报一件。
第二篇:20xx可疑医疗器械不良事件报告表
可疑医疗器械不良事件报告表
报告日期: 年 月 日
报告来源:? 生产企业 ? 经营企业 ? 使用单位 单位名称:
联系地址: 邮 编: 联系电话:
报告人签名:
