医疗器械不良事件监测及报告制度
一、医疗器械不良事件是指:获准上市的、合格的医疗器械在正常使用情况下,发生任何与医疗器械预期使用效果无关的有害事件。
二、医疗器械不良事件的监测是指对可疑医疗器械不良事件的发现、报告、评价和控制的过程。医疗器械不良事件监测工作,是预防医疗器械不良事件重复发生和蔓延,保证人民生命安全的重要工作。
三、为加强医疗器械的安全监管,规范医疗器械不良事件报告管理,发现可疑不良事件及时处置,并按规定上报,保障医疗器械临床使用安全,根据《医疗器械监督管理条例》及《昆明市医疗机构医疗器械质量管理规范》的相关规定,制定本制度。
四、医院成立医疗器械不良事件监测领导小组,完善管理制度,组织落实上级有关法律法规的培训工作,指导医院医疗器械不良事件监测工作的开展,监督、检查,确保医疗器械使用安全有效。
五、临床科室健全完善监测体系。科主任、护士长为科室医疗器械不良事件监测的负责人,指定专人做好医疗器械使用的详细登记,并对不良事件的信息进行收集,整理、上报。
六、报告医疗器械不良事件应当遵循可疑即报的原则。
七、医院各临床科室、门诊在诊疗过程活动中如发现医疗器械不良事件时,应立即停止使用,封存,向医疗器械管理科室报告。
八、医疗器械管理科室接到报告后应及时安排相关人员开展工作,对不良事件进行调查、分析、评价,在事件发生24小时内向省市药监局进行网络直报,填写《医疗器械不良事件报告表》交医院及
卫生局主管部门,不得擅自处理。
九、根据不良事件的调查情况,医疗器械管理科室应及时向院内各相关科室通报,以引起警惕,避免造成新的伤害。
十、临床科室如对医疗器械不良事件隐瞒不报,经查实后根据情节轻重进行处罚。
科室医疗器械临床使用安全监测领导小组及
工作职责
1、医疗器械临床使用安全监测领导小组
组长: 主任
副组长: 护士长
监测员:
2、工作职责
(1)加强医疗器械临床使用安全监管,保障医疗器械临床使用安全。
(2)研究制定科室医疗器械配置、规划、购置、培训、使用维护、效益分析、安全管理、制定相关的管理措施。
(3)对科室医疗器械进行安全监管、定期检查评价。
(4)监测员负责不良事件报告的具体工作,积极主动与与患者和医生联系,收集和完善患者随访制度,定期随访,发现可疑不良事件应及时处置并按规定上报。
(5)科室发现医疗器械不良事件时,应立即停问题产品的使用,按照报告流程进行上报,对不良事件造成的损害,及时组织开展救治工作,并进行分析,论证、定性,提出整改意见。
医疗器械临床使用安全监测登记表
监测时间 年 月 日
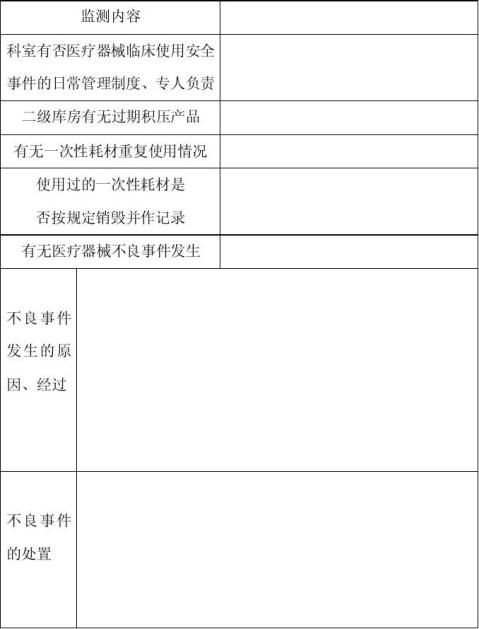
签字:
医疗器械不良事件监测报告流程








第二篇:医疗器械不良事件监测与报告制度
医疗器械不良事件监测与报告制度
1、医疗器械不良事件是指获准上市的、合格的医疗器械在正常使用情况下发生的导致或可能导致人体伤害的任何与医疗器械预期效果无关的有害事件。伤害事件分一般伤害与严重伤害。严重伤害的含义是指下列情况之一:
(1). 危及生命;
(2). 导致机体功能的永久性伤害或机体结构永久性损伤;
(3). 必须采取医疗措施才能避免的永久性伤害或损伤。
2、不良事件报告原则
1) 基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,并且可能与使用的医疗器械有关。
2) 濒临事件原则:当时并未造成人员伤害,但临床医务人员根据自己的临床经验认为再次发生同类事件时会造成患者、使用者死亡或严重伤害。
3) 可疑即报原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
3、不良事件报告及召回的程序
(1)医疗卫生机构发现可疑的医疗器械不良事件应详细记录,按规定报告。
(2)医疗器械不良事件重点监测品种应报告可疑医疗器械不良事件中的一般伤害事件,其他品种报告与医疗器械有关的死亡或严重伤害事件。
(3)可疑不良事件发生后,医疗机构应立即调查记录不良事件的有关资料,包括患者资料、发生情况与地点、医疗器械相关信息、操作使用人员等信息;在事件发生后10个工作日内填写《可疑医疗器械不良事件报告表》,报市医疗器械不良事件监测中心。其中,死亡事件应在24小时内报告市医疗器械不良事件监测中心和国家医疗器械不良事件监测机构,同时通知生产、经营单位,协助配合有关部门进行调查,提供有关相关资料。
(4)在可疑不良事件发生原因未明确前,医疗机构应主动采取措施,根据不良事件的严重程度,责令使用科室对出现不良事件的医疗器械该批号或该型号的库存产品暂缓放行和停用,若有必要,可对该医疗器械进行召回。
4、不列入医疗器械不良事件的几种情况
(1).在医疗器械使用中,由于其他因素也有可能引发不良事件,原因也可能错综复杂。对于可以确定的下列几种情况之一,可以不列入医疗器械不良事件,所产生的病人伤
害与死亡应按医疗事故处理方法的程序进行处理。不能明确判定原因的仍按国家可疑医疗器械不良事件处理上报。
(2).超过生产厂商规定的使用期限(有效质保期)或重复使用一次性使用器械引起的不良事件。
(3).医疗器械生产厂在技术文件中已标明的可能产生的副作用或有建议性提示的。
(4).使用错误造成的不良事件。不符合生产厂所规定的操作使用方法,使用者明显运用了厂家明文禁止或建议不能采用的操作行为而错误使用。对于不合法生产厂家的产品、无证产品用于临床,也认为是错误使用。由于错误使用引起的不良事件应保护现场、素材、论据,由专家调查鉴定分析、判断。
(5).由于病人自身原因、并发症或病人未按医嘱进行的活动造成的不良事件。
5、设备科协助医院主管部门,对本单位使用的医疗器械的不良事件信息收集、分析、报告和管理工作,加强对临床科室人员的不良事件教育,提高其医疗器械安全风险意识。
