华中科技大学
生命学院09级分子生物学实验报告
专业:生物医学工程
班级:0902班
学号:U2009125666 姓名:尤书畅
成绩____________________
指导教师________________
华中科技大学
分子生物学基础实验
分子生物学实验技术已成为生物化学及分子生物学以及相关学科院系教学科研不可缺少的一部分。为提高学生在分子生物学技术方面的动手能力,生物技术综合实验室主要开设常用而基本的分子生物学实验技术。它的内容包括质粒DNA的制备;DNA的重组;PCR基因扩增等等。
实验一质粒DNA的小量制备
一、 实验原理
要把一个有用的外源基因通过基因工程手段,送进细胞中去进行繁殖和表达,需要运载工具,携带外源基因进入受体细胞的这种工具就叫载体(vector)。载体的设计和应用是DNA体外重组的重要条件。作为基因工程的载体必须具备下列条件:(1)是一个复制子,载体有复制点才能使与它结合的外源基因复制繁殖;(2)载体在受体细胞中能大量增殖,只有高复制率才能使外源基因在受体细胞中大量扩增;(3)载体DNA链上有1到几个限制性内切酶的单一识别与切割位点,便于外源基因的插入;(4)载体具有选择性的遗传标记,如有抗四环素基因(Tcr),抗新霉素基因(Ner)等,以此知道它是否已进入受体细胞,也可根据这个标记将受体细胞从其他细胞中分离筛选出来。细菌质粒具备上述条件,它是基因工程中常用的载体之一。
质粒(plasmid)是一种染色体外的稳定遗传因子,大小在1~120kb之间,具有双链闭合环状结构的DNA分子,主要发现于细菌、放线菌和真菌细胞中。质粒具有自主复制和转录能力,能使子代细胞保持它们恒定的拷贝数,可表达它携带的遗传信息。它可独立游离在细胞质内,也可以整合到细菌染色体中,它离开宿主的细胞就不能存活,而它控制的许多生物学功能也是对宿主细胞的补偿。
质粒在细胞内的复制,一般分为两种类型:严密控制型(stringent control)和松弛控制型(relaxed control)。前者只在细胞周期的一定阶段进行复制,染色体不复制时,它也不复制。每个细胞内只含有1个或几个质粒分子。后者的质粒在整个细胞周期中随时复制,在细胞里,它有许多拷贝,一般在20个以上。通常大的质粒如F因子等,拷贝数较少,复制受到严格控制。小的质粒,如ColEⅠ质粒(含有产生大肠杆菌素E1基因),拷贝数较多,复制不受严格控制。在使用蛋白质合成抑制剂-氯霉素时,染色体DNA复制受阻,而松弛型ColEⅠ质粒继续复制12-16h,由原来20多个拷贝可扩增至1000-3000个拷贝,此时质粒DNA占总DNA的含量由原来的2%增加到40%-50%。本实验分离提纯化的质粒pBR322、pUC19就是由ColEⅠ衍生的质粒。
所有分离质粒DNA的方法都包括三个基本步骤:培养细菌使质粒扩增;收集和裂解细菌;分离和纯化质粒DNA。采用溶菌酶可破坏菌体细胞壁,十二烷基硫酸钠(SDS)可使细胞壁解,经溶菌酶和阴离子去污剂(SDS)处理后,细菌染色体DNA缠绕附着在细胞壁碎片上,离心时易被沉淀出来,而质粒DNA则留在清液中。用乙醇沉淀、洗涤,可得到质粒DNA。
质粒DNA的相对分子量一般在106-107范围内,如质粒pBR322的相对分子质量为
2.8×106,质粒pUC19的相对分子质量为1.7×106。在细胞内,共价闭环DNA(covalently closed circular DNA,简称cccDNA)常以超螺旋形式存在。如果两条链中有一条链发生
华中科技大学
一处或多处断裂,分子就能旋转而消除链的张力,这种松弛型的分子叫做开环DNA(open circular DNA,简称ocDNA)。在电泳时,同一质粒如以cccDNA形式存在,它比其开环和线状DNA的泳动速度快,因此在本实验中,自制质粒DNA在电泳凝胶中呈现3条区带。
二、 实验目的
1.掌握最常用的提取质粒DNA的方法和检测方法。
2.了解制备原理及各种试剂的作用。
三、 实验材料和试剂
材料:大肠杆菌E.coli,含pBR322质粒。
试剂:
1. LB培养基:10g/L胰蛋白胨,5g/L酵母提取物,10g/L NaCl,用NaOH调pH至
7.3左右。如固体培养基则添加15g/L琼脂。
2. 溶液Ⅰ(pH8.0G.E.T缓冲液):50 mmol/L葡萄糖,25mmol/LTris-HCl,10mmol/L
EDTA。灭菌后存放。
3. 溶液Ⅱ(0.2mol/LNaOH(内含1%SDS)):预先配制1%SDS母液,临用前一天晚上
加入0.2mol/LNaOH,4℃保存。
4. 溶液Ⅲ(pH4.8乙酸钾溶液):5mol/L乙酸钾60mL、冰乙酸11.5mL、双蒸馏水
28.5mL。
5. 酚/氯仿液(V/V=1/1):酚为重蒸酚,配制时,先将氯仿中加入异戊醇,使其体积比为
24:1,然后等量的加入重蒸酚,混匀,并用0.1mol/LTris-HCl (pH7.6)抽提几次以平衡这一混合物,于棕色瓶中存放,并在上面覆盖等体积的0.01 mol/LTris-HCl(pH7.6),4℃保存。
6. 无水乙醇
7. 70%乙醇
8. pH8.0TE缓冲液:10mmol/LTris-HCl、1mmol/LEDTA,其中含RNA酶20μg/mL。 仪器:
恒温培养箱、恒温摇床、超净工作台、高压蒸汽灭菌锅、台式高速离心机、台式小型振荡器、EP管(1.5mL微量离心管)、加样器(20uL~lmL)、吸头。
四、 操作步骤
(一)培养细菌
将带有质粒pBR322的大肠杆菌接种在含50μg/mL氨苄青霉素(Amp)的LB液体培养基中,37℃振荡培养过夜。注意:添加Amp时,须待LB培养基冷却到50℃左右方可加入。
(二)从菌落中快速提取制备质粒DNA
1.取1.4mL菌液置于1.5mLEp管中,7500rpm离心1min。
2.弃上清,重复步骤1,弃上清,加入150μL GET缓冲液,在涡旋混合器上充分混匀,在室温下放置10min。
3.加入200μL新配制的0.2mol/L NaOH(内含1%SDS),加盖,颠倒(不要振荡)2~3次,使之混匀,冰上放置4min,最多不能超过5min。
4.加入150μL15min。
5.10000rpm离心5min,上清液吸至另一干净的1.5mLEp中,如上清液浑浊则
华中科技大学
需重新离心一次。
6.于上清液中加等体积酚/12000rpm离心2min,小心吸取上清液,转移至另一1.5mLEp管中,注意勿将两液相中间的白色蛋白薄层吸出。
7.向上清液加入2倍体积无水乙醇,混匀,室温放置3min。用离心机于10000rpm离心5min。小心吸去上清液,将离心管倒置于一张纸巾上,以使所有液体流出。
8.用0.5mL 70%乙醇洗涤沉淀一次,10000rpm离心3min,除尽乙醇,室温自然干燥(将离心管倒置于一张纸巾上),备用。
9.用25uL含无DNA酶的胰RNase(20 ug/mL)的TE重新溶解DNA,置于供下午电泳使用。贮存于-20℃备用,可长期保存。
五、 注意事项
1.收集菌体提质粒前,培养基要去除干净,同时保证菌体在悬浮液中充分悬浮。
2.在添加溶液Ⅱ与溶液Ⅲ后溶液的混合一定要柔和,采用上下颠倒的方法,千万不能在旋
转器上剧烈振荡。其中加入溶液Ⅱ后,溶液变成澄清,并有黏性;加入溶液Ⅲ后,出现絮状沉淀。
3.苯酚具有腐蚀性,能造成皮肤的严重烧伤及衣物损坏,使用时应注意。如不小心皮肤上
碰到苯酚则应用碱性溶液、肥皂及大量的清水冲洗。
4.苯酚可以用于抽提纯化DNA,由于苯酚的氧化产物可以使核酸链发生断裂。所使用的
苯酚在使用前必须经过重蒸,且都必须用0.1mol/LTris-HCl (pH7.6)进行平衡。所以取酚/氯仿/异戊醇时应取下层溶液,因为上层是Tris-HCl液隔绝空气层。
5.酚/氯仿/异戊醇抽提时,应充分混匀。经酚/氯仿/异戊醇抽提后,吸取上清液时注意不
要把中间的白色层吸入,其中含有蛋白质等杂质。
6.实验中,涉及酚/氯仿溶液的操作要格外小心,而且与之接触的吸头、Ep管,全部弃用,
不回收。
7.有些质粒本身可能在某些菌种中稳定存在,但经过多次移接有可能造成质粒丢失。因此
不要频繁转接,每次接种时应挑单菌落。
六、 思考题
1.裂解细菌时需注意的事项有哪些?
2.质粒的基本性质有哪些?
3.碱裂解法提取质粒DNA中各溶液的作用是什么?
4.抽提质粒DNA的方法包括哪几个步骤?
5.如何提高质粒DNA的产量?
6.为什么质粒DNA不能反复在4℃、-20℃、室温中放置?为达到这一目的,需要注意些什么?
华中科技大学
实验二DNA含量、纯度与分子量的电泳法测定
一、 实验原理
测定核酸通常采用两种方法:即紫外分光光度法与琼脂糖凝胶电泳法。 1.紫外分光光度法
DNA或RNA定量时,应在260nm和280nm两个波长下读数。根据计算在260nm波长下,每1ug/mL DNA钠盐的A值为0.20,即在A260=1时,双链DNA含量为50ug/mL,单链DNA与RNA含量为40ug/mL,单链寡核苷酸的含量为33ug/mL。
双链DNA含量=A260×50×稀释倍数(ug/mL) RNA含量=A260×40×稀释倍数(ug/mL) 单链DNA含量=A260×33×稀释倍数(ug/mL)
此外还可以根据260nm和280nm的读数间的比值(A260/A280)估计核酸的纯度。 2.琼脂糖凝胶电泳法
根据DNA分子量不同,采用外加电场使其分开,用EB嵌入DNA分子后在紫外下显荧光。而荧光强度正比于DNA的含量,如将已知浓度的标准样品表2-1作为电泳对照,就可以估计出待测样品的浓度。电泳后的琼脂凝胶糖直接在紫外灯下拍照,只需要5-10ngDNA,就可以从照片上比较鉴别。
由于电泳时所用的样品量非常少,只要将浓度控制在几十纳克即可,所以在基因工程中经常被用做检测DNA样品。
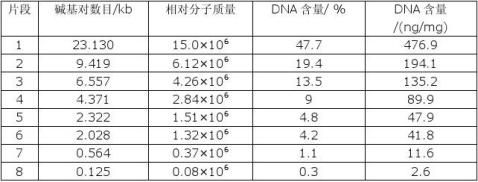
表2-1 λDNA/ Hind Ⅲ中DNA片断
二、 实验目的
1.从以上实验中提取到的质粒DNA,为了能作下一步的酶切,连接及转化实验,必须测
定DNA的纯度、含量以及分子量大小。
2.本实验旨在学习水平式琼脂糖凝胶电泳,学习检测DNA、含量与相对分子质量大小。
华中科技大学
三、 实验材料和试剂
材料:自制的质粒DNA、λDNA/ Hind Ⅲ、。
试剂:
1.标准DNAmarker(λDNA/ Hind Ⅲ)
2.限制性内切酶EcoRⅠ或HindⅢ和10X缓冲液
3.酶反应中止液:0.2 5%溴酚蓝(含40%蔗糖),已配好。
4.溴化乙锭染液(EB):使用前稀释1000倍,母液已配好。注意:EB是一种诱变剂,
配制和使用时应戴好手套,并且不能将该染液洒在桌面或地面上!使用后立即用大量的水冲洗干净。
5.0.5×TBE缓冲液:Tris2.18g、硼酸1.10g、EDTA-Na20.14g用蒸馏水定容至400mL。可配成5×TBE母液,使用时稀释10倍即可。
6.0.7%琼脂糖
仪器:
37℃水浴锅、微波炉、稳压电泳仪、凝胶成像系统、电泳槽、Eppendorf架、恒温摇床、台式小型振荡器、Ep管(1.5mL)、加样器(20uL~lmL)、吸头。
四、 实验操作
(一)质粒DNA的酶解
1.新提的质粒,在10uL的体系中用单一酶(如EcoRⅠ)进行处理,即:
质粒DNA 5μL
10×缓冲液1μL
EcoRⅠ0.5μL
ddH2O 4μL
2.37℃,保温30min。
3.加入1/10体积的酶反应终止液,混匀以停止酶解反应。各酶解样品于冰箱中贮存备用。
(二)琼脂糖凝胶板的制备
1.琼脂糖凝胶的制备
称取1.0g琼脂糖,置于锥形瓶中,加入100mL TBE缓冲液,瓶口倒扣一小烧杯,于电炉上加热,注意:防止溢出,由于琼脂糖较难溶解,如果水分损失较大,则补充一定量的蒸馏水,使其终浓度为1%。
2.胶板的制备
将有机玻璃内槽洗净、晾干。取胶带纸将有机玻璃内槽的两端边缘封好,形成一个边脚模子。注意:将橡皮膏紧贴在有机玻璃内槽两端边上,不能留空隙。
将有机玻璃内槽置于水平位置,放好样品槽模板(一般称之为梳子),将冷却至65℃左右的琼脂糖凝胶,小心地倒在内槽上,控制灌胶速度,使胶液缓慢地展开,直到整个有机玻璃板表面形成均匀的胶层。室温下静置1h左右,待凝固完全后,轻轻拔出样品槽模板,撕去胶带纸,胶板上即形成相互隔开的样品槽。
将有机玻璃内槽放入电泳槽中,加入0.5×TBE电泳缓冲液,以盖过胶板为宜。
华中科技大学

胶板内的样品小槽
3.加样
用微量加样器将上述样品分别加入胶板的样品小槽内,每次加完一个样品为了避免交叉污染,各样品用不同的吸头,以免造成限制酶被污染。加样时,吸头不要插入胶板内,防止碰坏样品槽周围的凝胶面,每个样品槽的加样量不宜过多,本实验加样为10uL左右。(每块胶板需点一个Marker,这里即为λDNA/ Hind Ⅲ)
4.电泳
加完样品后应立即通电,进行恒压电泳。在低压条件下,线形DNA片段的迁移速度与电压成比例关系,为了获得电泳分离DNA片段的最大分辨率,电场强度不应高于5V/cm。
当溴酚蓝染料(蓝色)移动到距离胶板下沿约1~2cm处,停止电泳。
5.染色
将电泳后的凝胶浸入EB染液中,进行染色以观察在琼脂糖凝胶中的DNA带。染色20min后,用大量水冲洗。
6.观察
在波长为254nm的紫外灯下,观察染色后的电泳凝胶。DNA存在处显示出红色荧光条带。
用凝胶自动成像仪处理代替。
五、 注意事项
1.基因工程是微量操作技术,DNA样品与限制性内切酶的用量都极少,必须严格注意吸样量的正确性,确认样品确实被加入反应体系。
2.酶应在-20℃冰箱中保存,取酶的操作必须严格在冰浴条件下进行,用完后立即放回-20℃冰箱,不要将酶在冰浴中放置过久,或放在高于0℃以上的环境中,以防止酶失活。
3.酶切加样次序为水、缓冲液和DNA,然后混匀。酶永远是最后加入的,如将酶直接加入浓缩的缓冲液中会引起严重的失水。酶切反应体系的溶液加完后,用手指轻弹管壁使溶液混匀,也可用微量离心机甩一下,使溶液集中在管底,不要用振荡器。此步操作是整个实验成败的关键,注意防止错加、漏加。
4.为了避免交叉污染,各样品用不同的吸头,且每次取酶时务必换吸头,以免造成限制酶被污染。
5.溴化乙锭是一种强烈的诱变剂,有毒性,使用含有这种染料的溶液时,应戴手套进行操作。勿将溶液滴洒在台面或地面上,用后用水彻底冲洗干净。
六、 思考题
1.简述EB显色的原理。
2.使用溴化乙锭时应注意什么?
3.说明不同电压对电泳结果的影响是什么
华中科技大学
4.如何判断DNA的纯度?
华中科技大学
实验三感受态细胞的制备及转化
一、 实验原理
感受态就是细菌吸收转化因子的生理状态,只有发展为感受态的细胞才能稳定摄取外来的DNA分子。转化是将外源DNA分子引入受体细胞,使之获得新的遗传性状的一种手段。转化的基本原理是细胞处于0℃,CaCl2低渗溶液中,细胞膨胀成球形,转化混合物中的DNA形成抗DNase的羟基-钙磷酸混合物粘附于细胞表面,经42℃短时间热冲击处理,促使细胞吸收DNA复合物,在选择性培养基平板上培养,可选出所需的转化子。
二、 实验目的
1.学习和理解影响细胞感受态的因素,掌握感受态细胞的制备方法。
2.掌握质粒的转化方法。把体外DNA引入受体细胞,使受体菌具有新遗传性,并从中选择出转化子。
三、 实验材料和用具
材料:自制的质粒DNA、大肠杆菌(E.coli)菌种(DH5α菌株)。
试剂:
LB琼脂平板 (无抗生素)、
LB琼脂平板 (含50μg/L氨苄青霉素)、
LB液体培养基5mL(无抗生素)、
LB液体培养基100mL(无抗生素)、
LB液体培养基5mL(含50μg/L氨苄青霉素)、
0.1mol/LCaCl2溶液(灭菌备用)。
仪器:
恒温培养箱、恒温摇床、接种环、涂布器、冷冻离心机、离心管、超净工作台、高压蒸汽灭菌锅。
四、 操作步骤
(一)大肠杆菌感受态细胞的制备
1.从新活化的E.coliDH5α菌平板上挑取一单菌落,接种于5mL液体培养基中,37℃振
荡培养过夜,直至对数生长期。将该菌悬液以1:50接种于50mL LB液体培养基中,37℃快速振荡培养3~4h。
2.取5mL培养液放入离心管中,在冰上放置10min,于4℃5000rpm离心10min。
3.可用加样器将残余液体尽量去净,用1mL预冷的0.1mol/LCaCl2溶液轻轻悬浮细胞,
冰上放置15~30min。
4.于4℃,5000rpm离心10min。
5.弃上清,加入200μL预冷的0.1mol/LCaCl2溶液,小心悬浮细胞,冰上放置片刻,即
制成了感受态细胞悬液。
6.制好的感受态细胞可在冰上放置,24h内直接用于转化实验,也可加入占总体积95%
华中科技大学
左右高压灭菌过的甘油,混匀后分装于Ep管中,-70℃条件下可保存半年至一年。 (二)细胞转化
取200μL摇匀后的感受态细胞悬液,进行下一步的转化,转化如下(单位:μL): 样品组即为我们的转化组:100μL感受态细胞+2μL质粒DNA 对照1为受体菌对照组:100μL感受态细胞+2μL无菌水
对照2为质粒DNA对照组:100μL0.1mol/LCaCl2+2μL质粒DNA
将以上各样品轻轻摇匀,冰上放置30min后,于42℃水浴中保温90s,然后迅速在冰上冷却3~5min。上述各管中分别加入400μL LB液体培养基,使总体积为500μL,该溶液称为转化反应原液,摇匀后于37℃振荡培养30min,使受体细胞恢复正常生长状态,并使转化体产生抗药性。 (三)平板培养
取各样品培养液100μL分别接种于含氨苄青霉素和不含氨苄青霉素的LB平板培养基
—+
上(分别记为Amp和Amp),涂匀。37℃培养24h,待菌落生长良好且未相互重叠时停止培养。
(四)检出转化体
受体菌对照组 质粒对照组 转化实验组
不含抗生素培养基 有大量菌落长出 无菌落长出 有大量菌落长出
含抗生素培养基 无菌落长出 无菌落长出 有菌落长出
结果分析
本实验未产生抗药性菌株 质粒DNA不含杂菌 质粒进入受体菌中产生抗
药性
五、 注意事项
1.这一个实验中的所有操作均要为无菌操作,在超净工作台内进行。 2.细胞转化中,42℃水浴90s要准确操作。
3.制备感受态细胞过程中,需要在冰上放置的一定不要在室温中放置。
六、 思考题
1.感受态细胞制备好后,为什么在转化前还要在冰上放置? 2.思考转化后平板培养应有的结果、分析自己培养的情况。

华中科技大学
附录:
1. pH8.0 G.E.T.缓冲液 (灭菌后使用):
葡萄糖0.991g
EDTA-Na20.372g
Tris-HCl0.303g
H2O 100mL
2. 5mol/LKAc:49.08gKAc溶于100mL H2O。
3. PH4.8乙酸钾溶液:取60mL 5mol/L KAc,11.5mL冰醋酸,28.5mL H2O即可。
4. 0.2mol/LTris-Cl:2.422g溶于100mL H2O。
5. 0.2mol/LHCl:取1.724mL浓HCl稀释到100mL。
6. pH8.0 0.1mol/L Tris-HCl:取0.2mol/LTris-Cl 50mL加入29.2mL 0.2mol/LHCl,
补H2O至100mL即可。
7.pH8.0 10mmol/LEDTA-Na2:3.722g EDTA-Na2溶于一定量的 H2O中,用固体
NaOH调节其pH值,最后定容至100mL。
8.pH8.0TE:取10mL pH8.0 0.1mol/L Tris-HCl,10mL pH8.0 10mmol/L EDTA -Na2,
最后定容至100mL,调节pH至8.0。含RNA酶(RNaseA)20ug/mL。
9.pH7.60.1mol/L Tris-HCl:取0.2mol/LTris-Cl 50mL加入38.5mL 0.2mol/L HCl,
补H2O至100mL即可。用于饱和酚/仿混合物。
10.酚/仿溶液(按如下体积和顺序加入试剂)
饱和酚:重蒸酚 12.5mL
三氯甲烷 12mL
异戊醇 0.5mL
用pH7.6 0.1mol/L Tris-Cl平衡2~3次,在饱和酚/仿上,加入等体积的pH7.6 0.01mol/L Tris-Cl保护,棕色瓶保存,4℃存放。
11.5×TBE:称取Tris-Cl21.8g,硼酸11.0g和EDTA-Na2 1.4g用蒸馏水溶解,定容
至400mL。临用时稀释为0 .5×TBE。
12.0.1 mol/LCaCl2:5.5g CaCl2溶于500mL H2O。灭菌后备用。
13.无菌水。
