脂肪乳氨基酸(17)葡萄糖(11%)注射液
无菌保证与细菌内毒素质量风险评估报告
作者:xxx
职务:质量管理与研发高级总监
日期:20xx-7-15
1.简介
脂肪乳氨基酸(17)葡萄糖(11%)注射液,商品名卡文,系由费森尤斯卡比集团公司研制,自2004年起由XX公司进口销售。经费卡董事会批准XX公司接受费卡公司就该产品的技术转移,在XX公司无锡生产基地建造生产线,产品供应中国市场并出口至亚太地区市场。项目分为生产线建设和产品注册两个相互影响的部分。由于国内药品生产注册申请受理前要求必须具备实际的生产线并经验证生产出注册报批样品,在等待审批过程中必然存在生产设备投资的闲置问题。由于生产设施中自动化制袋/灌装/装外袋的设备投资很大,为求得产品注册进展,项目费用、生产能力和市场需求的最优平衡,决定分两个阶段建设生产设施:
第一阶段,2008年实现投资较低的进口成品空袋、半自动灌装,每小时灌装200袋的生产能力,以达到年产100万袋的产能,产品可满足国内市场需求。但其中配制、灭菌、灯检、装箱等设备和公用工程应能为第二阶段每小时900袋的生产能力配套。
第二阶段,2010年投资一套全自动的制袋/灌装/装外袋的设备,以取代第一阶段的半自动设备,产品除满足国内市场外,还可供应亚太地区。
根据上述项目建设策略,因灌装速度的限制,会存在配制批量、灭菌能力超过第一阶段的灌装能力的问题。主要表现为:如以1440ml规格的产品计算,脂肪乳注射液最大配制批量2000升生产,灌装时间会达到40小时;以最小批量1000升生产,则需要的灌装时间为20小时。1920ml规格的产品灌装时间分别低于上述数据。通常,营养类输液产品灭菌前存放时间超过12小时,应考虑灭菌前微生物繁殖导致的产品无菌保证和细菌内毒素质量的风险,并采取有针对性的措施控制风险。
而就产品的理化质量而言,只要产品灌装前和灌装后具有同样的氮气保护,相对于产品2年以上的稳定性保证,几十小时的灌装时间不会造成特殊的风险。
本文以产品的无菌保证和细菌内毒素质量风险控制为目标,通过分析药液长时间灌装导致微生物繁殖的各种风险因素,说明项目在设备与工艺设计、质量控制策略等方面采用的全面的风险控制策略与方案,并结合相应的验证和试验结果,以评估产品的实际风险控制水平。
2.风险评估
2.1 风险因素分析
本项目的最大潜在风险因素在于药液自配制完成至开始灭菌最长可能有48小时的时间。作为营养性输液产品,药液中存在的微生物可能以产品为底物大量繁殖,造成灭菌前微生物无法控制进而超出灭菌工艺的能力,威胁产品无菌保证水平;同时也可能使革兰氏阴性菌的代谢物细菌内毒素超出安全水平。
产品中细菌繁殖的总量取决于药液温度、微生物的种类、时间以及药液的特性,如pH、可供微生物利用的成分等。在本项目中,药液等待灭菌的时间是最应关注的因素。此外,微生物的数量还与灭菌微生物初始污染量、污染种类以及药液的温度和性质有关;细菌内毒素数量与污染菌的种类和数量相关。
此外,细菌内毒素主要来自于原料中已有的内毒素和药液中微生物大量繁殖的代谢产物。由于原料中的内毒素能均匀分布溶解在药液中,通过抽样检查可以准确掌握整批产品来自原料的内毒素情况。而来自药液灭菌前微生物繁殖的内毒素,在各产品包装中可能不均匀,必须通过控制微生物的繁殖来间接控制该来源的内毒素。总体上,控制药液中灭菌前的微生物总量,就能控制相应的细菌内毒素风险。以下分析着重讨论微生物的风险因素控制。
2.1.1 微生物的初始污染
导致微生物初始污染的原因有以下多种方面:
⑴ 原料中的微生物,通过产品配制进入药液,
⑵ 配制过程中来自环境和人员操作的微生物,
⑶ 设备中残存的微生物
⑷ 包装材料中的微生物
2.1.2 污染的种类
从控制的角度,微生物污染的种类是不可控的,但对污染菌的鉴别有助于对产品质量的评价。
2.1.3 时间
整个灭菌前的时间分为配制时间、灌装时间和灌装后待灭菌时间。由于配制在高温下进行,一般生长态微生物能被杀死,而芽孢态微生物在此高温条件下不死亡也不会繁殖,因此配制过程的时间可以不予考虑。需要考虑的是配制完成药液冷却到室温后开始转移进入储罐直至灭菌开始的时间。
本产品最大灌装时间系生产1440ml规格产品时,配制2000升的脂肪乳注射剂,其灌装时间达到40小时,加上药液转移入储存罐、灌装后等待灭菌的时间,生产方法规定总共不超过48小时。在设计验证方案时,以48小时为挑战时间。
2.1.4 产品特性分析
三个单元产品分别为氨基酸溶液、脂肪乳液和葡萄糖溶液,其理化性质各异,各有敏感的微生物。从公司掌握的微生物经验,葡萄糖、氨基酸液的pH较低,一般微生物不宜在其中繁殖。脂肪乳比较适宜微生物的生长。
2.1.5 温度
适宜的温度是微生物繁殖的重要条件。三个产品均在高温下配制,其中葡萄糖和氨基酸注射液冷却到室温储存,而脂肪乳特别冷却到2-10℃储存。低温能抑制微生物生长。
2.2 风险控制策略与方案
风险控制策略与方案应针对风险因素。
2.2.1 设备与工艺设计
生产设备与工艺设计的总体目标是尽可能降低药液被微生物污染的风险。整个配制灌装系统都设计为计算机程序控制的全封闭系统,能经自动在线灭菌程序(SIP)对包括药液过滤器内的整个系统灭菌,灭菌完成后充入经0.22微米过滤的氮气正压保护,理论上只要维持正压,即能保证设备内表面的无菌状态。
配制好的氨基酸溶液和葡萄糖溶液,可经0.22微米的除菌过滤器滤除由原料带入药液的微生物,得到无菌溶液,并在灌装罐中在室温下无菌储存。
脂肪乳液(Intralipid 20%)的灌装罐带有冷却加套和温度测定控制系统,保证脂肪乳液储存在2-10℃。该设计基于费卡公司(前身为Kabi Pharmacia公司)多年的生产实践。该公司的生产常规为将匀化后的乳液冷却至2-10℃并在该条件下储存,可达40小时。在此基础上,我公司预测延长至48小时是可行的。
因此,从设计可以保障药液在等待灌装的期间污染微生物或微生物爆发性繁殖的风险很小。
2.2.2 微生物的初始污染
⑴ 原料中的微生物
1 对每种主要原辅料均制定了内控微生物限度和细菌内毒素限度标准,以减少进入药液的微生物总量和细菌内毒素量。

以最大批量2000升脂肪乳液,2400升氨基酸液,7000升葡萄糖液的工艺配方组合计算,最差情况下配制完成后氨基酸液中的微生物初始污染水平为12×106cfu,相当于 葡萄糖液中为15×106cfu。两种溶液均经过Pall公司的20英寸0.22微米除菌过滤器,其有效过滤面积为16800cm2,以对细菌截留效率107/cm2计,该型过滤器的截留细菌能力远远超过药液中的带菌量,理论上能获得无菌的氨基酸溶液和葡萄糖溶液。
因脂肪乳液无法通过0.22微米过滤器,故对配制脂肪乳的水、甘油溶液分别通过0.22微米除菌过滤,大豆油通过0.45微米过滤,氢氧化钠配制成1M的溶液后投料(一般微生物在强碱液中无法生存)。0.45微米过滤器常虽然不作为药液除菌过滤器使用,但其孔径小于绝大多数微生物的尺寸,广泛用于无菌检查和微生物限度检查中,实际上对微生物也有相当好的截留作用。因此由原料带入脂肪乳中初始污染微生物主要来自卵磷脂,不超过2.6×106cfu。
2 配制温度较高,其中氨基酸配制温度起始为约80℃,葡萄糖溶液起始约80℃,脂肪乳约70℃,一般生长态的微生物可以被杀死。
工艺验证报告836-PQ-R1总结了对三批验证生产中配制灌中微生物初始污染量的数据:
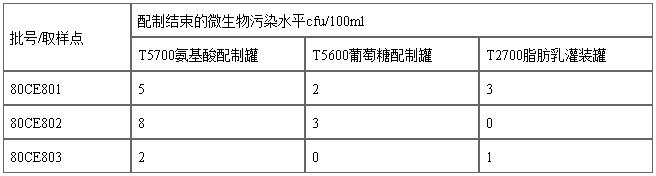
该验证数据说明配制过程能杀死大部分生长态的微生物,药液在过滤前的污染水平已经很低,原料的微生物限度标准足够严格。
生产方法中规定各药液灭菌前污染菌浓度纠偏限度为100cfu/100ml,与公司多年生产的其他输液类产品相同。
⑵ 配制过程中来自环境和人员操作的微生物
尽管采用了密闭性良好的配制灌装系统,能有效防止环境微生物的侵入,但加强环境和人员微生物的控制有助于进一步降低产品污染风险。
配制间和灌装间的生产环境为符合欧盟标准的C级,药液暴露的灌装环境局部为A级。空调净化系统系符合欧盟规范的计算机自控的恒风量系统,主要房间风量经初始调整验证确定后,24小时恒定风量连续运行,从而保证各房间换气次数及相邻房间之间气流方向的恒定。风险最大的房间为灌装间,设计送风量10600m3/h,75%循环风,按每人每小时40m3新风量的洁净室设计规范,理论上可容纳60人同时工作。房间风量设计和实测结果见下表:
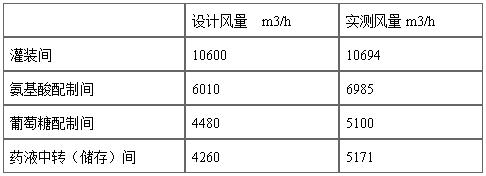
SOP10-120规定了空调净化系统高效过滤器、风量和层流系统风速的再验证,应每半年进行一次PAO(曾经为DOP)试验以及风速测定。
该洁净环境2009年4月经过静态验证,并于5月起转人动态监控。按SOP5-319的要求,最终灭菌产品C级及以上区域有生产时每周监控一次,连续无生产时每月进行一次静态监测。
从空调净化系统和洁净环境验证及监控数据看,空调系统和洁净环境均能符合设计要求。
⑶ 设备中残存的微生物
设备中残存微生物通过CIP出去,由SIP达到无菌保证。在设备内充氮气并维持正压以保证维持已建立的微生物洁净状态。其中,因长期储存药液,药液储罐至灌装机及其所属管道经CIP后必须经SIP,伴以最终充氮气保护,以达到并维持无菌状态;而配制系统则通过进行CIP达到微生物限度要求,并通过充氮气维持正压的措施保证微生物洁净标准。同时,配制系统也能进行SIP并通过了验证。
验证报告836-PQ-R1总结了配制、灌装系统SIP的验证结果。验证方法:通过经验对整个系统判断选取可能的冷点位置50个为测量点。将50根热电偶放置在测量点设备的外表面并用隔热材料包裹。运行SIP程序三次,记录F0值三组。所有150个F0值数据都大于17分钟。由于达到了过度杀灭的标准,决定不必进行微生物挑战试验。
清洁验证报告838-ClV-R1总结了三个验证批经CIP后的清洁验证数据,其中微生物清洁验证归纳如下:

验证证明系统经CIP能使微生物水平符合验证合格标准。
设备残存微生物的风险受控
⑷ 内包装材料中的微生物
内包装袋由爱尔兰工厂定点生产。在注册进口包装袋的过程中,对其生产、质量控制、储存、发运、接收、检验、储存、工厂使用等环节的质量可控进行了详细评估。公司制定了包装袋质量控制标准,微生物限度为100cfu/袋,远低于灭菌前产品微生物限度;细菌内毒素标准为50EU/袋,远低于每袋产品允许的细菌内毒素总量。上述控制使来自于包装材料的微生物和细菌内毒素降低到最小程度。另外,由包装袋进入药液的微生物至灭菌的时间通常不超过8个小时(一般为5小时),微生物繁殖的风险较小。SOP3-934规定了材料转移、使用过程的防止污染措施。
由包装材料向产品引入微生物的风险可以接受。
2.2.3 污染的种类
污染的种类无法预先控制。通过对超过微生物限度标准的污染菌进行鉴别,有助于预测细菌内毒素的质量情况并指导污染原因的调查。公司已有10多年使用API系统鉴别微生物种的经验,能为微生物污染原因调查提供技术支持。
2.2.4 时间
药液转移入储存罐、灌装及灌装后等待灭菌的时间,生产方法规定总共不超过48小时。该时间对能利用药液为底物的微生物而言,是非常长的。通过时间控制微生物繁殖是不够的。因而控制初始微生物污染是整个体系的关键。
2.2.5 产品特性
各单元产品中,葡萄糖、氨基酸液的pH较低,根据微生物的常识和公司多年生产经验该条件不利于微生物的生长,验证试验证明了该判断。(见3.1微生物生长验证)
2.2.6 温度
由于脂肪乳无法采用除菌过滤,储存期间药液带菌的可能性较大。因此,将储存罐设计为带冷却加套,能将药液冷却至2-10℃储存。药液进入灌装机前,通过热交换器将温度提升到灌装温度。
2.2.7 微生物中间控制标准
微生物中间控制标准包括灭菌前微生物污染量和污染菌耐热性标准。制定该标准是产品无菌保证的必要措施。产品无菌水平取决于灭菌工艺赋予产品的F0值、灭菌开始时的产品内污染菌总数(N0)和污染菌的耐热参数(D值)。本产品采用残存概率灭菌法,灭菌温度121℃,F0值8.5~21分钟。灭菌前污染菌含量纠偏限度为:

灭菌前微生物限度检查对产品无菌保证水平评价的意义重大。由于产品内的污染菌的种类无法控制,工艺验证实际上无法反映各种可能的污染情况。而本项检查,能直接实际反映出产品在完成整个灭菌前生产过程中的综合污染状况,其意义一是可以为产品无菌保证水平的评价提供关键参数,二是长期、大量数据的积累可以反映生产系统的微生物控制水平和趋势。灭菌前微生物的取样时机应能涵盖整个生产灌装的情况。XX公司规定在灌装的开始、中间和结束阶段抽取样品,并将样品存放在与待灭菌产品同样的条件下,当产品开始灭菌时,将样品转入冰箱冷藏以抑制微生物可能的繁殖。
XX公司有多年测定耐热芽孢D值的经验和技术,可以测定污染菌的耐热性。
2.2.8 细菌内毒素标准
控制了微生物污染,就控制了细菌内毒素的污染。由于通常一批产品的最后阶段微生物繁殖的时间最长,内毒素污染概率最高,可取此阶段的样品作细菌内毒素检查。也可对产品标识生产序号,根据微生物检查的异常情况有针对性地取样。
3. 验证
鉴于微生物污染菌的多样性,无法通过有限的试验获取生产体系的可靠性的充分证据,但毕竟验证能提供有益的证据和线索,证明一般情况下的生产体系的可靠性。验证分为微生物生长验证和生产工艺验证两部分。
3.1 微生物生长验证
验证报告V09-023考察了常温条件下本产品葡萄糖11%,氨基酸液Vamin 201在公司多年来药液微生物检查中发现的多种微生物,包括了革兰氏阴性菌、革兰氏阳性菌、球菌、杆菌和芽孢的促生长性,具有广泛的代表性。这些微生物接入产品中并在室温培养48小时后,均没有明显增长,说明对大部分微生物而言,上述产品不支持其繁殖。
该验证说明即使在储存过程中药液污染了少量常见的微生物,在相当长的时间内也不会大量繁殖,威胁产品的质量。
验证报告V07-038-R考察了2-10℃下本产品中脂肪乳20%对在公司多年来药液微生物检查发现的、以及有广泛代表性的9类微生物的促生长性报告。这些微生物接入产品中并在室温培养24、48、72小时后,均没有明显增长,说明对绝大部分微生物而言,上述产品在该温度下不支持其繁殖。
该验证说明即使在配制过程中药液污染了少量常见的微生物,在相当长的时间内也不会大量繁殖,威胁产品的质量。
应当指出,验证使用的菌种并不能代表自然界所有存在的微生物。对于可能存在的能在上述验证条件下迅速繁殖的微生物,可通过对灭菌前微生物样品的检查直观地反映药液中的微生物状况。该检查能有效控制偶然发生的特殊微生物的污染,从而防止有无菌保证风险和内毒素风险的产品放行。即该风险能被可靠地发现,从而避免产品对使用者的风险。
3.2 生产工艺验证
针对以上分析的风险因素,在三批生产工艺验证中特别设计了最差条件,通过对长达52小时储存条件的模拟灌装和取样,考察极端条件下实际产品灭菌前微生物数量的变化。
所有灭菌前取样的含菌量检验结果全部远低于纠偏限度100CFU/100ml。
尽管生产工艺验证的批次有限,但已有数据一定程度上验证了整个生产设施、工艺设计和质量控制方案的可行性。
通过未来投产后的同步验证,能获取更多的信息,获得跟大的质量保证信心。
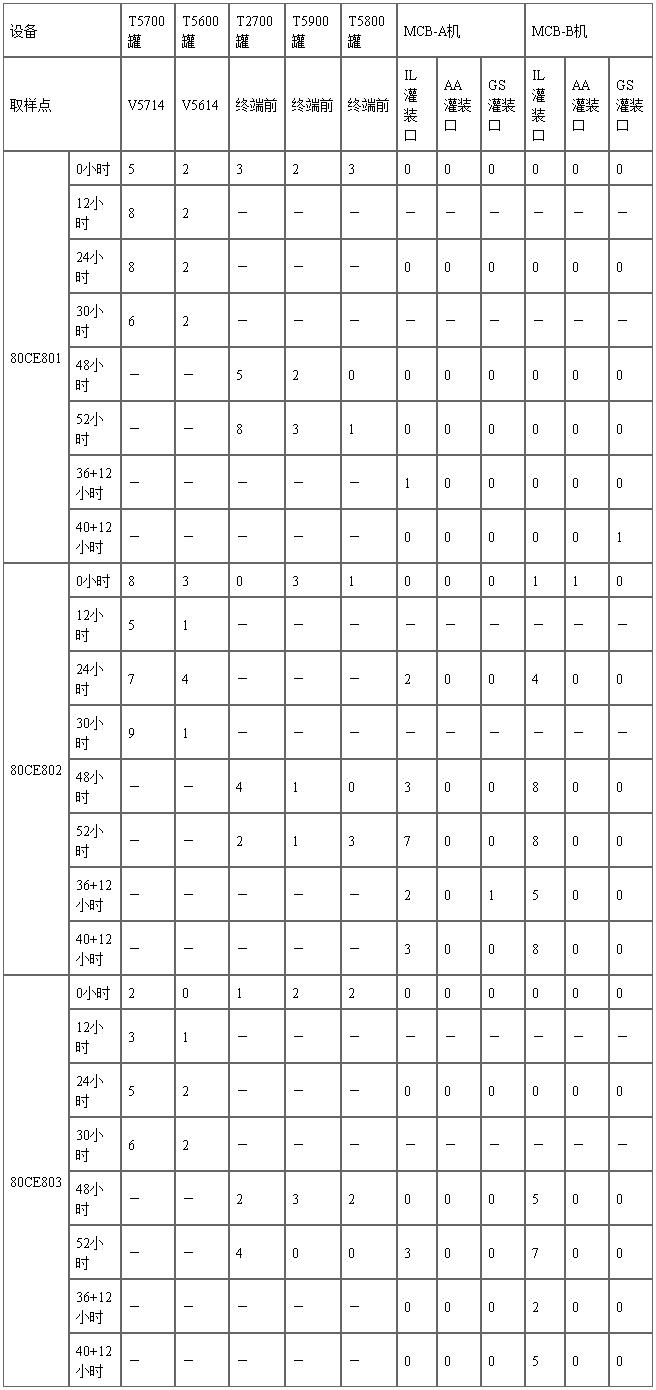
备注:36+12小时/40+12小时表示“在药液转移开始36或40小时灌装取样,取样后在20~25℃放置12小时后再进行含菌量检查”。
3.3 灭菌工艺验证
产品无菌的最终保障是灭菌工艺。灭菌工艺热穿透试验证明灭菌工艺能高度可靠地赋予药液的F0值为8 -21,即8≤F0平均±3SD≤21的标准。F0平均系验证过程中测定的所有药液实际F0值的平均值,SD系实际F0值的标准偏差。该灭菌工艺标准代表了行业先进水平,对灭菌设备的热分布均匀性提出了极高的挑战。历程灭菌工艺验证和再验证均支持上述结论。报告祥见880-PV-R1,882-PV-R1,883-PV-R1。
通过验证同时获取了灭菌设备控制用F0值与产品药液获取的F0值间的定量关系。从而确定了日常灭菌程序的控制参数。
在热穿透试验完成后进行的微生物挑战试验,采用生孢梭菌孢子ATCC7955接入标准溶液(NaCl-PBS pH7.0)中以获得D121=1分钟的生物指示剂,并测定该孢子在本产品的三种溶液中的最高D121=0.9分钟。因此在标准溶液中的耐热性高于直接接种的耐热性。验证接入的生物指示剂含3×106个孢子。验证对两种规格的产品分别进行了三次试验。每次放入20袋带指示剂的产品,并分布于满载的验证产品中。采用的灭菌程序系比正常灭菌程序降低F0值3分钟的最差条件。该生物指示剂挑战试验最终证明:对于1440ml,1920ml的两种装量规格的卡文,在灭菌前微生物总量不超过3000cfu/腔室,且污染菌D121≤0.85分钟的前提下,该灭菌程序能确保产品的无菌保证水平达到10-6的标准。
4.总结和结论
控制产品的无菌保证和细菌内毒素质量风险以确保使用者的安全性为目标。药液长时间灌装过程并等待灭菌的工艺过程存在微生物过量繁殖潜在风险,并威胁产品的无菌保证和细菌内毒素质量。该风险需要通过有针对性的设备和工艺设计、质量管理策略等全面的风险控制方法得以控制。通过上述分析和提供的证据,可以得出以下结论:
⑴ 包括工艺设备和工艺流程和质量控制策略在内的整个生产体系是根据消除、控制上述风险设计并建设的。
⑵ 所有已知的风险都采取了针对性的措施;
⑶ 已建立了以控制、监测灭菌前微生物污染量为核心的质量控制策略,能及时发现偶发的灭菌前药液异常微生物污染;
⑷ 产品的灭菌工艺、生产工艺和清洁验证工艺等都经过了验证。最终灭菌能有效杀灭灭菌前存在的微生物。
⑸ 公司有多年大容量注射剂试行参数放行的经验,有一支管理经验和技术知识丰富的微生物专业队伍和质量管理团队。对产品无菌保证的概念和要求具有深入的了解,有能力控制各种偶发的微生物污染风险,保证有质量风险的产品不流入市场。产品的无菌保证和细菌内毒素质量风险是完全可以控制的。
分发名单:

