附件2
药品注册收费实施细则
(试行)
依据《药品注册管理办法》、《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》等有关规定,制定本实施细则。
一、药品注册费缴费程序
(一)新药注册申请
1.国产药品。注册申请人向省级食品药品监督管理部门提出临床试验或生产申请,省级食品药品监督管理部门受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
2.参照新药申报的进口药品。注册申请人向国家食品药品监督管理总局提出临床试验(含国际多中心临床试验)或上市申请,国家食品药品监督管理总局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
(二)仿制药注册申请
1.国产药品。注册申请人向省级食品药品监督管理部门提出申请,省级食品药品监督管理部门受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
经技术审评需要进行临床试验的,注册申请人完成临床试验后,持《药物临床试验批件》及有关资料向省级食品药品监督管理部门提出现场核查申请,省级食品药品监督管理部门出具《行政许可项目缴费通知书》,注册申请人按要求补交差额(31.80万余-18.36万元=13.44万元)。
2.参照仿制药申报的进口药品。注册申请人向国家食品药品监督管理总局提出申请,国家食品药品监督管理总局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
经技术审评需要进行临床试验的,注册申请人完成临床试验后,向国家食品药品监督管理总局提出上市申请,国家食品药品监督管理总局受理后出具《行政许可项目缴费通知书》,注册申请人按要求补交差额(50.20万元-36.76万元=13.44万元)。
(三)补充申请注册
1.国产药品。注册申请人向省级食品药品监督管理部门提出申请,省级食品药品监督管理部门受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
2.进口药品。注册申请人向国家食品药品监督管理总局提出申请,国家食品药品监督管理总局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
(四)进口药品再注册申请
注册申请人向国家食品药品监督管理总局提出申请,国家食品药品监督管理总局受理后出具《行政许可项目缴费通知书》,注册申请人按要求缴纳。
二、药品注册费缴费说明
(一)新药申请包括《药品注册管理办法》附件1中药、天然药物注册分类1-8,附件2化学药品注册分类1-5和附件3生物制品注册分类1-15。新药申请按照申报临床试验和申报生产/上市分别缴费。单独申请新药证书的参照申请新药生产的收费标准缴费。
(二)仿制药申请包括《药品注册管理办法》附件1中药、天然药物注册分类9和附件2化学药品注册分类6。
(三)进口药品按照申报临床试验、申报上市分别缴费,参照《药品注册管理办法》相应注册分类执行新药和仿制药的收费标准。国际多中心临床试验申请参照进口药品临床试验的相应标准缴费。
(四)补充申请(常规项),包括《药品注册管理办法》附件4药品补充申请注册事项第2、14(改变制药厂商名称、注册地址、包装规格)、16(改变非直接接触药品的国外包装厂)、 17、18(无需技术审评)项。
(五)补充申请(需技术审评的),包括《药品注册管理办法》附件4药品补充申请注册事项第1、3、4、5、6、7、8、9、10、11、12、13、14(改变药品名称、药品有效期)、15、16(改变直接接触药品的国外包装厂)、18(需技术审评的)项。
(六)继续申报新药(含进口药)Ⅱ期或Ⅲ期临床试验,按照《药品注册管理办法》附件4药品补充申请注册事项第18(需要技术审评)项申报并缴费。
(七)新药(含进口药)临床试验申请经批准予以减免临床试验的,申报新药生产或上市时,按照相应收费标准的50%收费,注册申请人应在《药品注册申请表》“其他特别申明事项”中予以说明。
(八)新原料药(含进口药)申请生产或上市时,按相应收费标准的50%收费,注册申请人应在《药品注册申请表》“其他特别申明事项”中予以说明。
(九)参照仿制药申报的进口药品申请,申请人应在《药品注册申请表》“其他特别申明事项”中予以说明。
(十)注册申请人应当在收到《行政许可项目缴费通知书》后5个工作日内按照要求缴纳注册费,未按要求缴纳的,其注册程序自行中止。
(十一)注册申请受理后,申请人主动提出撤回注册申请的,或国家食品药品监督管理总局依法做出不予许可决定的,已缴纳的注册费不予退回。再次提出注册申请的,应当重新缴纳费用。
三、小微企业收费优惠政策
(一)优惠范围
符合国务院规定的小微企业提出的符合下列情形的创新药注册申请,免收新药注册费和创新药Ⅱ期或Ⅲ期临床试验补充申请注册费。
Ⅰ.治疗艾滋病、恶性肿瘤,且未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其中药或天然药物制剂。
Ⅱ.未在国内外上市销售的通过合成或者半合成的方法制得的化学原料药及其制剂。
Ⅲ.治疗用生物制品注册分类1.未在国内外上市销售的生物制品。
Ⅳ.预防用生物制品注册分类1.未在国内外上市销售的疫苗。
(二)需提交的材料
对符合《中小企业划型标准规定》(工信部联企业〔2011〕300号)条件的注册申请人,申请小微企业收费优惠政策时向执收单位提交下述材料:
1.《小型微型企业收费优惠申请表》(见附表);
2.企业的工商营业执照副本;
3.上一年度企业所得税纳税申报表(须经税务部门盖章确认)或上一年度有效统计表(统计部门出具)。
另外,国产药品注册申请在填写注册申请表时,选择相应类别即可。
四、其他问题说明
(一)补缴费用问题。国产药品注册申请需补缴费用的,申请人持有关批件至省级食品药品监督管理部门补缴相关费用,并按法定程序开展余下工作;进口药品注册申请补缴费用的,申请人持有关批件至国家食品药品监督管理总局行政事项受理服务和投诉举报中心(以下简称受理和举报中心)补缴相关费用,并按法定程序开展余下工作。
(二)退费问题。因申请人原因错汇的,由申请人向受理和举报中心提出,并递交退费申请、汇款收据、《非税收入一般缴款书》等有关材料;非因申请人错汇的,由国家食品药品监督管理总局药品化妆品注册司向受理和举报中心下发退费通知书,受理和举报中心与注册申请人联系,并由注册申请人提交退费申请、汇款收据、《非税收入一般缴款书》等材料,于每年4月底或10月底前按规定办理退费手续。
(三)药械组合产品。药械组合产品以发挥主要作用的物质为准,相应收取注册费。
附表
小型微型企业收费优惠申请表
第二篇:《药品注册管理办法》附件4
附件4:
药品补充申请注册事项及申报资料要求
一、注册事项
(一)国家食品药品监督管理局审批的补充申请事项:
1.持有新药证书的药品生产企业申请该药品的批准文号。
2.使用药品商品名称。
3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。
4.变更用法用量或者变更适用人群范围但不改变给药途径。
5.变更药品规格。
6.变更药品处方中已有药用要求的辅料。
7.改变影响药品质量的生产工艺。
8.修改药品注册标准。
9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。
10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。
11.申请药品组合包装。
12.新药的技术转让。
13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。
14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。
15.改变进口药品的产地。
16.改变进口药品的国外包装厂。
17.进口药品在中国国内分包装。
18.其他。
(二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项:
19.改变国内药品生产企业名称。
20.国内药品生产企业内部改变药品生产场地。
21.变更直接接触药品的包装材料或者容器(除上述第10事项外)。
22.改变国内生产药品的有效期。
23.改变进口药品制剂所用原料药的产地。
24.变更进口药品外观,但不改变药品标准的。
25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。
26.补充完善进口药品说明书安全性内容。
27.按规定变更进口药品包装标签。
28.改变进口药品注册代理机构。
29.其他。
(三)省级食品药品监督管理部门备案的补充申请事项:
30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。
31.补充完善国内生产药品说明书安全性内容。
32.按规定变更国内生产药品包装标签。
33.变更国内生产药品的包装规格。 34.改变国内生产药品制剂的原料药产地。 35.变更国内生产药品外观,但不改变药品标准的。 36.其他。
二、申报资料项目及其说明
1.药品批准证明文件及其附件的复印件:
包括与申请事项有关的本品各种批准文件,如药品注册批件、补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、《新药证书》、《进口药品注册证》、《医药产品注册证》等。附件包括上述批件的附件,如药品标准、说明书、标签样稿及其他附件。
2.证明性文件:
(1)申请人是药品生产企业的,应当提供《药品生产许可证》及其变更记录页、营业执照、《药品生产质量管理规范》认证证书复印件。申请人不是药品生产企业的,应当提供其机构合法登记证明文件的复印件。
由境外制药厂商常驻中国代表机构办理注册事务的,应当提供外国企业常驻中国代表机构登记证复印件。
境外制药厂商委托中国药品注册代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国药品注册代理机构的营业执照复印件。
(2)对于不同申请事项,应当按照“申报资料项目表”要求分别提供有关证明文件。
(3)对于进口药品,应当提交其生产国家或者地区药品管理机构出具的允许药品变更的证明文件、公证文书及其中文译本。其格式应当符合中药、天然药物、化学药品、生物制品申报资料项目中对有关证明性文件的要求。
除变更药品规格、改变产地、改变制药厂商和注册地址名称外,生产国家或者地区药品管理机构不能出具有关证明文件的,可以依据当地法律法规的规定做出说明。
3.修订的药品说明书样稿,并附详细修订说明。
4.修订的药品标签样稿,并附详细修订说明。
5.药学研究资料:
根据对注册事项的不同要求,分别提供部分或全部药学研究试验资料和必要的原注册申请相关资料,申报资料项目按照附件1~3中相应的申报资料项目提供。
6.药理毒理研究资料:
根据对注册事项的不同要求,分别提供部分或全部药理毒理研究的试验资料和必要的国内外文献资料,申报资料项目按照附件1~3中相应的申报资料项目提供。
7.临床试验资料:
要求进行临床试验的,应当按照附件1~3中相应的申报资料项目要求,在临床试验前后分别提交所需项目资料。不要求进行临床试验的,可提供有关的临床试验文献。
三、申报资料项目表

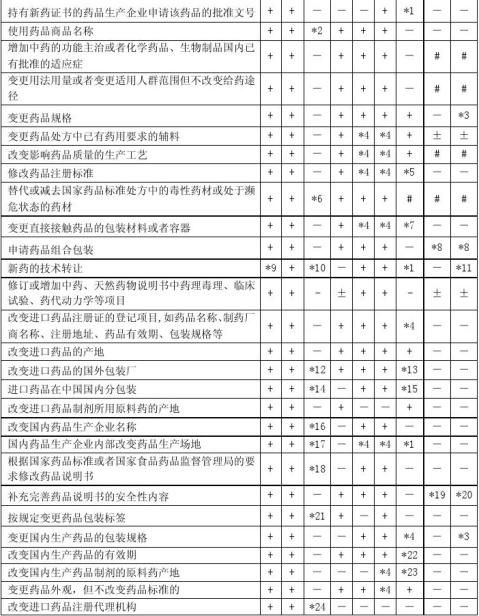
注:*1.仅提供连续3个批号的样品检验报告书。 *2.提供商标查询单。
*3.提供临床使用情况报告或文献。 *4.如有修改的应当提供。
*5.仅提供质量研究工作的试验资料及文献资料、药品标准草案及起草说明、连续3
个批号的样品检验报告书。
*6有关毒性药材、处于濒危状态药材的证明文件,或者有关部门要求进行替代、减去的文件、证明。
*7.仅提供连续3个批号的样品检验报告书、药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准。
*8.按照中药、天然药物、化学药品、生物制品注册分类中已在国外上市但尚未在国内上市销售的复方制剂的相应资料要求提供。其中药学研究部分仅提供药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准、连续3个批号的样品检验报告书。
*9.同时提交新药证书原件。
*10.提供技术转让有关各方签订的转让合同,原生产企业放弃生产的应当提供相应文件原件。
*11.国家食品药品监督管理局根据评价需要另行提出要求。
*12.提供包装厂所在国家或地区药品管理机构出具的该药品包装企业符合药品生产质量管理规范的证明文件。
*13.仅提供分包装工艺、药物稳定性研究的试验资料、直接接触药品的包装材料和容器的选择依据及质量标准、连续3个批号的样品检验报告书。
*14.提供进口药品分包装合同(含使用进口药品商标的授权)。
*15.仅提供分包装工艺、直接接触药品的包装材料和容器的选择依据及质量标准。 *16.提供有关管理机构同意更名的文件复印件,更名前与更名后的营业执照、《药品生产许可证》、药品生产质量管理规范认证证书等的复印件。
*17.提供有关管理机构同意药品生产企业变更生产场地的证明文件。 *18.提供新的国家药品标准或者国家食品药品监督管理局要求修改药品说明书的文件。 *19.可提供毒理研究的试验资料或者文献资料。 *20.可提供文献资料。
*21.按规定变更药品包装标签者,应提供有关规定的文件内容。
*22.仅提供药品稳定性研究的试验资料和连续3个批号的样品检验报告书。
*23.仅提供原料药的批准证明文件及其合法来源证明、制剂1个批号的检验报告书。 *24.提供境外制药厂商委托新的中国药品注册代理机构代理申报的委托文书、公证文书及其中文译本,新的中国药品注册代理机构的营业执照复印件,境外制药厂商解除原委托代理注册关系的文书、公证文书及其中文译本。
“#”:见“四、注册事项说明及有关要求”。
四、注册事项说明及有关要求
1.注册事项1,持有新药证书的药品生产企业申请该药品的批准文号,是指新药研制单位获得新药证书时不具备该新药生产条件,并且没有转让给其他药品生产企业的,在具备相应生产条件以后,申请生产该新药。
2.注册事项3,增加中药的功能主治或者化学药品、生物制品已有国内同品种使用的适应症,其药理毒理研究和临床试验应当按照下列进行:
(1)增加中药新的功能主治,需延长用药周期或者增加剂量者,应当提供药理毒理试验资料或者文献资料。经批准后应当进行临床试验,临床试验按中药新药要求;
(2)增加中药新的功能主治,用药周期和服用剂量均不变者,应当提供主要药效学试验资料及文献资料,并须进行至少100对临床试验;
(3)增加已有国内同品种使用的功能主治或者适应症者,须进行至少60对临床试验,
或者进行以使用此适应症的同品种为对照的生物等效性试验。
3.注册事项4,变更用法用量或者变更适用人群范围但不改变给药途径,应当提供支持该项改变的安全性研究资料或文献资料,必要时应当进行临床试验。中药、天然药物应当针对主要病证,进行至少100对临床试验。
4.注册事项5,变更药品规格,应当符合以下要求:
(1)所申请的规格一般应当与同品种上市规格一致。如果不一致,应当符合科学、合理、必要的原则。
(2)所申请的规格应当根据药品用法用量合理确定,一般不得小于单次最小用量,或者大于单次最大用量。
(3)如果同时改变用法用量或者适用人群,应当同时按照注册事项4的要求提供相应资料,必要时进行临床试验。
5.注册事项7,〖JP3〗改变影响药品质量的生产工艺的,其生产工艺的改变不应导致药用物质基础的改变。中药如有改变药用物质基础的,应当提供药学、药理毒理等方面的对比试验研究资料,并应当根据药品的特点,进行不同目的的临床试验,病例数一般不少于100对。
6.注册事项9,替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材,是指申请人自行要求进行替代或减去药材的申请,不包括国家规定进行统一替代或减去药材的情形。
(1)申请使用已获批准的中药材代用品替代中药成方制剂中相应药材。应当提供新的制备工艺、药品标准和稳定性等药学研究资料,可以减免药理、毒理和临床试验资料。
(2)申请使用已被法定标准收载的中药材进行替代,如果被替代的药材在处方中处于辅助地位的,应当提供新的制备工艺、药品标准和稳定性等药学研究资料,必要时提供药理、毒理和临床试验资料。其替代药材若为毒性药材,则还应当提供考察药品安全性的资料,包括毒理对比试验资料,必要时提供药效学试验资料,并进行临床试验。如果被替代的药材在处方中处于主要地位的,除提供上述药学研究资料外,还应当进行药效、毒理的对比试验及相关制剂的临床等效性研究。
(3)申请减去毒性药材的,应当提供新的制备工艺、药品标准和稳定性等药学研究资料、药理实验资料,并进行临床试验。
(4)药学、药理、毒理及临床试验的要求如下:
药学方面:①生产工艺:药材替代或减去后药品的生产工艺应当与原工艺保持一致。②药品标准:应当针对替代药材建立专属性鉴别和含量测定。不能建立专属性鉴别或含量测定的,应提供研究资料。③稳定性试验:替代药材可能影响药品的稳定性时,应进行稳定性试验。
药理、毒理学方面:药材替代后,应当与原药品针对主要病症进行主要药效学和急性毒性的比较研究。减去毒性药材后,应当与原药品针对主要病症进行主要药效学的比较研究。 临床试验方面:应当针对主要病证,进行100对随机对照试验,以评价二者的等效性。
7.注册事项11,药品组合包装是指两种或者两种以上具有独立的适应症和用法用量的药品组成的包装。其不包括下列情形:
(1)已有相同活性成份组成的复方制剂上市的;
(2)缺乏国际公认的成熟的治疗方案作为依据的;
(3)给药途径不一致的药品;
(4)其他不符合有关规定的。
药品组合包装不单独发给药品批准文号,不设立监测期,不得使用商品名称。 申请药品组合包装还应当符合以下要求:
(1)申请生产企业应当取得《药品生产质量管理规范》认证证书,组合包装的各药品应是本生产企业生产,并已取得药品批准文号。
(2)说明书、标签应当根据临床前研究和临床试验结果制定,而不是其中各药品说明书的简单叠加,并应当符合药品说明书和标签管理的有关规定。
(3)直接接触药品的包装材料应当适用于其中各药品。
(4)标注的有效期应当与其中药品的最短有效期一致。
(5)贮藏条件应当适用于其中各药品。
(6)名称为“X/Y/Z组合包装”,X、Y、Z分别代表其中各药品的通用名称。
8.注册事项13,指根据试验资料或文献资料修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学项目,不包括对功能主治、用法用量等项目的增加或修订。
9.注册事项19,改变国内药品生产企业名称,是指国内药品生产企业经批准变更《药品生产许可证》企业名称以后,申请将其已注册药品的生产企业名称作相应变更。
10.注册事项20,国内药品生产企业内部改变药品产地,包括原址改建或异地新建。
11.注册事项25和30,是指根据国家药品标准的统一规定和国家食品药品监督管理局的专项要求,对药品说明书的某些项目进行修改,如不良反应、禁忌、注意事项等项目。除有专门规定或要求外,不包括修改适应症或功能主治、用法用量、规格等项目。
12.注册事项26和31,补充完善药品说明书的安全性内容,仅可增加不良反应、禁忌、注意事项的范围。不包括对适应症或功能主治、用法用量等项目增加使用范围。
13.注册事项27和32,按规定变更药品包装标签,是指按照药品管理的有关规定、国家药品标准或经过核准的药品说明书内容,对该药品的包装标签进行相应修改。
14.注册事项33,变更国内生产药品的包装规格应当符合以下要求:
(1)药品包装规格应当经济、方便。有使用疗程的药品,其包装规格一般应当根据该药品使用疗程确定。
(2)申请药品注射剂配一次性使用注射器或者输液器的包装、药品注射剂配其专用溶媒的包装的,不得另行命名,所配注射器、输液器或者溶媒必须已获准注册,且注射器、输液器的灭菌有效期或者溶媒的有效期不得短于药品的有效期。
15.注册事项23和34,改变原料药产地,是指改换或增加生产药品制剂所用原料药的生产厂。国内生产药品制剂改变原料药产地的,该原料药必须具有药品批准文号或者进口药品注册证书,并提供获得该原料药的合法性资料。
16.申报注册事项1、5~10、12、15、20、21,应当对3个批号药品进行药品注册检验。申报注册事项34,应当对1个批号药品进行药品注册检验。
