细胞生物学综述
题目:干细胞是否选择分化,POU5F1蛋白是关键
专业:生物工程
年级:2010 级
姓名:高子奇
学号:01011074
干细胞是否选择分化,POU5F1蛋白是关键 干细胞也有一个“决定”过程,选择自己是变成某种特殊类型的细胞,还是继续保持“多能”的灵活性。美国布朗大学研究人员发明了一种名为MEGA转换的技术,能分析关键转录因子的相互作用,有助于再生医学研究更好地理解干细胞的“多能性”。该研究近日发表在《基因组

研究》杂志网站上。
研究显示,不同的转录因子蛋白在细胞中会竞争、合作,按照关键的DNA(脱氧核糖核酸)序列形成复杂的结合,这种分子“夺旗”的游戏(一种从敌人基地夺取旗子的户外或网络游戏)不断变换着结盟关系。保持多能性还是分化,以及分化成哪种类型,是干细胞必须面对的选择。
近几年,科学家通过“改编程序”成功地把全能细胞转化为多能干细胞,但使用这些多能细胞的动物罹患肿瘤的风险很高。另外,对于改编程序过程中某些复杂的细节,如转录因子如何与DNA相互作用,人们可能存在一些错误的认识。布朗大学的威廉姆·费尔布拉泽解释说:“大部分人认为蛋白质与DNA结合是一种表面的、独立的事件。但事实上,这些结合事件的发生牵涉到上百个核苷酸。此外,蛋白质在不同的地点结合不同的搭档,这种相互作用也使它们的功能具有多样化。”
研究小组利用名为MEGA转换的结合化验技术,分析了一段含有31.6万个字母的DNA片段中几种关键转录因子的相互作用。他们以10个碱基对的分辨率检测了数十万的序列,来研究转录因子蛋白的作用方式。
干细胞是否选择分化,POU5F1蛋白是关键。POU5F1与竞争对手POU2F1蛋白都能和一种8个字母的DNA序列相结合。但哪种蛋白先结合,会影响到一个干细胞是分化还是保持多能态。利用新技术进行的实验显示,一种名为SOX2的蛋白是决定因素,该蛋白能帮助这两种蛋白与DNA序列结合,但它对POU2F1的帮助比对POU5F1更大。他们还小范围地观察了存在于人群中的基因组序列变异和可
能导致疾病风险的基因“因果变异”。此外,他们还将MEGA转换用于其他研究,包括蛋白质之间的相互作用如何影响了RNA(核糖核酸)—蛋白质复合物的形成。
研究人员在论文中阐述了细胞外基质弹性诱导干细胞世系分化的研究的重要进展:较软的细胞外基质(Extracellular Matrix, ECM)易使整合素-基质蛋白复合物解离,从而触发整合素分子被细胞内吞,导致骨形态蛋白受体的亚细胞定位发生改变,使其下游信号通路被抑制,最终诱导干细胞向神经系分化。力学分析表明:材料的弹性变化影响了整合素-基质蛋白复合物上的加载速率,因此影响了该复合物的解离力。
英文原文:The pluripotency control regions (PluCRs) are defined as genomic regions that are bound by POU5F1, SOX2, and NANOG in vivo. We utilized a high-throughput binding assay to record more than 270,000 different DNA/protein binding measurements along incrementally tiled windows of DNA within these PluCRs. This high-resolution binding map is then used to systematically define the context of POU factor binding, and reveals patterns of cooperativity and competition in the pluripotency network. The most prominent pattern is a pervasive binding competition between POU5F1 and the forkhead transcription factors. Like many transcription factors, POU5F1 is co-expressed with a paralog, POU2F1, that shares an apparently identical binding specificity. By analyzing thousands of binding measurements, we discover context effects that discriminate POU2F1 from POU5F1 binding. Proximal NANOG binding promotes POU5F1 binding, whereas nearby SOX2 binding favors POU2F1. We demonstrate by cross-species comparison and by chromatin immunoprecipitation (ChIP) that the contextual sequence determinants learned in vitro are sufficient to predict POU2F1 binding in vivo.The inhibition of integrin
internalization blocked the neural lineage specification of BMMSCs on soft substrate.Furthermore, soft substrate also repressed the bone morphogenetic protein (BMP)/Smad pathway at least partially through integrin-regulatedBMP receptor endocytosis. A theoretical analysis based on atomic force microscopy (AFM) data indicated that
integrin–ligandcomplexes are more easily ruptured on soft substrate; this outcome may contribute to the enhancement of integrin
internalizationon soft substrate. Taken together, our results suggest that ECM elasticity affects integrin activity and trafficking to
modulateintegrin BMP receptor internalization, thus contributing to stem cell lineage specification
第二篇:细胞生物学报 综述格式
超低温保存中的氧化应激和细胞凋亡
徐 瑾 刘 芊 李秉玲 刘 燕*
(北京林业大学园林学院, 国家花卉工程技术研究中心, 北京 100083)
摘要 作为一门广泛应用于医学、水产养殖和濒危物种保护等领域的生物技术, 超低温保存已成为近年来低温生物学的研究热点之一。但到目前为止, 与超低温保存相关的机理并未得到全面的阐释, 从而使超低温保存技术在应用上受到多方面的限制。该文对近二十年来超低温保存中与氧化应激和细胞凋亡两大生理现象相关的研究做出综述, 以期为推进超低温保存技术的进步提供理论依据。 关键词 超低温保存; 氧化应激; 细胞凋亡; 细胞膜
Oxidative Stress and Apoptosis with Cryopreservation
Xu Jin, Liu Qian, Li Bingling, Liu Yan*
(College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China; National
Floriculture Engineering Research Center, Beijing 100083, China)
Abstract Cryopreservation, as a widely used biotechnology in fields such as medicine, aquaculture and endangered species protection in recent years, has become one of the research focuses in cryobiology. However, many of the molecular and biochemical mechanisms involved in this process are poorly understood, which restricts the application of cryopreservation in more biological materials. This paper reviewed the researches about oxidative stress and apoptosis with cryopreservation in the last two decades to provide a theoretical basis for promoting advances in cryopreservation.
Key words cryopreservation; oxidative stress; apoptosis; cell membrane
收稿日期: 2012-11-03 接受日期: 2013-01-05
国家自然科学基金(批准号: 30972411)资助的课题
*通讯作者。Tel: 010-62336062, E-mail: chbly@sohu.com
Received: November 3, 2012 Accepted: January 5, 2013
This work was supported by the National Natural Science Foundation of China (Grant No.30972411)
*Corresponding author. Tel: +86-10-62336062, E-mail: chbly@sohu.com
超低温保存(cryopreservation)是指将生物材料活体, 采取一定的技术, 存入–80 ℃以下的低温保存(通常为液氮–196 ℃), 需要时采取一定的方法使之回到常温并正常生长的一整套生物技术。由于在医学、农业、畜牧业及食品等相关领域有着广泛的应用前景, 超低温保存已成为近年来低温生物学的研究热点之一
[1]。近年来, 超低温保存的技术研究已趋于成熟, 除了基于低温脱水的传统的超低温保存技术外, 新兴的基于细胞内部溶质玻璃化的超低温保存技术的发展, 极大地扩充了超低温保存的应用范围[2]。超低温保存技术的发展依赖于其机制的解答, 而机制的解答也会起到指导超低温保存技术发展的作用。但是, 就目前的
1
现状而言, 超低温保存的机制研究相对滞后, 这也在一定程度上限制了超低温保存技术应用范围的进一步扩大。
近年来的研究发现, 在超低温保存中往往伴随着氧化应激和细胞凋亡两大生理现象, 这些现象是否与超低温保存密切相关, 是否会影响超低温保存的效果, 是否可以作为改进超低温保存技术的依据, 这些问题也逐渐得到了研究者的关注。本文对近二十年来超低温保存中与氧化应激和细胞凋亡两大生理现象相关的研究做出综述, 以期为推进超低温保存技术的进步提供理论依据。
1 超低温保存中的氧化应激现象
氧化应激是指由于活性氧(reactive oxygen species, ROS)过度产生和抗氧化防御机制减弱, 导致活性氧的生成和清除之间的平衡失调, 过量的活性氧引起分子、细胞和机体的损伤[3-7]。诸多的研究发现, 超低温保存往往伴随着生物材料中活性氧水平的升高, 而过多的活性氧引起的氧化应激是导致生物材料超低温保存损伤的重要原因之一。理论表明, 当活性氧的生成量大于细胞的抗氧化防御系统水平时, 过多的活性氧就会攻击脂质、蛋白质或核酸等大分子, 通过去除电子的方式, 促使其结构的修改和功能的改变, 从而导致脂质的过氧化、蛋白质的变性以及DNA或 RNA的损伤[8-10]。
Baumber[11]对马精子的超低温保存研究发现, 高水平活性氧的生成会增加DNA的片段化和减少谷胱甘肽的生成量, 并认为活性氧可能与精子获能的信号通路相关。这与Meseguer等[12]的发现存在一定的一致性——谷胱甘肽过氧化物酶1和4的表达水平及活性、谷胱甘肽浓度与人类精子超低温保存后的恢复速率相关,。Li等[13]同样在人类精子的超低温保存中发现, 保存后活性氧的生成量显著上升, 并且与冻融后精子的生存力和运动性下降等变化呈现出相关性, 因此认为超低温保存后精子质量的下降可能是由氧化应激所造成的。Zribi等[14]在人类精子的超低温保存中也发现了保存后精子的DNA片段化和氧化率显著增加的现象, 但并未对其产生机制做出解释。Thomson等[15]以8-羟化脱氧鸟苷(8-OHdG)作为生物标记, 证明了超低温保存引起的人类精子DNA片段化与氧化应激相关。
–生物材料中活性氧的种类包括了激活的单电子氧(1O2)、超氧阴离子自由基(·O2)、过氧化氢(H2O2)和羟
基自由基(·OH)等[16]。目前的研究显示, 与超低温保存相关的氧化应激可能是由羟基自由基所主导的。Fang等[16]在研究中发现, 超低温保存后伴随着可可体细胞胚的恢复, 羟基自由基产生的挥发性碳氢化合物——甲烷, 呈现出一定的周期性变化规律。更确凿的证据来自于Góes等[10]的研究, 他们将超低温保存后的山羊精子培养在4种不同的活性氧诱导机制下(分别产生激活的单电子氧、超氧阴离子自由基、过氧化氢和羟基自由基), 精子对羟基自由基显示出了高敏感性。
为了减少或消除氧化应激的影响, 抗氧化剂在超低温保存中得到了广泛的应用。抗氧化剂可以转换活性氧, 防止其过剩, 从而最大限度地提高超低温保存后细胞的存活率[17]。在众多的抗氧化剂中, 过氧化氢酶经常作为冷冻和熔融过程中的添加剂使用。研究表明, 添加过氧化氢酶可以显著减少超低温保存后人类精子[13]和马精子[11]的活性氧的生成量, 提高家猫精子的运动性和前向性[8], 并改善人类造血干细胞的粘附性和与迁移有关的属性等[18]。此外, 过氧化物歧化酶[8]、依达拉奉[19]、维他命E、维他命C、谷胱甘肽、硫辛酸、甜菜碱[9]、抗坏血酸[13]、蛋氨酸、肌醇、肉碱[20]等物质也被作为抗氧化剂应用于超低温保存中。最新的研究还显示, 精浆对于解冻后马精子[11]和山羊精子[10]的恢复更为有效: 而血小板裂解物对超低温保存后人类肝脏细胞代谢功能的恢复更为有效[21]。这可能同样是与精浆和血小板裂解物中含有抗氧化性的物质相关。
此外, 针对细胞膜的研究显示, 超低温保存会造成细胞膜的大范围破坏, 因此往往将细胞膜的完整性作为成功的超低温保存的最低标准[22]。如前所述, 氧化应激是造成超低温保存中生物材料损伤的重要原因之一。活性氧很容易氧化膜脂上的不饱和脂肪酸。脂质的过氧化一方面改变了细胞膜的结构和功能, 例如
2
通透性的升高, 另一方面它会导致二次脂质过氧化产物如醛的生成, 而醛分解后的丙二醛(MDA)又会与蛋白质、酶类和DNA链接, 进一步导致潜在的诱变[9, 16, 17]。
Martinez等[23]在甘蔗胚性愈伤组织超低温保存后的第2天观察到了电导率的升高。尚晓倩[24]在芍药花粉的超低温保存中观察到电导率随保存时间延长持续上升: 而李广清[25]在山茶花粉的超低温保存中发现花粉电导率是前期升高, 后期有出现下降趋势, 但仍高于对照。这些研究都说明超低温保存确实在一定程度上对细胞膜造成了损伤, 从而导致了细胞外电解质渗透液的增加。除了使用电导率作为细胞膜通透性的参数外, 脂质过氧化的产物丙二醛(MDA)也被用来作为检验超低温保存效果的指标。超低温保存后, 山茶花粉[25]、蜡梅花粉[26]、木薯茎尖[27]、罗氏沼虾胚胎[28]、留兰香茎尖[29]等的MDA含量均显著升高。超低温保存中氧化应激及外源抗氧化剂关系的研究进展见图1。
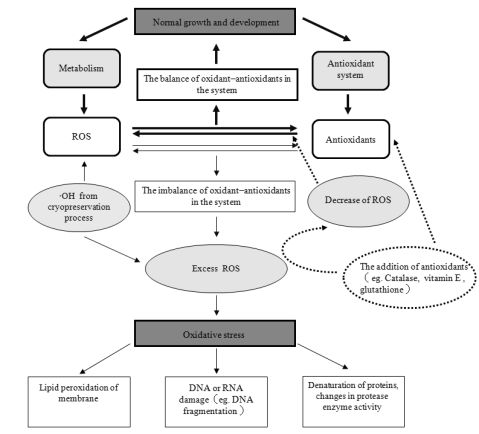
图1 超低温保存中氧化应激及外源抗氧化剂作用
Fig.1 Effect of antioxidants to the pro-oxidant/antioxidant balance in the cryopreservation
除了以上脂质过氧化的间接证据外, 研究者还证明了超低温保存对细胞膜脂类成分变化的直接影响。Blesbois等[30]发现超低温保存导致火鸡和珍珠鸡精子的细胞膜胆固醇/磷脂的比例显著下降, 并认为这种变化降低了细胞膜的流动性。Chakrabarty等[31]在山羊精子的超低温保存中发现, 总脂及其组成成分的中性脂肪、糖脂和磷脂在超低温保存后下降明显, 其中与磷脂相关的不饱和脂肪酸比例变小, 而饱和脂肪酸比例上升, 因而认为山羊精子应对超低温损伤的主要机制是通过优先脱落细胞膜中亲水性的脂质成分而增加细胞膜的疏水性进行的。Odintsova等[32]对海洋无脊椎动物幼虫细胞的研究显示, 超低温保存极大地影响了细胞膜脂肪酸的饱和度、单烯度和多烯度, 并且这种变化因保存的细胞来源和使用的冷冻保护剂而存在差异。
鉴于以上研究, 相应的细胞膜保护措施也被应用于超低温保存中, 其中通过一定的方式来增加胆固醇和不饱和脂肪酸的含量是采取的主要方式。已证明, 外援胆固醇的添加可以显著改善牛精子[33]和马精子[34]
3
超低温保存后的存活率: 而Ω-3脂肪酸可以显著提高超低温保存后不饱和脂肪酸的含量[35]。此外, 还有研究发现, 蔗糖的预培养可以使香蕉悬浮细胞超低温保存后豆甾醇/甾醇的比例, 总脂肪酸中的中性脂质、糖脂和鞘脂的成分以及游离脂肪酸酸含量显著增高, 并使中性脂肪的双键指数增加以及糖脂和鞘脂、磷脂和游离脂肪酸的双键的减少, 并提高了超低温保存后的存活率[36]。而利用毛猴素进行化学去脂, 可以显著提高猫胚胎超低温保存后的存活率、桑椹胚和胚泡的形成率[37]。这些保护措施可能都与改变细胞膜脂类成分的含量相关。
2 超低温保存中的细胞凋亡现象
超低温保存造成的细胞死亡主要有以下三种类型: 细胞破裂(与冰晶生成有关)、细胞坏死和细胞凋亡
[38]。部分研究发现, 超低温保存造成的细胞死亡具有迟发性, 进一步研究迟发性死亡的背后机制显示, 这种死亡主要是由细胞坏死和细胞凋亡这两种途径所造成的[39]。其中, 区别于细胞坏死的被动过程, 细胞凋亡作为一种与能量相关的, 由基因控制的细胞自主、有序的死亡方式, 得到了超低温保存机制研究者的广泛关注。
细胞凋亡通常会采用半胱氨酸蛋白酶活力、磷脂酰丝氨酸的外化、线粒体膜电位的改变和DNA片段化等参数进行检测[40]。Paasch等[41]比较了超低温保存对人类精子细胞凋亡参数的影响, 发现超低温保存后, 半胱氨酸蛋白酶-3、-8和-9的活性显著上升, 线粒体膜电位下降, 但DNA片段不存在显著变化。Martin等
[42-43]同样在超低温保存后的牛精子中发现线粒体膜电位的降低、半胱氨酸蛋白酶活性和细胞膜通透性升高等现象, 并检测到了细胞色素C和凋亡诱导因子这两种伴随细胞凋亡的蛋白的产生, 但没有发现DNA片段化和细胞核浓缩的显著变化。Vogel[44]通过免疫印迹技术比较了人类真皮的成纤维细胞中线粒体蛋白质Bcl-XL和Bax的比值(这两种蛋白的比值代表了细胞凋亡正向和负向的比例), 发现在超低温保存复温后比值略有升高, 在之后的6小时和12小时显著上升, 直到24小时才恢复到与对照相当的水平。Liu等[45]在比较超低温保存前后的小鼠卵巢卵泡的基因组时, 发现超低温保存诱导了凋亡基因Fas和Fas配体的表达。Park等[46]同样证明了冻融过程引起了牛囊胚细胞中与凋亡相关的生存素、Fas、热休克蛋白70和半胱氨酸蛋白酶-3基因表达量的增加。
以上研究在证明超低温保存与细胞凋亡的相关性之外, 也为如何减轻或消除细胞凋亡的影响指明了道路。半胱氨酸蛋白酶抑制剂已被证明在猪肝细胞超低温保存中降低了半胱氨酸蛋白酶-3的活性、减少线粒体中细胞色素C的释放, 减慢线粒体膜电位的下降速度, 并使肝细胞活力的功能指标——白蛋白产量、地西泮的代谢和尿素产量显著增加[47]。而在大鼠的肝细胞超低温保存中, 添加半胱氨酸蛋白酶抑制剂则显著改善了复温后6小时和24小时的肝细胞的分化能力和功能[48]。
氧化应激和细胞凋亡作为近年来超低温保存中生理现象的两大研究热点, 其本身也存在着千丝万缕的联系。研究表明, 超低温保存中出现的氧化应激不仅可以直接造成细胞损伤, 也可能诱导了细胞凋亡, 如活性氧活化核转录因子NF-KB(nuclear factor-Kappa B, NF-?B), 导致细胞凋亡; 或通过作用于线粒体介导细胞凋亡; 活性氧导致DNA损伤, 激活P53, 诱导细胞凋亡以及ROS激活SAPK通路介导细胞凋亡等[49]。
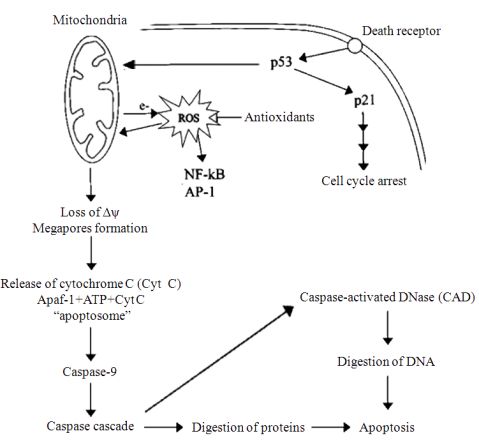
图2所示线粒体产生的活性氧介导的细胞凋亡, 可以在一定程度上反映超低温保存中细胞凋亡与氧化应激的关系。
4
图2 由线粒体产生的活性氧介导的细胞凋亡示意图(根据参考文献[50]修改)
Fig.2 Schematic representation of apoptosis which is mediated by ROS generated by
mitochondria(modified from reference [50])
3 结语和展望
超低温保存中有关氧化应激和细胞凋亡两大生理现象的研究还处于起步阶段, 本质的揭示尚需要大量的实验支持。对超低温保存中氧化应激和细胞凋亡这两大生理现象广泛和深入研究, 不仅对揭示超低温保存机制有重要的理论意义, 也将为超低温保存技术发展提供一条新的思路。
围绕该研究方向, 未来的超低温保存研究将集中在超低温保存技术中探索更多的抗氧化剂(包括酶类和非酶类)的使用效果, 从而开发新型的保护剂; 超低温保存的技术策略也会更多通过防止细胞膜氧化, 而不是仅仅关注冰晶对细胞膜的伤害展开; 超低温引起细胞凋亡的信号途径及其阻断技术也会得到深入的研究, 从而提高超低温保存材料的成活率。
参考文献 (references)
1 李秉玲. 芍药属植物超低温保存花粉的差异表达蛋白质研究及花粉库的建立(博士论文). 北京林业大学(Li Bingling. Studies on differentially expressed protein of pollen cryopreservation and cryobank construction of Paeonia spp. Beijing Forestry University) 2010.
2 Engelmann F. Plant cryopreservation: Progress and prospects. In Vitro Cell Dev Biol Plant 2004; 40(5): 427-33.
3 武 强, 刘郑荣. 慢性肾功能不全病人中的氧化应激现象观察. 实用医学杂志(Wu Qiang, Liu Zhengrong. The Journal of Practical Medicin) 2004(10): 1160-1.
4 龚 伟, 唐 政. 氧化应激和抗氧化治疗在慢性肾功能衰竭和高血压中的作用. 肾脏病与透析肾移植杂志(Gong Wei, Tang Zheng. Chinese Journal of Nephrology, Dialysis & Transplantation) 2005(3): 254-8.
5
5 Sohal RS, Weindruch R. Oxidative stress, caloric restriction, and aging. Science 1996; 273(5271): 59-63.
6 Beatty S, Koh H, Phil M, Henson D, Boulton M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Surv Ophthalmol 2000; 45(2): 115-34.
7 Sies H. Oxidative stress: Oxidants and antioxidants. Exp Physiol 1997; 82(2): 291-5.
8 Elkins EC. Cryopreservation of domestic cat (felis catus) epididymal spermatozoa in the presence of antioxidants. The American University, 2006.
9 Uchendu EE. Cryopreservation of shoot tips: Antioxidant investigations with Rubus and protocols for Mentha and Vaccinium. Oregon State University, 2009.
10 Goes PA, Nichi M, Silva RO, Perez EG, Dalmazzo A, Gurgel JR, et al. Influence of cryopreservation on the susceptibility of goat sperm against different reactive oxygen species. Reprod Fertil Dev 2011; 23(1): 143.
11 Baumber J. Reactive oxygen species and. Equine sperm function. University of California, 2003.
12 Meseguer M, Garrido N, Simon C, Pellicer A, Remohi J. Concentration of glutathione and expression of glutathione peroxidases 1 and 4 in fresh sperm provide a forecast of the outcome of cryopreservation of human spermatozoa. J Androl 2004; 25(5): 773-80.
13 Li Z, Lin Q, Liu R, Xiao W, Liu W. Protective effects of ascorbate and catalase on human spermatozoa during cryopreservation. J Androl 2010; 31(5): 437-44.
14 Zribi N, Feki Chakroun N, El Euch H, Gargouri J, Bahloul A, Ammar Keskes L. Effects of cryopreservation on human sperm deoxyribonucleic acid integrity. Fertil Steril 2010; 3(1): 159-66.
15 Thomson LK, Fleming SD, Aitken RJ, De Iuliis GN, Zieschang JA, Clark AM. Cryopreservation-induced human sperm DNA damage is predominantly mediated by oxidative stress rather than apoptosis. Hum Reprod 2009; 24(9): 2061-70.
16 Fang J, Wetten A, Johnston J. Headspace volatile markers for sensitivity of cocoa (Theobroma cacao L.) somatic embryos to cryopreservation. Plant Cell Rep 2008; 27(3): 453-61.
17 Luz HKM, Wanderley LS, Faustino LR, da Silva CMG, de Figueiredo JR, Rodrigues APR. Role of antioxidants agents in germ cells and embryos cryopreservation. Acta Sci Vet 2011; 39(2): 956.
18 Sasnoor LM, Kale VP, Limaye LS. A combination of catalase and trehalose as additives to conventional freezing medium results in improved cryoprotection of human hematopoietic cells with reference to in vitro migration and adhesion properties. Transfusion 2005; 45(4): 622-33.
19 段永壮, 钟世镇, 王增涛, 徐达传, 丁自海, 付庆林, 等. 依达拉奉对深低温冻存大鼠断肢再植后缺血再灌注损伤骨骼肌细胞膜及线粒体的保护效应(英文). 中国组织工程研究与临床康复(Duan Yongzhuang, Zhong Shizhen, Wang Zengtao, Xu Dachuan, Ding Zihai, Fu Qinglin, et al. Protective influence of edaravone on cellular membrane and mitochondria of replanted rat extremities following ischemia/reperfusion injury due to cryopreservation and rewarming. Journal of Clinical Rehabilitative Tissue Engineering Research) 2007; 11(25): 5032-5.
20 Bucak MN, Tuncer PB, Sariozkan S, Baspinar N, Taspinar M, Coyan K. Effects of antioxidants on post-thawed bovine sperm and oxidative stress parameters: Antioxidants protect DNA integrity against cryodamage. Cryobiology 2010; 61(3): 248-53.
21 Tolosa L, Bonora-Centelles A, Teresa Donato M, Mirabet V, Pareja E, Negro A. Influence of platelet lysate on the recovery and metabolic performance of cryopreserved human hepatocytes upon thawing. Transplantation 2011; 91(12): 1340-6.
22 Tchir J, Acker JP. Mitochondria and membrane cryoinjury in micropatterned cells: Effects of cell-cell interactions. Cryobiology 2010; 61(1): 100-7.
23 Martinez-Montero ME, Mora N, Quinones J, Gonzalez-Arnao MT, Engelmann F, Lorenzo JC. Effect of cryopreservation on the structural and functional integrity of cell membranes of sugarcane (Saccharum sp.) embryogenic calluses. Cryo Letters 2002; 23(4): 237-44.
24 尚晓倩. 芍药花粉超低温保存研究(硕士论文). 北京林业大学(Shang Xiaoqian. Sutdies on cyropresevration of peony pollen.
6
Beijing Forestry University), 2005.
25 李广清. 山茶花粉超低温保存研究(硕士论文). 北京林业大学(Li Guangqing. Sutdies on cyropresevration of Camellia pollen. Beijing Forestry University), 2005.
26 陈 珊. 蜡梅属植物花粉低温及超低温保存研究(硕士论文). 华中农业大学(Chen Shan. Studies on pollen cold storage and cryopreservation of Chimonanthus. Central China Agricultural University), 2005.
27 陈志林. 木薯种质超低温保存及其再生植株遗传稳定性的研究(硕士论文). 华南热带农业大学(Chen Zhilin. Studies on Cassava germplasm cryopreservation and genetic stability of its regenerated plant. South China University of Tropical Agriculture), 2007.
28 黄晓荣, 章龙珍, 庄 平, 江 琪, 姚志峰, 刘鉴毅, 等. 超低温保存对罗氏沼虾胚胎几种酶活性的影响. 海洋渔业(Huang Xiaorong, Zhang Longzhen, Zhuang Ping, Jiang Qi, Yao Zhifeng, Liu Jianyi, et al. Effects of cryopreservation on enzyme activity in embryo of Macrobrachium rosenbergii. Marine fisheries) 2010; 2: 166-71.
29 邵 丽. 留兰香种质材料的超低温保存及遗传变异分析(硕士论文). 河南大学(Shao Li. Cryopreservation of Mentha Spicata L. germplasm and analysis of genetic variation. Henan University), 2011.
30 Blesbois E, Grasseau I, Seigneurin F. Membrane fluidity and the ability of domestic bird spermatozoa to survive cryopreservation. Reproduction 2005; 129(3): 371-8.
31 Chakrabarty J, Banerjee D, Pal D, De J, Ghosh A, Majumder GC. Shedding off specific lipid constituents from sperm cell membrane during cryopreservation. Cryobiology 2007; 54(1): 27-35.
32 Odintsova NA, Boroda AV, Velansky PV, Kostetsky EY. The fatty acid profile changes in marine invertebrate larval cells during cryopreservation. Cryobiology 2009; 59(3): 335-43.
33 Purdy PH. Cholesterol supplementation of bovine sperm. Colorado State University, 2003.
34 Moore AI. Effects of cholesterol supplementation on the cryosurvival of equine spermatozoa. Colorado State University, 2005. 35 Harris MA. The influence of omega-3 fatty acid supplementation on stallion spermatozoa survival following short- and long-term preservation. The University of Arizona, 2005.
36 Zhu G, Geuns JM, Dussert S, Swennen R, Panis B. Change in sugar, sterol and fatty acid composition in banana meristems caused by sucrose-induced acclimation and its effects on cryopreservation. Physiol Plant 2006; 128(1): 80-94.
37 Tharasanit T, Techakumphu M. The effect of chemical delipidation on cryopreservability of cat embryos. Reprod Fertil Dev 2011; 23(1): 153.
38 Mukherjee IN. A rational design approach for the cryopreservation of natural and engineered tissues. Georgia Institute of Technology, 2008.
39 Robilotto AT. Calpain activation following cryopreservation: an initial investigation into their roles in cell death and cell adhesion. State University of New York at Binghamton, 2005.
40 Said TM, Gaglani A, Agarwal A. Implication of apoptosis in sperm cryoinjury. Reprod Biomed Online 2010; 21(4): 456-62. 41 Paasch U, Sharma RK, Gupta AK, Grunewald S, Mascha EJ, Thomas AJ, et al. Cryopreservation and thawing is associated with varying extent of activation of apoptotic machinery in subsets of ejaculated human spermatozoal. Biol Reprod 2004; 71(6): 1828-37. 42 Martin G, Sabido O, Durand P, Levy R. Cryopreservation induces an apoptosis-like mechanism in bull sperm. Biol Reprod 2004; 71(1): 28-37.
43 Martin G, Cagnon N, Sabido O, Sion B, Grizard G, Durand P, et al. Kinetics of occurrence of some features of apoptosis during the cryopreservation process of bovine spermatozoa. Hum Reprod 2007; 22(2): 380-8.
44 Vogel MJ. Proteomic profiling following cryopreservation. State University of New York at Binghamton, 2005.
45 Liu HC, He ZM, Rosenwaks Z. Mouse ovarian tissue cryopreservation has only a minor effect on in vitro follicular maturation and gene expression. J Assist Reprod Genet 2003; 20(10): 421-31.
46 Park SY, Kim EY, Cui XS, Tae FC, Lee WD, Kim NH, et al. Increase in DNA fragmentation and apoptosis-related gene
7
expression in frozen-thawed bovine blastocysts. Zygote 2006; 14(2): 125-31.
47 Matsushita T, Yagi T, Hardin JA, Cragun JD, Crow FW, Bergen HR, et al. Apoptotic cell death and function of cryopreserved porcine hepatocytes in a bioartificial liver. Cell Transpl 2003; 12(2): 109-21.
48 Fujita R, Hui T, Chelly M, Demetriou AA. The effect of antioxidants and a caspase inhibitor on cryopreserved rat hepatocytes. Cell Transplant 2005; 14(6): 391-6.
49 褚启龙. 氧化应激与细胞凋亡关系的研究进展. 卫生研究(Chu Qilong. Research progress on oxidative stress and apoptosis. Journal of Hygiene Research) 2003; 3: 276-79.
50 Salganik RI. The benefits and hazards of antioxidants: controlling apoptosis and other protective mechanisms in cancer patients and the human population. J Am Coll Nutr 2001; 20(5 Suppl): 464S-72S, 473S-5S.
8
