初三化学上学期知识点
一、物质的性质、变化和质量守恒定律
1、两种性质
物理性质:物质不需要发生化学变化就表现出来的性质 例如:色态味、熔沸点、硬度、密度、导电性、溶解性、挥发性、吸附性(活性炭、木炭有吸附性)等
化学性质: 物质在化学变化中表现出来的性质 可燃性、氧化性、还原性、酸性、碱性、稳定性等
2、两种变化:本质区别:是否有新物质生成。
物理变化:这种没有生成其他物质的变化 三态变化、挥发、吸附、蒸发、蒸馏、分馏、电灯发光、轮胎爆炸、工业分离液态空气制氧气等
化学变化:这种生成其他物质的变化 燃烧、生锈、氧化、火药爆炸、呼吸、光合作用、风化、干馏等
化学变化的基本特征是有其他物质生成;常表现为颜色改变;放出气体;生成沉淀
3、质量守恒定律
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
化学反应前后五个不变:物质总质量、元素种类、原子种类、原子数目、原子质量不变。
 4、化学反应的基本反应类型: 化合反应:A + B + …… → M
4、化学反应的基本反应类型: 化合反应:A + B + …… → M
分解反应:M → A + B + ……
氧化还原反应:
还原剂是得氧的物质:具有还原性--被氧化--发生氧化反应
氧化剂是失氧的物质:具有氧化性—被还原—发生还原反应
常作还原剂的物质有:H2 CO C和金属单质
二、物质的组成和构成
(一)分子和原子
1.分子的定义:分子是保持物质化学性质的一种微粒。
2、分子的性质: (1)分子很小
(2)分子之间有间隙
(3)分子在不断运动
(4)同种分子性质相同,不同种分子性质不同。
3、原子的定义:原子是化学变化中最小的微粒
4、原子的性质:同分子的性质一样
5、分子和原子的区别:在化学变化中分子可以再分,原子不能再分。
分子和原子的联系:分子和原子都能直接构成物质,分子只能由原子构成。
(二)元素
1、元素和原子团化合价:-2硫酸根SO4 、-2碳酸根CO3 、-1价硝酸根NO3、
-1氢氧根OH 、+1铵根NH4、
2、元素只讲种类,不讲个数。
例:二氧化碳由碳元素和氧元素组成
 3、元素的存在形态: 游离态 存在于单质中
3、元素的存在形态: 游离态 存在于单质中
化合态 存在于化合物中
4、 元素的分布:地壳中含量占前三位的是:氧(O)、硅(Si)、铝(Al)。
地壳中含量最多的金属元素是:铝(Al)
人体中含量最多的元素是:氧。
人体中含量最多的金属元素是:钙
人体中含量最多的物质是:水
大气中含量最多的元素是:氮元素
生命的基础元素是:碳
5、同素异形体:同种元素组成的不同单质。
碳元素的同素异形体:金刚石(C)、石墨(C)和C60
氧元素的同素异形体:氧气(O2)和臭氧(O3)
6、元素符号.化学式的意义
元素符号: 表示一种元素 ; 表示该元素的一个原子
 例: O:表示氧元素 ;表示一个氧原子
例: O:表示氧元素 ;表示一个氧原子
nO:表示 n 个氧原子 注:符号前加数字只具有微观意义
金属元素和稀有气体元素符号:表示一种元素;表示该元素的一个原子;还表示该元素的游离态单质
化学式:表示一种物质;表示一种分子;表示该物质的宏观组成;表示该分子的微观构成
 O2 :表示氧气;表示一个氧分子;表示氧气由氧元素组成;表示一个氧分子由两个氧原子构成
O2 :表示氧气;表示一个氧分子;表示氧气由氧元素组成;表示一个氧分子由两个氧原子构成
H2O : 表示水;表示一个水分子;表示水由氧元素.氢元素组成;表示一个水分子由两个氢原子和一个氧原子构成。
 2O2 : 表示 2个氧分子
2O2 : 表示 2个氧分子
2H2O : 表示2 个水分子 注:符号前加数字只具有微观意义
典型数字意义
3O2 : “3” 表示3个氧分子 “2” 表示1个氧分子里有2个氧原子。
5H2O: “5” 表示5个水分子. “2” 表示1个水分子中有2个氢原子。
三、物质的分类
 1、 混合物:由两种或多种物质混合而成。 ( 注:各物质相互不发生反应)
1、 混合物:由两种或多种物质混合而成。 ( 注:各物质相互不发生反应)
纯净物:由一种物质组成。
 混合物:由不同种分子构成 (注:由分子构成的物质)
混合物:由不同种分子构成 (注:由分子构成的物质)
纯净物:由同种分子构成
例如: 纯净物:水、蒸馏水、冰水混合物、液氧、酒精、无水酒精、胆矾、石碱、等
混合物:空气、自来水、煤、石油、天然气、水煤气、大理石、石灰石、消毒酒精、生理盐水、碘酒、盐酸、所有的溶液和浊液等
 2、 单质: 由同种元素组成的纯净物
2、 单质: 由同种元素组成的纯净物
化合物:由不同种元素组成的纯净物
氧化物: 由两种元素组成的化合物,其中一种是氧元素。如水、MgO、CO2、Fe2O3等。
四、物质知识
(一)、空气
(1)空气质量报告中的污染指数包括:可吸入颗粒物、二氧化硫和二氧化氮
引起温室效应的主要气体是二氧化碳,引起酸雨的主要气体是二氧化硫。
 氮气(N2)78%
氮气(N2)78%
氧气(O2)21%
(2)空气的组成及体积百分含量 稀有气体(氦气He、氖气Ne、氩气Ar) ( 0.94% )
二氧化碳 (0.03% )
水蒸气及其他杂质 ((0.03% )
(3)最早用实验验证空气组成的科学家是拉瓦锡
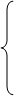 (4)用红磷燃烧来验证空气中氧气的体积分数(原因是:红磷在空气中能消耗掉氧气且生成的产物是固体。)实验现象:红磷燃烧产生大量白烟,打开止水夹后,水倒流入广口瓶且体积约占广口瓶的1/5。 装置漏气
(4)用红磷燃烧来验证空气中氧气的体积分数(原因是:红磷在空气中能消耗掉氧气且生成的产物是固体。)实验现象:红磷燃烧产生大量白烟,打开止水夹后,水倒流入广口瓶且体积约占广口瓶的1/5。 装置漏气
若实验后测得水的体积小于1/5的原因 红磷不足,氧气未消耗完。
装置未冷却到室温就打开夹子
(二)、水 通电
(1)电解水 2H2O → 2H2↑+O2↑ (正极产生氧气,负极产生氢气)
现象:两电极产生气泡,
V正极:V负极=1:2
水的组成:水是由氢元素和氧元素组成的。
氢气的验证方法:点燃,在火焰上方罩一个干冷烧杯,气体燃烧,有淡蓝色火焰,烧杯壁上有小液滴生成。
(2)除水用浓硫酸,检验水用无水硫酸铜,看白色粉末是否变蓝。
除水放最后除,检验水放前面检验
(3)二氧化碳通入紫色石蕊溶液:CO2+H2O→H2CO3 紫色石蕊变红。
加热:H2CO3 H2O+CO2↑石蕊又变成紫色。
H2O+CO2↑石蕊又变成紫色。
检验水的反应原理:CuSO4 + 5H2O→CuSO4·5H2O白色粉末变蓝。
生石灰投入水: CaO+H2O→Ca(OH)2 放出热量
向反应后的液体中滴入无色酚酞,无色酚酞变红。
(4)水的特性:反常膨胀、比热容大、分散性
(5)水的净化步骤:过滤、吸附(明矾)、消毒(Cl2)
(三)、氧气.
(1)氧气的物理性质:无色无味气体,密度比空气,.不易溶于水。液氧.固氧为淡蓝色
(2)化学性质:氧化性(助燃性)
木炭完全燃烧:C+O2  CO2 发出白光,放热,生成的气体使澄清石灰水变浑浊。
CO2 发出白光,放热,生成的气体使澄清石灰水变浑浊。
木炭不完全燃烧:2C+O2  2CO
2CO
红磷燃烧:4P+5O2  2P2O5 产生大量白烟
2P2O5 产生大量白烟
白磷自燃:4P+5O2  2P2O5
2P2O5
铁丝在氧气中燃烧:3Fe+2O2  Fe3O4 火星四射,放热,生成黑色固体。
Fe3O4 火星四射,放热,生成黑色固体。
硫燃烧:S+O2 SO2
SO2
在空气中:发出淡蓝色火焰,放热,生成具有刺激性气味的气体;
在氧气中:发出蓝紫色火焰,放热,生成具有刺激性气味的气体。
镁带燃烧:2Mg+O2  2MgO 发出耀眼白光,放热,生成白色粉末。
2MgO 发出耀眼白光,放热,生成白色粉末。
三种可燃性气体的燃烧: 2H2+O2  2H2O
2H2O
2CO+O2  2CO2
2CO2
CH4+2O2  CO2+2H2O
CO2+2H2O
(3)氧气的制法:
 实验室制法 :
2KClO3
实验室制法 :
2KClO3
 2KCl+3O2↑
2KCl+3O2↑
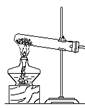
(1).装置注意事项:①酒精灯用外焰加热 ②试管口略向下倾斜---防止冷凝水倒流入管底使试管破裂 ③铁夹应夹在距试管口1/3处 ④导管伸入试管内1--2厘米
③铁夹应夹在距试管口1/3处 ④导管伸入试管内1--2厘米
(2)实验步骤:①连接装置 ②检查气密性 ③装入药品 ④固定装置 ⑤加热 ⑥收集气体
⑦先将导管从水中取出 ⑧后熄灭酒精灯 (防止水倒流,使试管破裂。)


 2H2O2 → 2H2O+O
2↑
2H2O2 → 2H2O+O
2↑

MnO2 在两个反应中都作催化剂,起催化作用
催化剂:改变物质的反应速度,而本身的质量和化学性质保持不变。
 氧气的收集方法 向上排空气法----氧气比空气重
氧气的收集方法 向上排空气法----氧气比空气重
排水法----氧气不易溶于水
氧气的检验:用带火星的木条伸入瓶内,看是否复燃。
氧气的验满:用带火星的木条放在瓶口,看是否复燃。
工业制法:分离液态空气(物理变化)
(四)、二氧化碳:
1、二氧化碳的工业制法:高温煅烧石灰石CaCO3 CaO + CO2↑
CaO + CO2↑
2、二氧化碳的实验室制法:大理石与稀盐酸CaCO3+2HCl→CaCl2+H2O+CO2↑(不能用碳酸钙粉末代替大理石,因为反应速度太快不利于收集;不能用硫酸代替稀盐酸,因为生成微溶于水的硫酸钙阻碍反应进一步发生,只能得到少量二氧化碳。不能用浓盐酸,因为浓盐酸具有挥发性,导致收集到的二氧化碳不纯。)
装置 ①.长颈漏斗插到液面以下 防止生成气体从长颈漏斗逸出

 ②.导管伸入试管1-2cm 防止难于收集气体
②.导管伸入试管1-2cm 防止难于收集气体
③.导气管伸到集气瓶底部
3、 二氧化碳的收集方法:只能用向上排气法(二氧化碳密度比空气大且能溶于水)
4、二氧化碳的检验方法:通入澄清石灰水CO2+Ca(OH)2→CaCO3↓+H2O,能使石灰水变浑浊。
5、 二氧化碳的验满方法: 用燃着的木条放在瓶口,观察,如熄灭说明已收集满了。
6、二氧化碳的化学性质:不助燃也不可燃;
能使石灰水变浑浊CO2+Ca(OH)2→CaCO3↓+H2O;
能使石蕊溶液变红色CO2+H2O→H2CO3(与水反应生成碳酸,碳酸呈酸性);加热溶液后溶液从红色变回紫色H2CO3 H2O+CO2↑(碳酸不稳定受热易分解);加入活性炭后溶液变无色(活性炭具有吸附性)。
H2O+CO2↑(碳酸不稳定受热易分解);加入活性炭后溶液变无色(活性炭具有吸附性)。
镁带能在二氧化碳中燃烧2Mg+CO2  2MgO+C;
2MgO+C;
二氧化碳通过灼热的炭层会转化成一氧化碳。CO2+C 2CO
2CO
7、用途: 灭火; 干冰(固体二氧化碳) 致冷剂.人工降雨
8、除去二氧化碳中含有的少量一氧化碳,实验方法为:混合气体通过灼热的氧化铜。
除去一氧化碳中含有的少量二氧化碳,实验方法为:混合气体通过足量的澄清石灰水。
(五)、碳、一氧化碳、氢气:
1、古代字画可以保留至今说明单质碳在常温下具有稳定性。
2、自然界中的单质碳有金刚石与石墨等他们互为碳元素的同素异形体。( 由同一种元素组成不同单质的现象称为同素异形现象。例红磷与白磷;氧气与臭氧)
3、一氧化碳具有毒性,能与人体血液中的血红蛋白结合使人窒息死亡
4、碳、一氧化碳、氢气具有相似的化学性质:可燃性与还原性。
C+O2  CO2;2CO+O2
CO2;2CO+O2  2CO2 ;2H2+O2
2CO2 ;2H2+O2  2H2O
2H2O
C+2CuO 2Cu+CO2↑(CO2+C
2Cu+CO2↑(CO2+C 2CO)
2CO)
 CO+CuO
CO+CuO Cu+CO2 尾气处理(一氧化碳有毒性,为防空气污染把它点燃)现象
Cu+CO2 尾气处理(一氧化碳有毒性,为防空气污染把它点燃)现象
H2+CuO Cu + H2O氢气要检验纯度(听爆鸣声,越轻越纯)
Cu + H2O氢气要检验纯度(听爆鸣声,越轻越纯)
这两个实验在操作中还要注意——气体早出(排尽装置中的空气,防爆)晚归(防止生成的热铜与空气中的氧气反应再次被氧化)
5、化学反应中,元素化合价有变化的反应属于氧化还原反应
6、氧化剂是失氧的物质,具有氧化性,被还原,发生了还原反应;还原剂是得氧的物质,具有还原性,被氧化,发生了氧化反应;常见的还原剂有氢气、一氧化碳与碳
(六)、燃料与燃烧:
1、 燃烧三要素:可燃物的温度达到着火点,与氧气接触
2、 煤的加工方法叫干馏。是一种化学变化;石油的加工方法叫分馏。是一种物理变化。
3、 管道煤气的主要成分为::一氧化碳、氢气与甲烷。(如何鉴别这三种气体:点燃后将产物依次通过硫酸铜粉末与澄清石灰水)
 2CO+O2
2CO+O2  2CO2 ; 检验产物:
2CO2 ; 检验产物:
2H2+O2  2H2O ; CuSO4 + 5H2O→CuSO4·5H2O
2H2O ; CuSO4 + 5H2O→CuSO4·5H2O
CH4+2O2  CO2+2H2O CO2+Ca(OH)2→CaCO3↓+H2O
CO2+2H2O CO2+Ca(OH)2→CaCO3↓+H2O
4、 天然气的主要成分是甲烷
5、 可燃性气体与氧气混合后可能引起爆炸。(气体的爆炸浓度范围叫爆炸极限)
6、燃料充分燃烧的方法
五、溶液:
1、三类分散系的特征:都是混合物
悬浊液:与水不互溶的固体小颗粒分散在水中(泥浆、石灰乳等)
乳浊液:与水不互溶的小液滴分散在水中(油水、牛奶等)
溶液:均一、稳定的混合物(盐酸、石灰水等)
2、 被溶解的物质
被溶解的物质
溶质 结晶水合物的无水部分
溶液的组成 反应后的产物
 溶剂
溶剂
说明:溶液的组成:溶质与溶剂(石灰水中溶质氢氧化钙,盐酸中的溶质氯化氢气体,碘酒中的溶质碘,消毒酒精中的溶质酒精)
*物质溶于水:形成溶液中的溶质有三种情况a被溶解的物质b结晶水合物的无水部分(可通过无水部分在结晶水合物中的百分含量进行计算)c反应后的产物,例如生石灰溶于水后形成的溶液溶质为氢氧化钙。
3、影响溶解度的因素:
固体溶质:温度越高,固体溶解度越大(除熟石灰);
气体溶质:温度越高,气体溶解度越小。气压越大,气体的溶解度越大。
4、 加溶剂、升高温度

 饱和溶液 不饱和溶液
饱和溶液 不饱和溶液
加溶质、蒸发溶剂、降温
特例:使不饱和的石灰水转化成饱和溶液可采用的方法:加熟石灰、加生石灰、蒸发水、升温。
*使饱和石灰水转化成不饱和石灰水的方法:加水、降温、通入少量二氧化碳。
5、 蒸发结晶(适用于溶解度受温度影响变化小的物质如食盐)
蒸发结晶(适用于溶解度受温度影响变化小的物质如食盐)
结晶,
冷却结晶(适用于溶解度受温度影响变化大的物质如硝酸钾)
说明:结晶后剩余溶液是饱和溶液,因此恒温蒸发结晶后,溶质与溶剂的质量变小,剩余饱和溶液的溶质的质量分数不变;冷却结晶后的溶液,溶质变小,一般溶剂的质量不变(如果结晶得到结晶水合物则溶剂也减少),剩余饱和溶液的溶质的质量分数变小。
6、结晶水合物:胆矾(蓝矾)CuSO4·5H2O受热会分解、石碱Na2CO3·10H2O会风化。
CuSO4·5H2O CuSO4 + 5H2O
CuSO4 + 5H2O
7、溶解度的计算公式:
8、溶质的质量分数计算公式


溶质的质量分数= ╳100% (饱和.不饱和溶液)

溶质的质量分数= ╳ 100% (饱和溶液)

 9、溶液的配置:计算 、 称量 、 溶解;
9、溶液的配置:计算 、 称量 、 溶解;
仪器:托盘天平、药匙(浓溶液配稀溶液则不需这两样)、量筒、胶头滴管、烧杯、玻璃棒。
第二篇:初三化学(下册)重点知识点总结
第8单元 金属和金属材料
课题1 金属材料
一、金属和合金
1、金属的物理性质:常温下都是固体(汞除外),大多数为银白色,有金属光泽、优良的导电导热性、有延展性,密度、硬度较大,熔点较高。
2、性质与用途的关系:性质决定用途,但这不是唯一的决定因素,还要考虑价格、资源、美观、便利、回收以及对环境的影响。
3、合金
(1)合金是金属和其他金属(或非金属)熔合形成的具有金属特性物质。(合金属于混合物。)
(2)合金的性能与纯金属不同,硬度和强度一般比纯金属更高,抗腐性也更强。 (3)生铁和钢是两种常见的铁合金。
它们的根本区别是含碳量不同。
课题2 金属的化学性质
一、金属的化学性质
1、与氧气反应(很多金属在常温或高温下能和氧气反应,但剧烈和难易程度不同) ① 2Mg + O2 == 2 MgO
②4Al + 3O2 ==2 Al2O3 (氧化铝是致密的保护膜,能阻止铝被进一步氧化,所以铝具有很好的抗腐蚀性能)
③2Cu + O2 == 2CuO
2、活泼金属与稀酸反应(指稀盐酸和稀硫酸),能转换出酸中的氢。
①Fe +2 HCl == FeCl2 + H2 ↑
② Mg +2HCl ==MgCl2 + H2 ↑
③ 2Al +3H2SO4==Al2(SO4)3 +3H2↑
3、金属和盐(可溶性盐)的反应
①Fe +CuCl2 == FeCl2 + Cu
② Mg +ZnCl 2==MgCl2 + Zn ↑
③ 2Al +3CuSO4==Al2(SO4)3 + 3Cu
二、金属活动性顺序与置换反应
1、金属活动性顺序表注意点:
①金属位置越靠前,活动性越强;反之越弱。
②位于氢前的金属能置换出酸中的氢,氢后的则不能。
③位于前面的金属能把位于后面的金属从它们的盐(溶液)中置换出来。
2、置换反应:单质+化合物=单质+化合物(A + BC == B + AC)
单元3 金属资源的利用和保护
一、金属矿物:
1、金属在自然界的存在方式:以单质(Ag和Au)和化合物的形式存在。 2、常见的金属矿物:磁铁矿(Fe3O4)、赤铁矿(Fe2O3)
二、金属的冶炼:(以CO还原Fe2O3为例)
1、实验原理: Fe2O3 + 3CO==2Fe + 3CO2
2、实验现象:红色粉末变黑色;澄清石灰水变浑浊;尖嘴玻璃管有淡蓝色火焰。 3、含杂计算:将混合物质量转换成纯净物再计算。(纯净物质量=混合物质量×质量分数)
三、金属资源的保护
1、铁生锈条件:铁制品与空气、水(或水蒸气)同时接触。
2、防止铁生锈的措施:在铁制品表面涂油、刷漆、镀耐磨耐腐蚀的铬或制造耐腐蚀的合金等。
3、保护措施:①防止金属腐蚀; ②回收利用废旧金属;
③合理有效地开采矿物;④寻找金属代用品;
第九单元 溶液
课题1 溶液的形成
一、溶液的形成
1、溶液:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液。
①均一:各部分性质、浓度、密度、色泽等相同。
②稳定:当水分不蒸发、温度不变化时,溶液不分层、不沉淀。
溶质:被溶解的物质(可以是气体、液体和固体)。
溶剂:能溶解其它物质的物质(常见的溶剂:水、酒精、汽油;溶液中有水存在时,一般把水作为溶剂;)
2、能区分溶液中的溶质、溶剂(如:碘酒、糖水、生理盐水、高锰酸钾的水溶液、石灰水);
3、知道溶液、溶质、溶剂之间的质量关系(溶液质量=溶质质量+溶剂质量)及质量比。
4、知道生活中的一些常见的乳浊液:小液滴分散到液体里形成的混合物。(不属于溶液)
生活中常见的乳化现象:如:肥皂漂洗衣服、洗洁精洗碗筷、牛奶、农药等。
二、饱和溶液和不饱和溶液
1、 在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液是饱和溶液;反之为不饱和溶液。
2、 饱和溶液和不饱和溶液之间的转换:
①增加溶质;②蒸发溶剂;③降低温度;
①增加溶剂;②升高温度;
结晶:已溶解在溶液中的溶质从溶液中以晶体的形式析出的现象,叫做结晶。(结晶
和溶解都属于物理变化)。(结晶方法:蒸发结晶和降温结晶)
三、物质溶解与温度的关系
⑴酸碱溶于水,放出热量,温度上升;如:硫酸、氢氧化钠等。
⑵绝大多数的盐溶于水,吸收热量,温度下降;如:硝酸钾、氯化铵等。 ⑶蔗糖、食盐溶于水温度不变。
课题2 溶解度
一、溶解度
1、 概念:在一定的温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。2、注意点:①指明温度:一定的温度;②溶剂量:100克;③状态:饱和;④单位:克。
3、溶解度曲线:物质的溶解度随温度变化的曲线叫溶解度曲线。
3、 该曲线可表示如下信息:
① 某物质在某一温度下的溶解度;
② 同种物质在不同温度下的溶解度;
③ 不同物质在同一温度下的溶解度;
④ 太多数物质的溶解度随温度的升高而增大。如:KNO3、NH4Cl、NH4NO3等; 少数物质的溶解度随温度的升高而减小.如Ca(OH)2;
少数物质的溶解度受温度的影响不大.如:NaCl。
5、气体的溶解度:指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。※气体的溶解度与压强、温度有关:随温度升高而减小,随压强增大而增大。
二、溶质的质量分数
1、溶液中溶质的质量分数是溶质质量和溶液质量之比。
即:
(变式:溶质质量=溶液质量×质量分数)
2、有关计算:
①已知溶质及溶剂的质量,求溶质的质量分数;
②要配制一定量的溶质的质量分数一定的溶液,计算所需溶液和溶剂的量; ③稀释溶液的计算(稀释前后,溶质的质量分数不变);
m(浓液)×m(浓)% = m(稀液)×m(稀)%
④把质量分数运用于化学方程式的计算。
3、配制溶质质量分数一定的溶液的步骤
⑶ 计算:计算溶质和溶剂的质量;
⑷ 称量:用天平称量所需溶质倒入烧杯中;
⑸ 量取:用量筒量取所需的水,倒入烧杯,用玻璃棒搅拌;
⑹ 溶解:把配好的溶液倒入试剂瓶中,盖好瓶塞并贴上标签。
第10单元 酸和碱
课题1 常见的酸和碱
1、H2SO4 、HCl 、HNO3、 H2CO3 等。 酸:由H+和酸根离子构成的化合物。如:
2、KOH 、 NaOH 、 Ca(OH)2、 Al(OH)3碱:由OH-和金属离子构成的化合物。如:
等。
3、酸碱指示剂:紫色石蕊和无色酚酞能使酸碱溶液显不同的颜色,叫做酸碱指示剂。可用于检验酸碱溶液。①石蕊遇酸变红色,遇碱变蓝色;②酚酞遇酸不变色,遇碱变红色。
一、常见的酸
1、盐酸(HCl):①物性:无色有刺激性气味、易挥发的液体(打开瓶盖在空气中形成白雾、质量减轻、质量分数减小);②用途:除锈、制药、胃酸帮助消化等。 2、硫酸(H2SO4):
①物性:无色无味、粘稠油状液体,不易挥发,具有吸水性(打开瓶盖,能吸收空气中的水蒸气、质量增加、浓度减小)。
②用途:作干燥剂;制化肥、农药等;金属除锈
③腐蚀性(脱水性):夺取物质中的水分,生成黑色的碳。
④稀释:一定要把浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。切不可将水倒进浓硫酸里。
二、酸的通性(酸的化学性质)
1、能使酸碱指示剂显不同的颜色。(石蕊遇酸变红色,酚酞遇酸不变色) 2、和活泼金属(H前金属)反应,生成盐和H2。
①Fe +2 HCl == FeCl2 + H2 ↑
② Mg +2HCl ==MgCl2 + H2 ↑
③ 2Al +3H2SO4==Al2(SO4)3 +3H2↑
3、和某些金属氧化物反应,生成盐和水。
①Fe2O3 +6HCl ==2FeCl3 +3H2O
②Al 2O3+6HCl ==2AlCl3 +3H2O
③CuO+H2SO4==CuSO4 +H2O
三、常见的碱
1、氢氧化钠(NaOH)
①物性:白色块状固体、易溶于水(溶解时放出大量的热)、易潮解(吸收空气中的水分、质量增加)。有强烈的腐蚀性(化学性质)。 ②俗名:火碱、烧碱、苛性钠。③用途:干燥剂、造纸、纺织、印染、清洁剂。
2、氢氧化钙:Ca(OH)2
①物性:白色粉沫固体、微溶于水。有较强腐蚀性(化学性质)。②俗名:熟石灰、消石灰、澄清石灰水的主要成分。
③制取:CaO + H2O= Ca(OH)2
四、碱的通性(碱的化学性质)
1、能使指示剂显色。石蕊遇碱变蓝色,酚酞遇碱变红色。
2、与非金属氧化物反应生成盐和水。
①2NaOH+CO2=Na2CO3+H2O
(NaOH 必须密封保存,否则将变质生成Na2CO3、质量增加)
②2NaOH+SO3=Na2SO4+H2O
③Ca(OH)2+CO2=CaCO3↓+H2O (检验CO2的方法)
课题2 酸和碱之间发生的中和反应
1、概念:酸和碱作用生成盐和水的反应,叫做中和反应。(属于复分解反应) 2、中和反应在生活中的应用
①改良土壤; ②处理废水;
③用于医疗及日常生活当中。如治疗胃酸
3、溶液酸碱度的表示方法--PH
①酸碱度:溶液酸碱性的强弱程度。用PH表示。
②PH的范围在0-14之间(PH越小,酸性越强;PH越大,碱性越强) 酸性溶液:PH<7;中性溶液;PH=7;碱性溶液:PH>7。
③测定方法:用PH试纸。
第11单元 盐 化肥
一、 生活中常见的盐
※Ⅰ、氯化钠(NaCl):白色晶体、易潮解、易溶于水
1、用途:调味品、生理盐水、NaCl溶液选种、作化工原料(制盐酸、氯气、氢氧化钠等)。
2、氯化钠的存在:海水、盐湖、盐井和盐矿中。
3、粗盐的制取:用海水晒盐和用盐井水、盐湖水煮盐,使水蒸发,析出NaCl晶体--粗盐。
4、粗盐提纯
(1)方法与步骤:
①溶解(用天平称取食盐,用量筒量取水,放入烧杯,用玻璃棒搅拌) ②过滤(注意一贴、二低、三紧靠)
③蒸发、结晶(用蒸发皿蒸发滤液,使晶体析出)
④计算产率(将得到的精盐和溶解的粗盐比较,算出产率)
(2)玻璃棒在提纯过程中的作用:
①溶解时:搅拌,加速食盐溶解;
②过滤时:引流,防止液体溅出;
③蒸发时:搅拌,防止由于局部温度过高,造成液滴飞溅; ④计算产率时:把固体转移到纸上。
※Ⅱ、碳酸钠(Na2CO3)
1、俗名:纯碱、苏打(纯碱不是碱,而属于盐类);
2、用途:制玻璃、造纸、洗涤剂等
※Ⅲ、碳酸氢钠(NaHCO3)
1、俗名:小苏打;2、用途:焙制糕点、治疗胃酸;
※Ⅳ、碳酸钙(CaCO3)
1、是大理石、石灰石、鸡蛋壳、贝壳的主要成分;
2、用途:重要的建筑、装簧材料、补钙剂等。
二、盐的化学性质(酸碱盐之间的化学反应)
1、盐+酸=新盐+新酸
①CaCO3 + 2HCl == CaCl2 + H2O + CO2↑(制取CO2的原理)
② Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
③NaHCO3+HCl==NaCl+H2O+CO2↑(灭火的原理)
2、盐+碱=新盐+新碱
①Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
②Na2SO4+Ba(OH)2==BaSO4↓+2NaOH
3、盐+盐=新盐+新盐
①Na2SO4+BaCl2==BaSO4↓+2NaCl
②AgNO3+NaCl==AgCl↓+NaNO3
三、复分解反应
1、定义:两种化合物互相交换成分,生成另外两种化合物的反应。
2、发生的条件:①有沉淀 ②或有水 ③或有气体生成(三者之一)
3、碳酸盐的检验:(含CO32-或HCO3-)
向样品中加入稀盐酸,若有能使澄清石灰水变浑浊的CO2生成,则样品是碳酸盐。
四、化肥(植物生成需求量最大的元素是氮、磷、钾)
1、氮肥:①种类:尿素、氨水、铵盐、硝酸盐。
②作用:能促使作物茎叶生成茂盛、叶色浓绿
③若缺氮,会生成迟缓、叶色发黄、严重时叶脉呈淡棕色
2、磷肥:①种类:磷矿粉、钙镁磷肥、过磷酸钙。
②作用:促使根系发达、增强抗寒、抗旱能力;
③缺磷时,植株矮小、生长迟缓、根系瘦弱
3、钾肥:①种类:硫酸钾、氯化钾;
②作用:促进茎秆粗壮、增强抗病抗虫害、抗倒伏能力;
③若缺钾,茎秆软弱、易倒伏、叶片呈褐色、并逐渐焦枯。
4、复合肥:含两种或两种以上营养元素的化肥。主要有硝酸钾、磷酸铵、磷酸钾等。
五、化肥的简单鉴别方法:
①看外观;②看溶解性;③灼烧;④加熟石灰研磨。
六、有关计算:会计算化肥中某元素的质量分数、相对分子质量、元素间的质量比等。
※ 酸碱盐溶解性的识记方法:(口诀)
钾钠铵硝全溶类;不溶氯银硫酸钡;碳盐能溶MgCO3,碱类可溶是钙钡。 ⑴K、Na、NH4、NO3盐全溶;
⑵盐酸盐:除AgCl不溶,其他全溶;
⑶硫酸盐:除BaSO4不溶,其他全溶;
⑷碳酸盐:除MgCO3微溶,其他不溶;
⑸碱类:K、Na、NH4、Ca、Ba溶,其他不溶。
第十二单元 化学与生活
一、人类重要的营养物质
六大营养素:蛋白质、糖类、油脂、维生素、无机盐和水等六大类。
1、蛋白质:①作用:促进机体生长及修补受损组织。
②存在:肉类、鱼类、乳类、蛋类、豆类等;
③CO中毒机理:CO与血红蛋白结合,造成人体缺氧。
2、糖类:①由C、H、O三种元素组成;
②主要存在植物种子或块茎中(如稻、麦、薯类、甘蔗);
③作用:放出能量,供机体活动和维持恒定体温的需要。
3、油脂:是重要的供能物质,是维持生命活动的备用能源。
4、维生素:
①作用:调节新陈代谢、预防疾病、维持身体健康的作用。
②存在:水果、蔬菜、动物肝脏、鱼类、奶制品等。
③缺乏会引起夜盲症、坏血症等。
二、化学元素与人体健康
1、人体中含量较多的元素有11种,最多的是氧,最多的金属元素是钙。 2、C、H、O、N以水、糖类、油脂、蛋白质和维生素的形式存在,其他元素以无机盐形式存在;
3、钙可使骨骼和牙齿坚硬;缺钙会得佝偻病、发育不良、骨质疏松等病。 4、K+、Na+可维持人体内水分和体液有恒定的PH,是人体维持生命活动的必要条件。
三、有机合成材料
1、有机化合物:含碳元素的化合物。(不含CO、CO2、H2CO3、碳酸盐) 2、无机化合物:不含碳元素的化合物。(含CO、CO2、H2CO3、碳酸盐) 3、天然高分子材料:棉花、羊毛、天然橡胶等。
4、三大合成材料:塑料(热固性和热塑性)、合成纤维(涤伦、锦伦、腈伦)、合成橡胶。
5、白色污染:废弃塑料对环境造成的污染。
治理措施:①减少使用;②重复使用;③开发新型塑料;④回收利用。
