第七单元 燃烧及其利用
课题1 燃烧和灭火
一、燃烧
1、概念:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应。
2、条件:(1)可燃物(2)氧气(或空气)(3)温度达到着火点(三者缺一不可,否则不能燃烧)
3、 燃烧与缓慢氧化(铁生锈、食物腐烂、动植物的呼吸作用、酒和醋的酿造)的比较
相同点:都是氧化反应、都放热;
不同点:前者发光、反应剧烈,后者不发光、反应缓慢
二、灭火的原理和方法
1、燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以达到灭火的目的
2、灭火的原理:(1)消除可燃物(如森林大火时制造隔离带)
(2)隔绝氧气(或空气)(如锅盖、酒精灯帽盖灭火焰,如泡沫灭火器)
(3)降温到着火点以下(如吹灭蜡烛、高压水枪)
3、泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般的失火外,还可以扑灭电器、油、气等燃烧引起的失火。
液态二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等处的失火
4、泡沫灭火器的反应原理,利用碳酸钠与浓盐酸迅速反应产生大量的二氧化碳来灭火
化学反应方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑
二、爆炸
① 可能是化学变化(火药爆炸)也可能是物理变化(车胎爆炸)
② 化学变化引起的爆炸:可燃物在有限的空间内发生急剧燃烧,短时间内积聚大量的热,使气体体积迅速膨胀而引起爆炸
③ 可燃性气体(氢气、一氧化碳、甲烷)或粉尘(面粉、煤粉)与空气或氧气混合,遇到明火可能会发生爆炸;可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险
④ 油库、面粉加工厂门口贴有“严禁烟火”的标志:空气中常混有可燃性气体或粉尘,接触到明火,就有发生爆炸的危险
⑤ 可燃物与氧气的接触面积越大,燃烧越剧烈
常见灭火的方法
① 油锅着火,用锅盖盖灭
② 电器着火,先应切断电源
③ 煤气泄漏,先应关闭阀门,再轻轻打开门窗,切忌产生火花
④ 酒精在桌面上燃烧,用湿抹布扑盖
⑤ 扑灭森林火灾,将大火蔓延前的一片树木砍掉
其它:A、生煤炉火时,需先引燃纸和木材,因为纸和木材的着火点比煤低,容易点燃
B、室内起火,如果打开门窗,会增加空气的流通,增加氧气的浓度,反应剧烈,燃烧更旺
C、用扇子扇煤炉火,虽然降低了温度,但没有降至着火点以下,反而增加了空气的流通,所以越扇越旺。用扇子扇蜡烛火焰,虽然增加了空气的流通,但却带走了热量,使温度降低至着火点以下,所以一扇就灭。
课题2 燃料和热量
一、化石燃料
① 包括煤、石油、天然气(都是混合物)
② 是古代生物遗骸经一系列复杂变化而形成的
③ 属于不可再生能源
④ 合理开采,综合利用,节约使用
1、煤
① 称为“工业的粮食”
② 组成:主要含碳元素,还含少量的氢、氮、氧、硫等元素
③ 将煤隔绝空气加热,发生化学变化,得到焦炭(冶炼金属)、煤焦油(化工原料)、煤气(主要含氢气、一氧化碳、甲烷),用作燃料;煤气泄漏,会使人中毒,有可能发生爆炸)
④ 煤燃烧会产生SO2、NO2等,会形成酸雨;还产生CO2,引起温室效应
2、石油
① 称为“工业的血液”
② 从油井开采出来的石油叫原油,它不是产品
③ 组成:主要含碳、氢元素
④ 炼制原理:利用石油各成分的沸点不同,通过蒸馏使之分离(此分离过程是物理变化)
⑤ 石油各产品:汽油、煤油、柴油(作燃料);沥青(筑路);石蜡(作蜡烛)等
⑥ 石油不可以直接作燃料,会浪费资源
3、天然气
(1)、有石油的地方一般有天然气,主要成分是甲烷CH4,最简单的有机物,相对分子质量最小有机物
A、甲烷的物理性质:无色、无味的气体,密度比空气小,极难溶于水。
B、甲烷的化学性质:可燃性CH4+2O2 CO2+ 2H2O (发出蓝色火焰)
CO2+ 2H2O (发出蓝色火焰)
注意:1点燃甲烷前要检验纯度
(2)、检验某可燃物是否含碳、氢元素的方法:点燃,在可燃物上方罩一个冷而干燥的烧杯,烧杯内壁出现水雾,说明生成了水,证明含有氢元素;把烧杯迅速倒过来,立即注入澄清石灰水,变浑浊,说明生成了二氧化碳,证明含有碳元素。(如果某可燃物燃烧生成了二氧化碳和水,只能证明一定含碳、氢元素,可能含氧元素)
(3)、鉴别氢气、一氧化碳、甲烷:检验燃烧的产物(导出点燃,在火焰上方分别罩一个冷而干燥的烧杯,看烧杯内壁是否出现水雾现象;把烧杯迅速倒过来,立即注入澄清石灰水,看是否变浑浊
(4)、沼气的主要成分是甲烷,把秸秆、杂草、人畜粪便等废弃物放在密闭的沼气池中发酵,就可产生甲烷。在农村,沼气可解决生活用燃料问题和改善环境卫生
(5)、可燃冰:埋藏于海底,可以燃烧,主要成分是甲烷水合物,储量是化石燃料总和的两倍将成为替代化石燃料的新能源,开采时如果甲烷气体大量泄漏于大气中,造成的温室效应将比二氧化碳更严重
(6)、西气东输:输的是天然气
(7)、在化石燃料中,天然气是比较清洁的燃料
二、化学变化中的能量变化,能量的变化通常表现为热量的变化
a) 放出热量:燃料燃烧放热(如化石燃料的燃烧);不通过燃料燃烧也可放热
Mg+2HCl=MgCl2+H2↑; CaO+ H2O=Ca(OH) 2
b) 吸收热量: CO 2+C  2CO; Ba(OH)2 + 2NH4Cl = BaCl2+ 2NH3·H2O
2CO; Ba(OH)2 + 2NH4Cl = BaCl2+ 2NH3·H2O
利用化学反应产生的能量做饭、取暖、发电、冶炼金属、发射火箭、开山炸石、拆除旧建筑
三、使燃料充分燃烧注意两点:燃烧时要有足够多的空气,燃料与空气有足够大的接触面。燃料不充分燃烧的后果:产生的热量减少,浪费资源,产生大量的CO等物质污染空气
四、燃气泄漏报警器安装的位置应根据燃气的密度决定,如果燃气的密度比空气的大,则安装在墙壁下方,反之,则安装在上方
课题3 使用燃料对环境的影响
一、 燃料燃烧对空气的影响
1、 煤的燃烧。煤燃烧时会产生二氧化硫、二氧化氮等污染物。溶于水,当溶解在雨水中时,就形成了酸雨。
2、 酸雨的危害:破坏森林、腐蚀建筑物、使水体酸化影响水生生物的生长等
防止酸雨的措施:使用脱硫煤、使用清洁能源等
3、 汽车用燃料的燃烧。汽油和柴油作为多数汽车的燃料,它们燃烧时产生的尾气中主要含有一氧化碳、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘等大气污染物。
减少汽车尾气对空气污染的措施:改进发动机的燃烧方式,使燃料充分燃烧;使用催化净化装置;使用无铅汽油;使用车用乙醇汽油;汽车用压缩天然气(主要成分是甲烷)作燃料;禁止没有达到环保标准的汽车上路
二、使用和开发新的燃料及能源
1、乙醇
① 属于绿色能源中的一种,属于可再生能源
② 由高粱、玉米、薯类等经发酵、蒸馏而得,俗称酒精
③ 可燃性:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
④ 被用作酒精灯、火锅、内燃机的燃料
⑤ 乙醇汽油是混合物,其优点:节省石油资源,减少汽车尾气的污染,促进农业生产
2、氢气
① 最清洁、最理想的燃料:A、原材料资源丰富,B、放热量多,C、产物无污染。
② 有可燃性 2H2 + O2 2 H2O
2 H2O
③ 有还原性H2+CuO Cu+ H2O 用于冶炼金属
Cu+ H2O 用于冶炼金属
④ 电解水可得到氢气2 H2O 2H2↑+ O2↑,但耗用电能
2H2↑+ O2↑,但耗用电能
⑤ 不能广泛使用的原因:制取氢气成本太高且贮存困难
3、氢气的实验室制法
原理:Zn + H2SO4 = ZnSO4 +H2↑
收集方法:向下排空法(密度比空气下)、排水法(难溶于水)
不可用浓盐酸的原因 浓盐酸有强挥发性 ;
不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性
4、正在推广或使用的新能源:太阳能、风能、地热能、核能、潮汐能等
第二篇:九年级化学上册第六、七单元知识点总结
第六单元:《碳和碳的氧化物》 知识点
课题1
一、碳的几种单质
1、金刚石:无色透明的固体,是自然界中最硬的物质,可用于制钻石、刻划玻璃、钻探机的钻头等。
2、石墨:深灰色固体,是最软的矿物之一,有优良的导电性,润滑.
用于制铅笔芯、润滑剂等。
★金刚石和石墨的物理性质有很大差异的原因:碳原子的排列不同。
★CO和CO2的化学性质有很大差异的原因是:分子的构成不同。
3、C60 中的60是指:一个C60分子中含有60个碳原子。
4、活性炭、木炭具有强烈的吸附性(表现在脱色、除异味、吸附毒气等方面),焦炭用于冶铁。
二、单质碳的化学性质:(类似氢气的化学性质)
碳的几种单质物理性质各异,而化学性质却相同!
1、常温下化学性质不活泼(古代字画能长久保存的原因之一)
2、可燃性:
完全燃烧(氧气充足),生成CO2 : C+O2点燃CO2
不完全燃烧 (氧气不充足),生成CO:2C+O2点燃2CO
3、还原性:C+2CuO 高温 2Cu+CO2↑ 应用:冶金工业
现象:黑色粉末逐渐变成红色,澄清石灰水变浑浊。
2Fe2O3+3C高温4Fe+3CO2↑
装置图:

课题2
1、实验室制取气体的思路:(原理、装置、检验)
(1)发生装置:由反应物状态及反应条件决定:
固固加热型:①加热高锰酸钾制取O2②加热氯酸钾与二氧化锰混合物制取O2(图1)
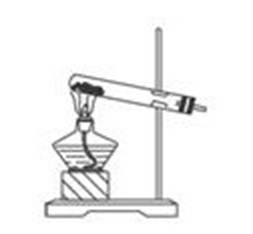
图一 图二
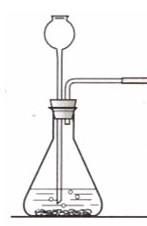
固液常温型:①分解过氧化氢制取O2②实验室制CO2③实验室制H2。(图2)
(2)收集方法:由气体的密度及溶解性决定:
不溶于水、难溶于水、不易溶于水的气体(也不与水反应)用排水法收集
密度比空气大(也不与空气的成分发生反应)用向上排空气法
密度比空气小(也不与空气的成分发生反应)用向下排空气法
O2收集方法:向上排空气法、排水法(密度比空气大、不易溶于水)
CO2收集方法:向上排空气法(密度比空气大、能溶于水且能与水反应)
H2收集方法:向下排空气法、排水法(密度比空气小、难溶于水)
★2、二氧化碳的实验室制法
1)反应原理:用石灰石(或大理石)和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑
2) 装置
 3)气体收集方法:向上排空气法
3)气体收集方法:向上排空气法
4)验证方法:
将制得的气体通入澄清的石灰水,如石灰水变浑浊,则证明是二氧化碳。
验满方法:
用燃着的木条,放在集气瓶口,木条熄灭,证明已二氧化碳气体已经收集满。(对比氧气的验证和验满)
3、二氧化碳的工业制法:
煅烧石灰石: CaCO3煅烧CaO+CO2↑
课题3
★二氧化碳:
1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体——干冰(能升华)
2、化学性质:
1)与水反应生成碳酸:
CO2+H2O=H2CO3 生成的碳酸(不是CO2)能使紫色的石蕊试液变红,
H2CO3 = H2O+ CO2↑ 碳酸不稳定,易分解,所以加热后,变红了的石蕊试液又会恢复紫色。
2)能使澄清的石灰水变浑浊:
CO2+Ca(OH)2 = CaCO3↓+H2O 本反应可用于检验二氧化碳气体!
★重要提示:石灰石和大理石的主要成分都是碳酸钙;氧化钙也叫生石灰;氢氧化钙也叫熟石灰;石灰浆或石灰水的主要成分都是氢氧化钙!煅烧石灰石: CaCO3高温CaO+CO2↑
生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2
CO2+Ca(OH)2==CaCO3↓+H2O
补充:二氧化碳能与灼热的碳反应: C+CO2高温2CO (吸热反应)
3、用途:灭火:既利用其物理性质(密度比空气大),又利用其化学性质(不能燃烧也不能支持燃烧);
干冰用于作制冷剂、人工降雨;温室肥料;是工业原料如制饮料等。
4、二氧化碳过多排放引起温室效应。减缓温室效应的措施:减少煤、石油、天然气等化石燃料的燃烧;大力开发如太阳能、风能等清洁能源;多植树造林;不滥砍滥伐;使用双面纸张、不使用一次性筷子。
★一氧化碳:
1、物理性质:无色,无味的气体,密度比空气略小
2、有毒
3、化学性质: (H2、CO、C具有相似的化学性质:①可燃性 ②还原性)
1)可燃性:2CO+O2点燃2CO2 (可燃性气体点燃前一定要检验纯度)
鉴别:H2、CO、CH4:看燃烧产物(不可根据火焰颜色,因为都带蓝色)
2)还原性:
CO+CuO △ Cu+CO2
现象:黑色的氧化铜逐渐变红,澄清石灰水变浑浊。
Fe2O3+3CO高温2Fe+3CO2
现象:红色粉末逐渐变黑,澄清石灰水变浑浊。
除杂:括号外为主要物质,括号内为杂质。
CO[CO2] 通入足量的石灰水
CO2[CO] 通过灼热的氧化铜 CO+CuO △ Cu+CO2
CaO[CaCO3]只能煅烧(不可加盐酸) CaCO3煅烧CaO+CO2↑
第七单元知识点
1、燃烧是可燃物与氧气发生的一种发光发热的剧烈的氧化反应。
2、燃烧需要的三个条件是①可燃物②氧气(或空气)③温度达到着火点(缺一不可)。
3、灭火的原理:①清除可燃物;②隔绝空气(氧气);③降温到着火点以下。(只要破坏燃烧条件的任意一个即可)
4、泡沫灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑
干粉灭火器原理:2NaHCO3△ Na2CO3+ H2O+CO2↑
5、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。 一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)混合,点火均有可能会发生爆炸。
6、三大化石燃料包括煤、石油、天然气。它们都是不可再生能源,都属于混合物。
7、煤被称为“工业的粮食”,主要含有C元素,煤燃烧排放的污染物:SO2、NO2(引起酸雨)、CO、烟尘等;石油被称为“工业的血液”,主要含有C、H元素;天然气又称瓦斯,主要成分甲烷,化学式CH4,是较清洁的能源。
8、CH4的可燃性。反应方程式CH4 + 2 O2点燃CO2 + 2 H2O
甲烷燃烧产生蓝色火焰,,罩在火焰上方干冷的烧杯壁有水珠出现,证明甲烷中含有H元素,把烧杯倒过来加入澄清石灰水,石灰水变浑浊,证明甲烷中含有C元素。
9、生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2 放热反应。
10、使燃料充分燃烧的方法①使燃烧时有足够空气②使燃料与空气有足够的接触面.充分燃烧好处①产生的热量更多②节约了资源,减少污染。
11、酸雨由于煤燃烧产生的SO2、NO2形成的。
12、实验室制氢气:Zn+H2SO4=ZnSO4+H2↑
13、乙醇化学式为C2H5OH,俗称酒精,属于可再生能源、绿色能源,是一种清洁能源。
乙醇燃烧反应方程式C2H5OH + 3 O2点燃2 CO2 + 3 H2O。
14、H2是最清洁的能源。新能源:太阳能、风能、地热能、潮汐能等
★物质颜色:
黑:C、CuO、Fe3O4
红:Cu、Fe2O3、红磷
黄色:S
暗紫色:KMnO4
★火焰颜色:
淡蓝色:H2、S在空气中燃烧
蓝色:CO、CH4
蓝紫色:S在氧气中燃烧
★常出错化学是书写:
氧化镁 氧化钙 氧化铝 氢氧化钙
氧化亚铁 氧化铁 四氧化三铁
氯化氢 碳酸钙 氯化钠 氯化钙
盐酸 硫酸 甲烷(天然气) 乙醇(酒精)
★补充化学方程式(第三次)
泡沫灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑
干粉灭火器原理:2NaHCO3△ Na2CO3+ H2O+CO2↑
生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2 ( 放热)
CH4的燃烧:CH4 + 2 O2点燃CO2 + 2 H2O
乙醇燃烧:C2H5OH + 3 O2点燃2 CO2 + 3 H2O。
实验室制氢气:Zn+H2SO4=ZnSO4+H2↑
