离子反应重难点归纳
重点一、离子方程式的书写原则
1.强酸、强碱和易溶于水的盐改写成离子形式,如:硫酸、氢氧化钠等要拆成离子形式;难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式,如:碳酸钙、硫酸钡、氯化银、硅酸、氢氧化铜、氢氧化铁等不溶物要写成化学式,醋酸、氨水等弱电解质要写成化学式。
2.微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式;微溶物作为生成物,一般写化学式(标↓号)。
3.多元弱酸酸式酸根离子,在离子方程式中不能拆开写。注意:中强酸归为弱酸范畴,也不能拆。如:HSO3—、H2PO4-、HPO42-等。
4.氨水作为反应物写NH3·H2O;作为生成物,若有加热条件或浓度很大时,可写NH3 (标↑号)。
5.固体与固体间的反应不能写离子方程式;浓H2SO4、浓H3PO4与固体的反应不能写离子方程式。
6.离子方程式要做到原子个数配平、电荷配平。
7.一些特殊的反应,如:有酸式盐参加或生成的反应、两种或两种以上的离子被一种物质氧化或还原、Ba(OH)2与KAl(SO4)2按不同比的反应等,要考虑并满足反应物物质的量的比值。
重点二、离子方程式正误判断(六“看”)
1.看离子反应是否符合客观事实,不可主观臆造产物及反应。如:2Fe+6H+────2Fe3++3H2↑是错误的,因为H+只能将铁氧化成+2价。
Cu+2H+────Cu2++H2↑是错误的,因为铜排在金属活动顺序表氢之后,不能置换出酸中的氢。
2.看“────”、“ ”、“↑”、“↓”等是否正确。如:H2S在水中发生电离的离子反应方程式
”、“↑”、“↓”等是否正确。如:H2S在水中发生电离的离子反应方程式
H2S────HS-+H+是错误的,因为H2S在水中发生部分电离,应当用“ ”。
”。
3.看表示各物质的化学式是否正确。如:HCO3-不能写成CO32-+ H+,HSO3-不可写成SO32-+ H+等。
4.看是否漏掉离子反应。如:Ba(OH)2溶液与硫酸铜溶液反应,既要写Ba2+与SO42-的离子反应,又要写出Cu2+与OH-的离子反应。
5.看电荷是否守恒。如:FeCl2溶液与C12反应,不能写成Fe3++Cl2────Fe2++2Cl-,而应写成2Fe2++Cl2────2Fe3++2Cl-,两边即要原子守恒又要电荷守恒。
6.看反应物或产物的配比是否正确。如:稀H2SO4与Ba(OH)2溶液反应不能写成
H++OH-+SO42-+Ba2+────BaSO4↓+H2O,应写成2H++2OH-+SO42-+Ba2+────BaSO4↓+2H2O。
【规律总结】
视点一、量不同,离子反应不同。
1.生成的产物可与过量的物质继续反应的离子反应
这类离子反应,只需注意题中所给条件,判断产物是否与过量物质继续反应,正确确定产物形式即可。如NaOH(足量或不足量)与AlC13溶液,NaAlO2溶液通HCl(少量或足量),CO2、H2S、SO2(少量或足量)通入到Ca(OH)2、NaOH溶液中等,有关离子方程式都有所区别。
例: 向氢氧化钠溶液中通入少量二氧化碳:CO2+2OH-────CO32-+H2O
向氢氧化钠溶液中通入过量二氧化碳:CO2+OH-────HCO3-
2.酸式盐与量有关的离子反应
这类离子反应一般书写时,量不足的物质参与反应的离子的物质的量之比一定要与它的化学式相符合,而足量的物质参与反应的离子的物质的量之比不一定与化学式相符。如果没有明确的用量,用任一反应物作为足量写出的离子反应方程式均属正确。如:NaHSO4溶液与Ba(HCO3)2(足量或少量),Ca(HCO3)2溶液与NaOH(少量或足量),Ca(OH)2溶液与NaHCO3(不限制量),NaH2PO4溶液与Ba(OH)2(不限制量)等,均应明确量的影响。
例:Ca(HCO3)2溶液与少量NaOH溶液反应的离子方程式
OH-+ HCO3-+Ca2+────CaCO3↓+H2O
Ca(HCO3)2溶液与足量NaOH溶液反应的离子方程式
Ca2++ 2HCO3-+2OH-────CaCO3↓+2H2O+CO32-
3.氧化还原反应中与量有关的离子反应
这类离子反应中常涉及一种氧化剂(或还原剂)与多种还原剂(或氧化剂)的反应。书写时只要找准氧化性、还原性强弱,依据氧化性或还原性强的先反应即可。如向FeBr2、FeI2溶液中通入Cl2的离子反应。因还原性有以下关系I->Fe2+>Br-,所以当Cl2量不同时离子反应不同。
例:向FeBr2溶液中通入少量Cl2的离子反应:
2Fe2++Cl2────2Fe3++2Cl-
向FeBr2溶液中通人过量Cl2应:
2Fe2++4Br-+3C12────2Fe3++2Br2+6Cl-
4.较特殊且与量有关的离子反应
这类反应要求量与其他因素统筹兼顾。如Mg(HCO3)2溶液与过量NaOH反应,不可忽视Mg(OH)2比MgCO3更难溶、更稳定;明矾与足量Ba(OH)2溶液反应,不可忽视Al(OH)3的两性;NH4HSO4溶液与足量Ba(OH)2反应,不可忽视NH3·H2O也是弱电解质等。
例:明矾与少量Ba(OH)2溶液反应:
2Al3+ +3SO42-+3Ba2++6OH-────3BaSO4↓+2Al(OH)3↓
明矾与足量Ba(OH)2溶液反应
Al3+ +2SO42-+2Ba2++4OH-────2BaSO4↓+AlO2-
5.按实际用量书写离子方程式的离子反应
这类反应是在上述书写规律的基础上增大难度,不仅是少量足量问题,而且是给出具体比进行书写总的离子反应方程式。
例:将1mol/L 的NaAlO2溶液和1.5mol/L的HCl溶液等体积充分混合的总离子反应方程式
根据NaAlO2与HCl的物质的量之比可知最终生成的Al3+和Al(OH)3的物质的量之比为1:5故离子方程式为 6AlO2-+ 9H+ +3H2O────5Al(OH)3↓+ Al3+
视点二、混合顺序不同时,离子反应的现象及产物
如AlCl3与NaOH;Na2CO3(Na2SO3、Na2S)与HCl(H2SO4、NaHSO4);Na2S与FeCl3;氨水与AgNO3等混合顺序不同时所对应的离子反应方程式不同,反应现象不同。当两者用量一定时,除Na2CO3(Na2SO3、Na2S)与HCl(H2SO4、NaHSO4);Na2S与FeCl3外最终产物相同。
当Na2CO3(Na2SO3、Na2S)与HCl(H2SO4、NaHSO4)混合时,若H+足量时,产物相同;若H+不足量时,产物不同。同理,Na2S与FeCl3混合时,若Na2S足量时,产物相同;若Na2S不足量时,产物不同。
【典例剖析】
【例1】能正确表示下列反应的离子方程式的是
⑴铜片与稀硝酸反应 Cu+NO3-+ 4H+ Cu2++NO↑+2H2O
Cu2++NO↑+2H2O
⑵饱和石灰水跟稀硝酸反应Ca(OH)2+2H+ Ca2++2H2O
Ca2++2H2O
⑶硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+ Fe3++4H2O
Fe3++4H2O
⑷硫化钠水解 S2-+2H2O H2S+2OH-
H2S+2OH-
⑸氯气通入水中 Cl2+H2O 2H++Cl-+ClO-
2H++Cl-+ClO-
⑹次氯酸钙溶液中通入过量CO2 Ca2++2ClO-+H2O+CO2 CaCO3↓+2HClO
CaCO3↓+2HClO
⑺碳酸钙与醋酸反应 CaCO3+2CH3COOH Ca2++2CH3COO-+CO2↑+H2O
Ca2++2CH3COO-+CO2↑+H2O
⑻将金属钠加入水中 Na+2H2O Na++2OH-+H2↑
Na++2OH-+H2↑
[解析]解题的依据是书写离子方程式的规则。⑴中电荷不守恒;⑵中石灰水中Ca(OH)2应以Ca2+、OH-形式书写;⑶中电荷不守恒;⑷中反应没分步且没用可逆号;⑸中HClO分子不可拆开写;⑹中过量CO2能将生成的CaCO3溶解;⑺正确;⑻中电荷不守恒;
【答案】⑺
【例2】下列离子方程式中,正确的是
A 向FeCl2溶液中通人Cl2:Fe2++Cl2 Fe3++2Cl-
Fe3++2Cl-
B 石灰石和盐酸反应:CO32-+2H+ CO2↑+H2O
CO2↑+H2O
C 氢氧化钡溶液和稀硫酸反应:H++OH- H2O
H2O
D 碘化钾和适量溴水反应:2I-+Br2 I2+2Br-
I2+2Br-
[解析]:A中离子的电荷数未配平;B中把难溶物质CaCO3写成了离子形式;C中遗漏了参加反应的Ba2+和SO42-离子;D中既符合反应规律,又遵守离子方程式的书写规则。
【答案】 D
【例3】按要求正确书写离子反应方程式
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出此步的离子反应方程式: ;
在以上中性溶液中,继续滴加Ba(OH)2溶液至完全反应,此步的离子反应方程式为: 。
(2) 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至恰好沉淀完全,写出此步的离子反应方程式: ;
在以上溶液中,继续滴加NaHSO4溶液至完全反应,此步的离子反应方程式为:
。
[解折] 因NaHSO4是二元强酸的酸式盐,可以理解成全部电离。
(1) 当Ba(OH)2向NaHSO4溶液中逐滴加入至中性时,其反应的化学方程式是:
2NaHSO4+Ba(OH)2 BaSO4↓+ Na2SO4+ 2H2O
BaSO4↓+ Na2SO4+ 2H2O
离子反应方程式是:2H+ + SO42-+ Ba2++ 2OH- BaSO4↓+ 2H2O
BaSO4↓+ 2H2O
此时溶液中成份只有Na2SO4,再加人Ba(OH)2时的离子反应方程式为:
Ba2++SO42- BaSO4↓
BaSO4↓
(2)同理,当NaHSO4向Ba(OH)2溶液中逐滴加入至沉淀完全时,其反应的化学方程式是:NaHSO4+Ba(OH)2 BaSO4↓+NaOH+H2O
BaSO4↓+NaOH+H2O
离子反应方程式是:H+ +SO42-+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O
此时溶液中成份只有NaOH,再加人NaHSO4时的离子反应方程式为:
H+ +OH- H2O
H2O
【答案】
(1)2H+ +SO42-+Ba2++2OH- BaSO4↓+2H2O;Ba2++SO42-
BaSO4↓+2H2O;Ba2++SO42- BaSO4↓
BaSO4↓
(2)H+ +SO42-+Ba2++OH- BaSO4↓+H2O; H+ +OH-
BaSO4↓+H2O; H+ +OH- H2O
H2O
【例4】在一定条件下,RO3n-和I-可以发生反应,离子方程式为:RO3n-+6I-+6H+ R-+3I2+3H2O
R-+3I2+3H2O
(1) RO3n-中R元素的化合价为 。
(2)R元素的原子最外层电子有 个。
[解析] 根据电荷守恒原理,离子方程式反应前后电荷数应相等,则有:(-n)+6×(-1)+6×(+l)= -1,解得n=l,即RO3n-为RO3-,故R的化合价为+5。根据离子反应生成物为R-,R的最低负化合价为-1,表明元素R原子最外层电子有7个(为卤族元素)。
【答案】 (1) +5;(2) 7
【例5】下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A Na+、Ba2+、Cl-、SO42- B K+、AlO2-、NO3-、OH-
C H+、NH4+、Al3+、SO42- D H+、Cl-、CH3COO-、NO3-
[解折] 首先用题中第一个条件“在溶液中可以大量共存”筛选ABCD四个选项:A中的Ba2+与SO42-因生成BaSO4沉淀不能大量共存,D中的H+与CH3COO-因结合生成弱电解质不能大量共存,这样将A和D排除;再用题中第二个条件“加入氨水后也不产生沉淀”去筛选B和C,C中的Al3+遇到NH3· H2O后会生成Al(OH)3沉淀,而B中本来就有AlO2-、OH-,是碱性溶液,加入氨水时不会产生沉淀。
【答案】 B
【例6】(05年天津)下列各组离子的溶液中能大量共存的是
A.酸性溶液Na+、K+、MnO4—、Br—
B.酸性溶液Fe3+、NH4+、SCN—、NO—
C.碱性溶液Na+、K+、AlO2—、SO42—
D.碱性溶液Ba2+、Na+、CO32—、Cl—
[解折]酸性溶液中,MnO4—具有强氧化性,氧化Br—A错;Fe3+与SCN—发生络和反应不共存,B措;C对;Ba2+与CO32—生成沉淀不共存,D错。
【答案】C
【例7】某无色透明溶液中存在以下离子中的几种,且跟金属铝反应能放出氢气,试判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、HCO3-、SO42-、SO32-、OH-、NO3-何者能存在于此溶液中?
(1)当生成Al3+时,一定存在 ,可能存在 。
(2)当生成AlO2-时,一定存在 ,可能存在 。
[解折] 此类题目的解题方法是:当肯定一种离子后,一定要看在此基础上是否能否定一些离子。
首先用溶液无色这一条件,判定一定没有Cu2+
(1)当生成Al3+时,溶液必定呈现酸性,所以一定存在H+,而与H+不共存的离子有HCO3-、SO32-、OH-、NO3-(NO3-在酸性条件下有强氧化性,与Al反应不会产生氢气),但溶液中必定要有阴离子,因此一定含有SO42-,与SO42-不共存的离子有Ba2+、Ag+;Mg2+可能存在。
(2)当生成AlO2-时,溶液必定呈现碱性,所以一定存在OH-,而与OH-不共存的离子有HCO3-、Mg2+、H+、Ag+,但溶液中必定要有阳离子,因此一定含有Ba2+,与Ba2+不共存的离子有SO42-、SO32-;NO3-可能存在
【答案】(1)H+、SO42-;Mg2+
(2)OH-、Ba2+;NO3-
氧化还原反应
考点整合
考点一 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物
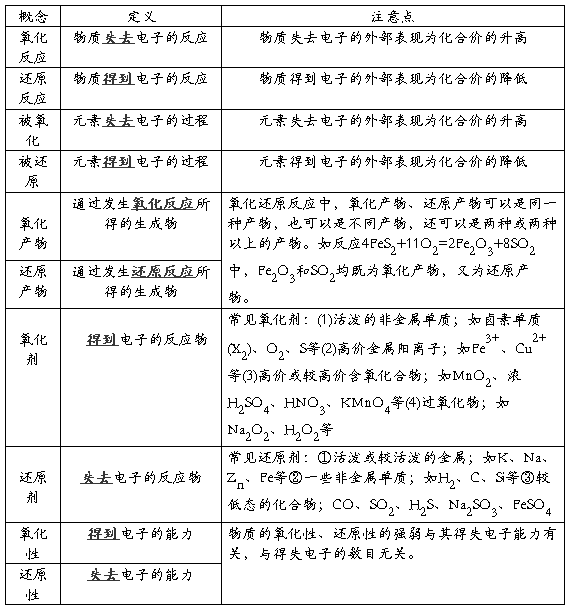
[例1](2008·茂名一模)金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2 + bCl2 + cC 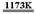 aTiCl4 + cCO ……反应①
aTiCl4 + cCO ……反应①
TiCl4 +2Mg 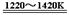 Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是( )
①TiCl4在反应①中是还原产物,在反应②中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
[解析]②中C、Mg在反应中均为还原剂,被氧化;经计算知⑤中每生成19.2 g Ti,反应①、②中共转移3.2 mol e-
[答案]D
[知识规律]
还原性 化合价升高 弱氧化性
 ↑
↑
 ↑
↑


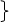
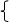

 还原剂 氧化反应 氧化产物
还原剂 氧化反应 氧化产物


 氧化剂 还原反应 还原产物
氧化剂 还原反应 还原产物
 ↓
↓  ↓
↓
氧化性 化合价降低 弱还原性
考点二 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强
还原性→失电子性,失去电子越容易→还原性越强
由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1.根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
2.根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
3.根据氧化还原反应发生的规律来判断:
规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
4.根据氧化还原反应发生的条件来判断:
 如:Mn02+4HCl(浓) MnCl2+C12↑+2H20
如:Mn02+4HCl(浓) MnCl2+C12↑+2H20
2KMn04+16HCl(浓)=2MnCl2+5C12↑+8H2O
后者比前者容易(不需要加热),可判断氧化性 KMn04>Mn02
5.根据反应速率的大小来判断:
如:2Na2SO3+O2=2Na2SO4(快), 2H2SO3+O2=2H2SO4(慢), 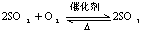 ,
,
其还原性: Na2SO4>H2SO3>SO2
6.根据被氧化或被还原的程度来判断:
如: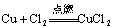 ,
,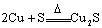 , 即氧化性:
, 即氧化性: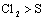 。
。
又如: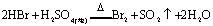 ,
,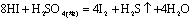 ,
,
即有还原性: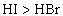 。
。
7.根据原电池的正负极来判断:
在原电池中,作负极的金属的还原性一般比作正极金属的还原性强。
8.根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
如:Cl-失去电子的能力强于OH-,还原性: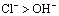 。
。
9.根据元素在周期表中位置判断:
(1)对同一周期金属而言,从左到右其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
(2)对同主族的金属而言,从上到下其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱。
10.根据(氧化剂、还原剂)元素的价态进行判断:
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO34< HClO24< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。
②原子的氧化性一般都强于分子的氧化性。如:氧化性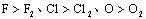 等。
等。
[例2](2007·聊城二模)常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO4-=2x2++5Z2+8H2O ②2A2+ +B2=2A3++2B- ③2B-+Z2=B2+2Z- 由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行。 B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
[解析]根据上述规律4可得:氧化性顺序:XO4->Z2>B2>A3+,还原性顺序:A2+>B->Z->X2+。
[答案]B
考点三 氧化还原反应方程式的配平方法
1.配平原则:电子守恒、原子守恒、电荷守恒
2.配平步骤(以高锰酸钾和浓盐酸反应制氯气为例):
①标出化合价变化了的元素的化合价。如:
+7 -1 +4 0
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
②根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成1︰1的关系。如:+7 -1 +4 0
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
③调整系数,使化合价升降总数相等。
 化合价↓ 5×②
化合价↓ 5×②
 KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
KMnO4+2HCl==KCl+MnCl2+Cl2↑+H2O
化合价↑2×⑤
④根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。如:2KMnO4+10HCl==KCl+2MnCl2+5Cl2↑+H2O
⑤利用元素守恒,用观察方法配平没有参加氧化还原反应的其他物质的系数。如:
2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O
⑥检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
[例3](2008·江西信丰中学)对于反应KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平),若有0.1mol KMnO4参加反应,下列说法正确的是( )
A.其转移电子0.5mol B.生成Cl20.5mol
C.参加反应HCl为16mol D.Cl2是还原产物
[解析]配平该方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O ,Mn由+7→+2,得到5电子,则0.1mol KMnO4参加反应消耗HCl为1.6mol,转移的电子为0.5mol,生成的Cl2为0.25mol,故A正确,B、C不正确;Cl2是氧化产物,故D不正确。[答案]A
考点四 电子转移守恒应用
电子转移守恒法是依据氧化剂与还原剂得失电子数目相等这一原则进行计算的。电子转移守恒法是氧化还原反应计算的最基本的方法。
[例4](2007·广州·学业水平测试)在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.l∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶2
[解析]用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半。[答案]B
★ 高考重点热点题型探究
热点1 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物判断
[真题1](2006·广东)下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A.O3+2KI+H2O=2KOH+I2+O2 B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2Ca
C.I2+2NaClO3=2NaIO3+Cl2 D.4HCl+MnO2=MnCl2+Cl2↑+2H2O
[解题思路]根据氧化还原反应规律,正确判断氧化剂与还原剂,由方程式的系数确定出它们的物质的量,再求比即可。
[解析]反应A中氧化剂为O3,还原剂为KI,从方程式系数易知,其物质的量之比为1∶2;反应B为非氧化还原反应;反应C中氧化剂为NaClO3,还原剂为I2,从方程式系数易知,其物质的量之比为2∶1;反应D中氧化剂为MnO2,还原剂为HCl,但4molHCl中只有2molHCl作还原剂。故答案为A D。
[答案]A D
名师指引
氧化还原反应一般可分为以下几种类型:
1.一般的氧化还原反应:指氧化剂和还原剂分别属于不同物质的氧化还原反应。如:
H2还原氧化铜,实验室用二氧化锰和浓盐酸反应制氯气等等。
2.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应。如:实验室用氯酸钾和二氧化锰加热制氧气,氯气和水的反应等等。
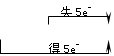
3.歧化反应:指发生在同一物质分子内、同一价态的同一元素之间的氧化还原反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:
 得5e-
得5e-
Cl2 + 2NaOH==NaCl+ NaClO+H2O;对于歧化反应,可通过分析参加氧化还原反应的元素的去
 失5e-
失5e-
向,从而确定氧化剂、还原剂的物质的量之比。
 4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价
4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价
→中间价”,而不会出现交错现象。如:KClO3+6HCl==KCl+3Cl2+3H2O ;对于归中反应,可
通过分析参加氧化还原反应的元素的来源,从而确定氧化产物、还原产物的物质的量之比。
热点2 氧化剂的氧化性、还原剂的还原性强弱判断
[真题2](2007·济宁一模)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2=2FeCl3+4FeI3 B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D.2Fe3++2I—=2Fe2++I2
[解析]A中因I-的还原性强于Fe2+,Cl2应先氧化I-,只有当I-氧化完全后才会氧化Fe2+,故A不正确,B正确。C、D中的物质的氧化性顺序都符合题给要求,也是正确的。
[答案]A
名师指引
同一氧化剂与含多种还原剂(物质的量浓度相同)的溶液反应时,首先被氧化的是还原性较强的物质;同一还原剂与含多种氧化剂(物质的量浓度相同)的溶液反应时,首先被还原的是氧化性较强的物质。如:将Cl2通人物质的量浓度相同的NaBr和NaI的混合液中,C12首先与NaI反应;将过量铁粉加入到物质的量浓度相同的Fe2+、和Cu2+的混合溶液中,Fe首先与Fe3+反应。FeBr2 中通入Cl2 ,Fe2+首先与Cl2反应;FeI2 中通入Cl2 ,I-首先与Cl2反应。
热点3 氧化还原反应方程式的配平
[真题3](2008·全国理综)(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3,在该反应的化学方程式中,化学计量数由小到大的产物分子依次是( )
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
[解析]根据题意,题设中的氧化还原方程式的配平如下:
3(NH4)2SO4 = 3SO2↑+N2↑+4NH3↑+6H2O 故答案为C
名师指引
电子转移守恒法(化合价升降价法)只是配平氧化还原反应方程式的方法之一,“设1法”、“ 设1,x法”也不失为氧化还原反应方程式配平的一种好的方法,至于方法的使用,则大家可以根据所需配平的氧化还原方程式的特点去进行合理的选择,采用不同的方法。
现以KMnO4和HCl反应(KMnO4+HCl → KCl+MnCl2+Cl2↑+H2O)为例来加以说明。
假设KMnO4的系数为1,由元素守恒知,KCl和MnCl2的系数都为1,H2O的系数为4;又由H2O的系数为4可得HCl的系数为8,再由Cl守恒可知Cl2的系数为2.5,然后方程式左右两边再同×2可得方程式为:2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
同理,如果“设1法”不能配平,则可以通过“ 设1,x法”或“ 设1,x,y … 法”等去进行处理。
热点4 电子转移守恒的运用
[真题4](2008·海南)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol B.1 mol C.0.5mol D.0.25mol
[解析]每生成1mol硝酸锌时,Zn的化合价升高2价,而1 molHNO3被还原成硝酸铵,N元素的化合价降低8价,由电子转移守恒可知,在氧化还原反应中化合价升高总数与化合价降低总数相等,则每生成1 mol硝酸锌时,被还原的HNO3的物质的量为0.25mol。[答案]D
