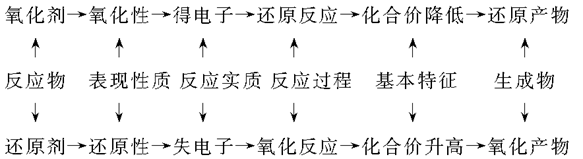
氧化还原反应
1、从得失氧的角度认识氧化还原反应:根据反应物中物质是否得到氧或者失去氧,将化学反应分为氧化反应和还原反应;
注:氧化反应和还原反应一定是同时发生的;
2、从化合价升降角度认识氧化还原反应:元素化合价升高的反应时氧化反应;元素化合价降低的反应是还原反应;
注:凡是有元素化合价升降的反应都是氧化还原反应,氧化还原反应不一定有氧的得失;
3、从电子转移角度认识氧化还原反应:①从电子得失的角度分析,失电子,化合价升高,被氧化;得电子,化合价降低,被还原; ②从共用电子对角度分析,非金属原子间不易得失电子形成化合物,它们通过共用电子对达到8(2)个电子的稳定结构。电子对常偏向其吸引力较强的原子(显负价),而偏离其吸引力较弱的原子;
注:氧化还原反应的本质:有电子转移(电子得失或共用电子对偏离)的反应;
氧化反应的本质:元素失去电子或者共用电子对偏离的反应;
还原反应的本质:元素得到电子或者共用电子对偏向的反应;
4、氧化还原反应与四种基本反应类型的关系:
化合反应:有单质参加的化合反应都是氧化还原反应;
分解反应:有单质生成的分解反应都是氧化还原反应;
置换反应:所有的置换反应都是氧化还原反应;
复分解反应:复分解反应都不是氧化还原反应;
注:有单质参加的反应不一定都是氧化还原反应,例如氧气在放电的情况下可以生成臭氧;
5、氧化剂:在氧化还原反应中得到电子的物质;
还原剂:在氧化还原反应中失去电子的物质;
氧化剂具有氧化性:物质中所含元素的原子或离子得电子能力越强,则物质的氧化性就越强; 还原剂具有还原性:物质中所含元素的原子或离子失电子能力越容易,则物质的还原性就越强; 氧化产物:物质失电子被氧化的生成物,具有得电子的性质(氧化性);
还原产物:物质得电子被还原的生成物,具有失电子的性质(还原性);
注:还原剂:有还原性,被氧化,化合价升高,失电子,发生氧化反应,转化成氧化产物 氧化剂:有氧化性,被还原,化合价降低,得电子,发生还原反应,转化成还原产物
6、常见的氧化剂和还原剂:
常见的氧化剂:①活泼的非金属单质:O2,Cl2,Br2,I2 ②高价金属阳离子:Fe3+,Cu2+,Ag+ ③高价或较高价含氧化合物:MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4、KClO3 ④其他:H2O2,Na2O2; 常见的还原剂:①活泼或较活泼金属:K,Na,Ca,Mg,Al,Zn,Fe; ②某些非金属单质:C,H2; ③低价金属阳离子:Cu+,Fe2+; ④非金属阴离子:S2-,I-,Br-,Cl-; ⑤较低价化合物:CO,SO2,H2S,NH3;
注:若元素处于最高价态,则只表现氧化性,作氧化剂;若元素处于最低价态,则只表现还原性,作还原剂;若元素处于中间价态,则既表现氧化性又表现还原性,既可作氧化剂又可作还原剂;
7、氧化剂、还原剂强弱的判断;
①根据金属活动顺序判断:在金属活动顺序表中,从左到右原子的还原性逐渐减弱,但其对应阳离子的氧化性逐渐增强;
例如:还原性: Mg Zn Cu 氧化性: Cu2+ Zn2+ Mg2+
②根据反应方向判断: 若下列反应能向右进行,
氧化剂 + 还原剂 还原产物 + 氧化产物
则氧化性强弱:氧化剂 > 氧化产物 还原性强弱:还原剂 > 还原产物
______例如:2FeCl3 + Cu ______ 2FeCl2 + CuCl2
氧化性:Fe3+ > Cu2+ 还原性: Cu > Fe2+
③根据物质所含元素反应前后价态不同判断:
④当不同的氧化剂(还原剂)作用于同一种还原剂(氧化剂)时,氧化产物(还原产物)所含元素价态相同,可根据反应条件的难易进行判断。条件越简单,氧化性(还原性)越强。一般从反应是否需要加热、温度高低、有无催化剂等反面判断;
⑤根据反应剧烈程度判断:例如:Cu与浓HNO3反应较剧烈,Cu与稀HNO3反应较微弱
故氧化性:HNO3(浓)> HNO3(稀)
注:比较氧化性(还原性)的强弱不在于比较得(失)电子数目的多少,而在于比较得(失)电子的难易,而难易程度就是依据反应的剧烈程度来判断的;
8、氧化还原反应的规律
①守恒规律: 化合价升高总数=化合价降低总数(失电子数=得电子数)
②价态规律: 元素处于最高价态,只有氧化性,如Fe3+
元素处于最低价态,只有还原性,如S2-
元素处于中间价态,既有氧化性又有还原性,如Fe2+
③先后规律:氧化还原反应中,强者有限,即氧化性(还原性)强,优先发生反应。
④不交叉规律:即同种元素不同价态之间,相邻价态不反应,发生反应时化合价向中间靠拢,但不交叉;
第二篇:高一化学氧化还原反应练习题
强电解质:
1、强酸:HCl 盐酸 H2SO4硫酸 HNO3硝酸 HBr氢溴酸 HI氢碘酸 HCLO4高氯酸
2、强碱:NaOH KOH Ba(OH)2 Ca(OH)2
3、绝大多数盐:高中见到的盐全部是强的电解质
金属化合物:a、 氧化物:氧化钙CaO 氧化钠Na2O 氧化镁MgO 氧化Al2O3 氧化锌 ZnO 氧化盐铁FeO 氧化铁Fe2O3 氧化铜CuO 氧化汞HgO 氧化银Ag2O
b、 过氧化合物:过氧化钠Na2O2
c、 金属碳化物:碳化钙CaC2
d、 金属硫化物:硫化钙CaS2 二硫化亚铁FeS2
弱电解质:
1、弱酸:碳酸H2CO3 亚硫酸H2SO3 醋酸CH3COOH 氢硫酸H2S
氢氟酸HF 硅酸H2SiO3 原硅酸H3SiO4 所有的有机酸
2、弱碱:一水合氨NH3.H2O 所有的除强碱的氢氧化金属R(OH)
3、水H2O也是弱电解质
非电解质:
1、非金属氧化物:二氧化碳 二氧化硫 一氧化碳 三氧化硫 二氧化氮
一氧化氮
2、大多数有机物:甲烷 乙醇 蔗糖 (有机酸和有机盐除外)
3、非金属化合物:氨气
(1)氧化反应: 失去 电子(化合价 升高 )的反应。
(2)还原反应: 得到 电子(化合价 降低 )的反应。
(3)氧化剂(被 还原 ): 得到 电子的反应物(所含元素化合价降低 的反应物)。
(4)还原剂(被 氧化 ): 失去 电子的反应物(所含元素化合价升高 的反应物)。
(5)氧化产物: 还原 剂失电子被氧化后的对应产物(包含化合价 升高 的元素的产物)。
(6)还原产物: 氧化 剂得电子被还原后的对应产物(包含化合价 降低 的元素的产物)。
(7)强氧化剂与强还原性相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓)与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P等。
Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、H2、SO2、
、H2SO3等。
HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、 、H2SO3等。
(8).元素处于最高价时只有氧化性,在反应中只作氧化剂;
元素处于最低价时只有还原性,在反应中只作还原性;
元素处于中间价态时,在反应中化合价既可升高又可降低,既有氧化性又有还原性,既可作氧化剂又可作还原性。
练习题
1下列类型的反应,一定发生电子转移的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
2下列有关氧化还原反应的叙述中正确的是( )
A.在反应中不一定所有元素化合价都发生变化
B.肯定有一种元素被氧化另一种元素被还原
C.非金属单质在反应中只能得电子
D.金属单质在反应中失电子被还原
3已知下列反应:
2FeCl3+2KI===2FeCl2+2KCl+I2①
2FeCl2+Cl2===2FeCl3②
I2+SO2+2H2O===H2SO4+2HI③
4判断下列物质的还原能力由强到弱的顺序是( )
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
5已知:X2、Y2、Z2、W2四种物质的氧化能力W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2===2NaZ+W2 B.2NaX+Z2===2NaZ+X2
C.2NaY+W2===2NaW+Y2 D.2NaZ+X2===2NaX+Z2
6已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体 ②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色 ③取实验②生成的溶液滴在淀粉碘化钾试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性:MnO >Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉碘化钾试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
7 Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( )
A. 2 B.3 C.4 D.5
8.1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504mL B.168mL C.336mL D.224mL
9含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
10 (1)Na3AsO4与HI可发生反应,化学方程式是Na3AsO4+2HI===Na3AsO3+H2O+I2试标出电子转移的方向和数目:_______________________________________________________________。
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向反方向进行,此时体系中的氧化反应为由________→________。如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是________。
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关,下列各组物质由于浓度不同而发生不同氧化还原反应的是( )
A. Cu与HNO3 溶液 B.Cu与FeCl3 溶液
C.Fe与HCl 溶液 D.Fe与H2SO4 溶液
一、选择题(只有1个正确答案)
1.有关氧化还原反应实质的说法中正确的是 ( )
A.是否有元素的电子转移 B.是否有元素的化合价的变化
C.是否有氧元素的参加 D.是否有原子的重新组合
2.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是 ( )
A.化合反应一定是氧化还原反应
B.分解反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.复分解反应不一定是氧化还原反应
3、某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原 C.既可能被氧化又可能被还原 D.以上都不是
4.下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4
C.2NaHCO3 Na2CO3+CO2↑+H2O D.CaO+H2O===Ca(OH)2
Na2CO3+CO2↑+H2O D.CaO+H2O===Ca(OH)2
5. 从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是 ( )
A.Na2S B. S C. SO2 D. H2SO4
6、由反应KClO3+xHCl(浓)=KCl+yCl2+3H2O可推测,x和y的值应分别为( )
A、2,1 B、5,3 C、6,3 D、8,4
二、选择题(有1-2个答案)
7.下列说法中,能够判断一个反应是否是氧化还原反应的是 ( )
A.反应前后,元素是否有电子转移 B.反应前后,元素是否有化合价变化
C.反应前后,是否有氧元素参加 D.反应前后,是否有氢元素参加
8、根据反应: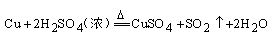 下列叙述中正确的是( )
下列叙述中正确的是( )
A、反应中浓H2SO4既表现强氧化性,又表现酸性
B、反应中浓H2SO4中H原子得电子被还原
C、反应中浓H2SO4中+6价S得4e-被还原成SO2
D、反应中Cu失2e-被氧化,CuSO4是还原剂
9.属于氧化还原反应的离子方程式的是 ( )
A.CaCO3+2H+ = Ca2++CO2↑+H2O B.2Fe2++Cl2 = 2Fe3++2Cl-
C.HCO3-+H+ = CO2+H2O D.2Na+2H2O = 2Na++2OH-+H2↑
10.下列化学变化中,需加入氧化剂才能实现的是 ( )
A.C→CO2 B.CO2→CO C.CuO→Cu D.H2SO4→BaSO4
11.氧化还原反应发生在同种元素之间的是 ( )
A.Zn+2HCl=ZnCl2+H2↑ B.2H2S+SO2=3S+2H2O
C. H2+CuO=Cu +H2O D.2H2O  2H2↑+O2↑
2H2↑+O2↑
12.下列反应中氯元素被氧化的是 ( )
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.MnO2+4HCl=MnCl2+2H2O+Cl2↑
D.2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
13.下列反应中,电子转移发生在同种元素之间的是 ( )
A.2H2S+SO2=3S+2H2O
 B.2KMnO
4
B.2KMnO
4
 K
2MnO
4+MnO
2+O
2↑
K
2MnO
4+MnO
2+O
2↑
C.2KClO3 2KCl+3O2↑
D.Cu2O+H2SO4=CuSO4+Cu+H2O
14.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
15.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
三、填空题
16.氧化还原反应的实质是____________,其特征是____________。物质中的某元素发生氧化反应时,反应结果该元素的化合价____,该物质在反应中所起的作用是________________;物质中某元素被还原时,它发生了______反应,______电子,结果化合价______,该物质在反应中所起的作用是____________。
17.在KClO3+6HCl==KCl+3Cl2+H2O反应中,______是氧化剂,______是还原剂,______物质中的______元素被氧化,______中的______元素被还原。______是氧化产物,______是还原产物。
18.火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是
,还原剂是 ,氧化产物是 ,还原产物是
。
19.阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有 性,铁离子具有
性,(1)中的维生素C是 剂,(2)中的CO2是 剂,写出(2)中的离子方程式 。
