初三化学试卷
总分:100分 考试时间:90分钟 考试内容:氧化还原反应 离子反应 摩尔质量 出题人:王智超
姓名:________
一.选择题(共15题,每题3分,共45分)
1.下列反应中属于氧化还原反应的是( )
A.2NaHCO3=Na2CO3+CO2↑+H2O B.2KMnO4= K2MnO4+MnO2+O2↑
C.Ca(OH)2+CO2=CaCO3↓+H2O D.Cu(OH)2+H2SO4=CuSO4+2H2O
2.在反应CO+CuO=CO2+Cu,CO2是( )
A.氧化剂 B.还原剂 C.氧化产物 D.还原产物
3.下列反应中H2O既不是氧化剂又不是还原剂的反应是( )
A.2H2O=2H2↑+O2↑ B.Cl2+H2O=HCl+HClO
C.2Na+2H2O=2NaOH+H2↑ D.2F2+2H2O=4HF+O2↑
4.下列哪一个反应表示二氧化硫被还原( )
A.SO2+2H2O+Cl2=H2SO4+2HCl B.SO2+2NaOH=Na2SO3+H2O
C.SO2+2H2S=2H2O+3S↓ D.SO2+PbO2=PbSO4
5.关于氧化剂的叙述正确的是( )
A.分子中不一定含有氧元素 B.分子中一定含有氧元素
C.在反应中易失电子的物质 D.在反应中易结合电子的物质
6.下列变化需要加入氧化剂才能实现的是( )
A.S2-→HS- B.HCO--2+
3→CO2 C.I→I2 D.Cu→Cu
7.下列物质不能做氧化剂的是( )
A.KNO3 B.KClO3 C.Cu D.SO2
8.某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化也可能被还原 D.既没被氧化也没被还原
9.下列对于盐酸性质的叙述中正确的是( )
A.只具有氧化性和酸性 B.只具有还原性和酸性
C.具有酸性、氧化性和还原性 D.只有酸性无氧化性和还原性
10.在H2SO3+2H2S=3H2O+3S↓反应中被氧化元素与被还原元素的质量比是( )
A.1∶1 B.2∶1 C.1∶2 D.3∶2
11.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
12、下列电离方程式错误的是( )
++―++―A NaHCO3 ====Na +H +CO32 B NaHSO4 ====Na +H +SO42
+―+―C MgCl2 ====Mg2 +2Cl D Ba(OH)2 =====Ba2 +2OH
13.下列说法正确的是 ( )
A.1 molH2的质量是1 g B.1 mol HCl的质量是36.5 g·mol
C.Cl2的摩尔质量等于它的相对分子质量 D.硫酸根离子的摩尔质量是96 g·mol
14.下列物质里含氢原子数最多的是 ( )
A.1 mol H2 B.0.5molNH3 C.6.02×10个的CH4分子 D.0.3molH3PO4
15.如果1g水中含有n个氢原子,则阿伏加德罗常数是 ( )
A.1/n mol-1 23-1-1B.9n mol-1 C.2nmol -1 D.nmol -1
二.填空题(共8个空,前六个每个空2分,后两个每个4分,共20分)
1.5mol的CO2与8mol的SO2的分子数比是 ;原子数比是 。
2. H2S + 2FeCl3 === 2FeCl2 + S + 2HCl 氧化剂,还原剂
3.请根据反应①X2+2Z=2X+Z2 ②Z2+2W=2Z+W2 ③W2+2Y=2W+Y2 判断:
(1)哪些物质具有氧化性,并指出氧化能力强弱顺序。
_____________________________________________________________________
--(2)反应W2+2X=2W+X2能否进行,说明理由。
_____________________________________________________________________
-4. 酸化的KMnO4溶液中加入H2O2,MnO4被还原成Mn2+,并有O2放出,写出反应的离
子方程式_______________________________________。
5. Zn+NH4NO3+2HNO3=Zn(NO3)2+N2↑+3H2O的反应中,参加反应的锌和被还原的硝酸根的物质的量之比是_______________________________________。
三.配平化学方程式(共四个,每个5分,共20分)
2 + 2O —— 3
(浓)+ 4=== 2+ H2O+ Cl2↑ ------4 + HBr ?Br2 + MnBr2 KBr + 2O 2Cr2O7 + KI+ HCl —— CrCl3 + NaCl + KCl+I2+
四.四.用双线桥法表示得失电子(共三题,每题五分,共15分)
加热(1)2KMnO4==K2MnO4+MnO2+O2↑
(2)11P+15CuSO4+24H2O====5Cu3P+6H3PO4+15H2SO4
(3)Na2B4O7+16Na+8H2+7SiO2====4NaB H4+7Na2SiO3
第二篇:高中化学氧化还原反应
第一节 氧化还原反应
一、氧化还原反应的本质
㈠实质:电子的转移(得失或偏移)。
㈡特征:反应前后元素的化合价发生了变化。
二、氧化还原反应与四种基本反应类型的关系
三、氧化还原反应的表示方法
 a.用两条线由反应物指向生成物,且对准同种元素。
a.用两条线由反应物指向生成物,且对准同种元素。
㈠双线桥法 b.要标明“得”、“失”电子,且得失电子数相等。
c.箭头不代表电子转移的方向。
 a.用一条线表示不同元素原子得失电子的情况。
a.用一条线表示不同元素原子得失电子的情况。
㈡单线桥法 b.由失电子的元素指向得电子的元素,并标明电子转移的总数。
c.箭头表示电子转移的方向
 Fe2O3+3CO高温 2Fe+3CO2 3Cu+8HNO3==3Cu(NO3)2+NO +4H2O
Fe2O3+3CO高温 2Fe+3CO2 3Cu+8HNO3==3Cu(NO3)2+NO +4H2O
四、有关氧化还原反应的总结
㈠从化合价升降角度认识氧化还原反应
㈡从电子转移角度理解氧化还原反应
1、在离子化合物的形成过程中,金属元素原子失去电子使化合价升高,发生氧化反应;非金属元素原子得到电子使化合价降低,发生还原反应。
2、在共价化合物的形式过程中,公用电子对偏向哪一方,该元素的化合价降低,发生还原反应,共用电子对偏离哪一方,该元素化合价升高,发生氧化反应。
3、元素化合价的升降既与氧化还原反应有着密切的关系,又与元素原子之间的电子转移有着密切的关系。
五、氧化还原反应的基本规律
㈠守恒律:化合价升高总数与降低总数相等,失电子总数与得电子总数相等,反应前后电离总数相等(离子反应)
㈡价态律:元素处于最好价态,只有氧化性;元素处于最低价态,只有还原性。
㈢强弱律:强氧化性的氧化剂跟强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
㈣转化律:以元素相邻价态之间的转化最容易;同种元素不同价态之间发生反应,元素的化合价只靠近不交叉(有可能生成同一价态的物质);同种元素相邻价态之间不发生氧化还原反应。
㈤难易律:越易失电子的物质,失去后就越难得电子;越易得电子的物质,得到后就越难失去电子。
㈥跳位律
在特殊情况下,氧化剂遇到强还原剂时,或还原剂遇到强氧化剂时,元素的价态变化不是临位变化而是跳位变化的。
㈦有效律
㈧分部律:分部反应覆盖了某些氧化还原反应的本质
当一个氧化剂(还原剂)遇到还原剂(氧化剂)时,自身氧化还原能力较强的优先。
六、氧化还原反应的类型
㈠还原剂+氧化剂===氧化产物+还原产物
㈡部分氧化还原反应
㈢自身氧化还原反应
七、常见的氧化剂和还原剂
㈠具有最高价元素的物质,在氧化还原反应中只能得到电子,一般是较强的氧化剂,具有较强的氧化性。
 a.高价或较高价含氧化合物:MnO2 KClO3 KMnO4 K2Cr2O7 HNO3 H2SO4(浓)
a.高价或较高价含氧化合物:MnO2 KClO3 KMnO4 K2Cr2O7 HNO3 H2SO4(浓)
常见的氧化剂 b.高价金属阳离子:Cu2+ Fe3+ Ag+ Pb4+
c.非金属单质:Cl2 Br2 I2 O2 S
d.过氧化物:Na2O2 H2O2
㈡具有最低价元素的物质,在氧化还原反应中只能失去电子,一般是较强的还原剂,具有较强的还原性。
 a.活泼或较活泼的金属:K Ca Na Mg Al Zn Fe
a.活泼或较活泼的金属:K Ca Na Mg Al Zn Fe
b.低价金属阳离子:Fe2+ Cu+
常见的还原剂 c.非金属离子及低价态化合物:S2- H2S I- SO2 H2SO3 Na2SO3
d.较低价的化合物:CO NH3 H2
e.少数金属化合物:NaH CaH2 CaC2
八、氧化性、还原性的强弱判断方法
㈠由氧化还原反应方向比较
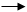 还原剂A+氧化剂B 氧化产物a+还原产物b,则:氧化性B>a,还原性A>b。
还原剂A+氧化剂B 氧化产物a+还原产物b,则:氧化性B>a,还原性A>b。
如:由2 Fe2++ Br2===2 Fe3++2Br-可知:氧化性Br2>Fe3+,还原性Fe2+>Br-
㈡根据物质活动性顺序比较判断:
1、金属活动性顺序(常见元素)
K Ca Na…Fe…Cu Hg Ag
 原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
2、非金属活动性顺序(常见元素)
F Cl Br I S
 原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强
原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强
3、由反应条件的难易比较
a. 不同氧化剂与同一还原剂反应,反应条件约易,氧化性越强。
如:F2和H2混合在暗处就能剧烈化合而爆炸,而I2与H2需在不断加热的情况下才能缓慢化合,因而F2的氧化性比I2强。
b. 不同还原剂与同一氧化剂反应,反应条件越易,还原性越强。
如有两种金属M和N均能与水反应,M在常温下能与水反应产生氢气,而N需在高温下才能与水蒸气反应,由此判断M的还原性比N强。
4、 条件相同,与同一物质反应,能使这一物质化合价变化大的 ,氧化(还原)性强。
如:2 Fe+3 Cl2=== 2 Fe Cl3 Fe+S=== FeS
可以判断氧化性:Cl2>S
5、对于同种元素:化合价高的氧化能力强,化合价低的还原能力强
如:氧化性:H2SO4(浓)>SO2>S 还原性:H2S>S>SO2
九、氧化还原反应方程式的配平技巧
㈠逆向配平法
 K2Cr2O7 + HCl(浓)=== KCl+ CrCl3+ Cl2 + H2O
K2Cr2O7 + HCl(浓)=== KCl+ CrCl3+ Cl2 + H2O
㈡设“1”配平法
P4O+ Cl2=== POCl3+ P2Cl6
㈢零价配平法
 Fe3+ HNO3== Fe(NO3)3+ NO2 + CO2 + H2O
Fe3+ HNO3== Fe(NO3)3+ NO2 + CO2 + H2O
㈣整体标价法
S+ Ca(OH)2== CaSx+ CaS2O3+ H2O
㈤缺项配平法
 MnO4-+Cl-+ ==Mn2++Cl2+H2O
MnO4-+Cl-+ ==Mn2++Cl2+H2O
㈥有机氧化还原反应方程式的配平
 KMnO4+ H2SO4+ H2C2O4== CO2 + MnSO4+ K2SO4+ H2O
KMnO4+ H2SO4+ H2C2O4== CO2 + MnSO4+ K2SO4+ H2O
第二节 离子反应
一、电解质和非电解质
1、 电解质:水溶液或融化状态、能导电、化合物
2、 非电解质:水溶液和融化状态、不能导电、化合物
3、 电解质溶液的导电能力:离子浓度越大,离子的电荷数越多,导电能力越强。
注:⑴单质与混合物不属于电解质,也不属于非电解质。
⑵金属氧化物是电解质。
⑶能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。
⑷有些化合物的水溶液能导电,但因为这些化合物在水中或融化状态下本身不能电离,也不是电解质。如SO2、SO3、NH3、CO2等,它们的水溶液都能导电,是因为跟水反应生成了电解质,它们本身都不是电解质。
⑸有些电解质不溶于水。如:硫酸钡、碳酸钙都是电解质。
二、电解质的电离
㈠电离:酸、碱、盐等在溶解与水或受热融化时,理解成能够自由移动的离子的过程。
※ 注意:1、电离的条件:溶解于水或受热融化。
2、电离不需要通电。
3、电离一般是吸热过程。
㈡强电解质与弱电解质
强电解质与弱电解质的比较
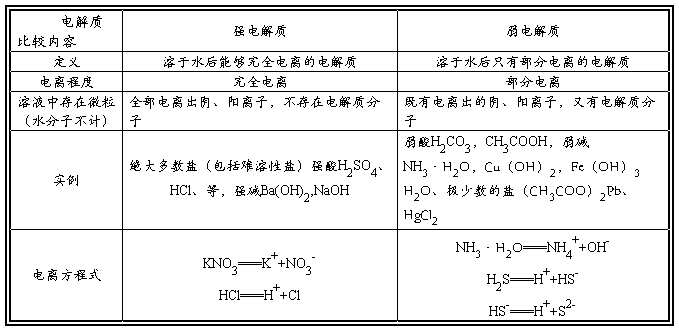
※ 注意:1、电解质的强弱与物质内部结构有关,与外界因素无关。
2、电解质的强弱与溶解性无关,BaSO4等一些难溶电解质,在水中的溶解度极小、但溶解的部分全部电离成离子,只是离子浓度太小、它不仅是电解质、而且是强电解质。
3、电解质的强弱与溶液的导电性没有必然联系,其导电能力强弱由溶液中自由离子的浓度决定,也与离子所带电荷多少有关。
㈢电离方程式
1、 离子反应是在溶液中或融化状态时进行的反应,凡非溶液中进行的反应,一般不能写成离子方程式。
如:NH4Cl固体和Ca(OH)2固体混合加热,只能写成化学方程式
2、 单质、氧化物、气体、水在离子方程式中一律写化学式;弱酸、弱碱等难电离的物质必须写化学式;难溶于水的物质等必须写化学式。
3、 ①弱酸的酸式盐:第一步完全电离,其余部分电离,如:NaHCO3== Na++ HCO3-
②强酸的酸式盐在溶液中一步完全电离,如:NaHSO4== Na++H++SO42-,但在熔融状态下,只电离出离子和酸根离子,NaHSO4(熔融)== Na++ HSO42-
③ 元弱酸的酸式酸根离子在离子方程式中不能拆开写,如NaHSO3溶液和稀硫酸反应:
 HSO3-+H+===SO2 +H2O
HSO3-+H+===SO2 +H2O
4、活泼金属的氧化物在熔融状态下也可以电离,如:Na2O融化2Na++O2-
5、微溶物的处理有三种情况:
⑴在生成物中有微溶物析出时,微溶物用化学式表示
⑵当反应物里有微溶物处于浊液状态(稀溶液)、应写成离子的形式,如CO2气体通入澄清石灰水中
⑶当反应物里有微溶物处于浊液或固态时,应写成化学式,如石灰乳中加入Na2CO3
6、操作顺序或反应物相对量不同时离子方程式不同,例如少量烧碱滴入Ca(HCO3)2溶液(此时Ca(HCO3)2过量)有:
 Ca2++ HCO3-+OH-===CaCO3 + H2O
Ca2++ HCO3-+OH-===CaCO3 + H2O
少量Ca(HCO3)2溶液滴入烧碱溶液(此时NaOH过量)有:
 Ca2++2HCO3-+2OH-=== CaCO3 +CO32-+2 H2O
Ca2++2HCO3-+2OH-=== CaCO3 +CO32-+2 H2O
7、离子方程式中浓硫酸的处理
浓硫酸跟固体反应,一律不写成离子方程式,只用化学方程式但若是浓硫酸与某溶液反应,则一律写为“2H+ SO42-”形式
8、氨在离子方程式中的书写形式
⑴有关氨气跟某溶液反应的写成“NH3”或 “NH3·H2O”
⑵有关氨气跟某物质反应的写成“NH3·H2O”
⑶在冷的稀溶液中生成氨气的写成“NH3·H2O”
 ⑷在热的溶液或冷的浓溶液中生成氨气的写成:“NH3 ”
⑷在热的溶液或冷的浓溶液中生成氨气的写成:“NH3 ”
三、常见离子的检验方法
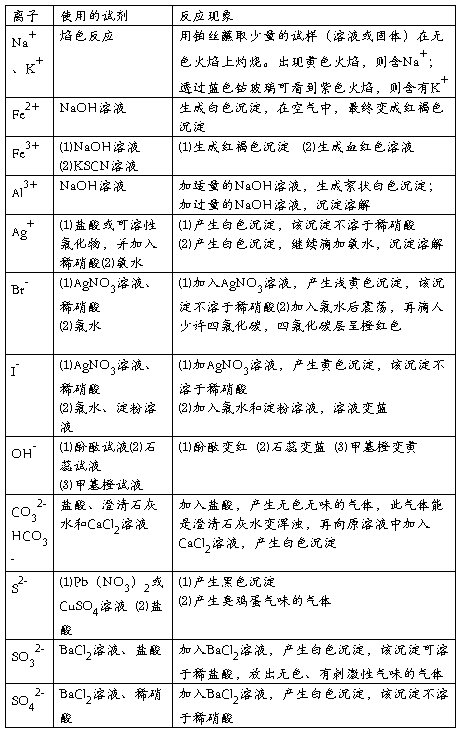
四、离子共存
常见的离子在溶液中不能大量共存的情况主要有以下几种:
1、 离子之间相互反应有沉淀析出
2、 离子之间相互反应有气体逸出
3、 离子之间相互反应生成弱电解质
4、 离子之间因相互促进水解
5、 离子之间因发生氧化还原反应
6、 离子之间因发生反应生成络离子
7、 因题目的附加条件而不能大量共存
⑴ 无色溶液中Cu2+、Fe2+、MnO4-等有色离子不能大量共存。
⑵ 看是否符合题设条件及要求,如“过量”“少量”“等物质的量”“适量”“任意量”。
⑶ 滴加顺序
⑷ 注意溶液隐含的酸碱性,如PH=1;水电离的H+浓度为1×10-12,则隐含着溶液具有很强酸性或强碱性。
⑸ 注意溶液中隐含的氧化性离子与还原性离子不能共存。
如:在PH=1的溶液中含有大量NO3-,由于酸性溶液中NO3-有强氧化性,则不能再有Fe2+、S2-等还原性离子。
