离子反应和离子方程式知识点详解
一、强电解质和弱电解质
1、电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等。
非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等。
2电解质概念应注意以下几点:
①电解质应是化合物。
②电解质的判断与溶液的溶解性无关
③电解质应是一定条件下本身电离而导电的化合物
④BaSO4、CaCO3、AgCl虽然难溶于水,但溶解部分完全电离,是强电解质。
CH3COOH、HF虽然极易溶于水,但仍属于弱电解质。
2.强电解质、弱电解质

[例1]下列物质属于电解质的是( )
A.Na2O B.SO3 C.Cu D.NaCl溶液

[例2](2008·上海)下列离子方程式书写正确的是( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓
B.过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClO
C.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+==CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O
考点三 溶液中的离子共存
1.离子共存条件:
同一溶液中若离子间符合下列任意一个条件就会发生离子反应,它们之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:如:Ba2+与CO32-,Ag+与Br-,Ca2+与SO42-等不能大量共存。
⑵生成气体或挥发性物质:如:NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等不能大量共存。
⑶生成难电离物质:如:H+与CH3COO-、CO32-、S2-、SO32-等因生成弱酸不能大量共存;OH-与NH4+因生成的弱碱不能大量共存;H+与OH-生成水不能大量共存。
⑷发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-(H+)等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
2.附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没有有色离子,如Cu2+、Fe3+、Fe2+、MnO4-
⑵强碱性溶液中肯定不存在与OH-反应的离子,如Fe3+、 Fe2+、HCO3-、NH4+、Al3+
⑶强酸性溶液中肯定不存在与H+反应的离子,如HCO3-、CO32-、S2-、CH3COO-、AlO2-
[例3](2008·全国理综)在溶液中加入少量Na2O2后仍能大量共存的离子组是( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42 -C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
【典型例题】
[例1] 下列离子方程式中,正确的是( )
A. 金属钠与水反应: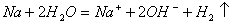
B. 石灰石和盐酸反应: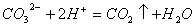
C. 氢氧化钡溶液和稀硫酸反应: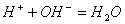
D. 过量的二氧化碳和石灰水反应: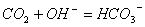 答案:D
答案:D
[例2] 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A. 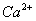 、
、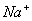 、
、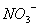 、
、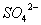 B.
B. 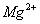 、
、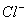 、
、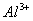 、
、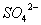
C. 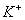 、
、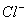 、
、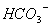 、
、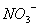 D.
D. 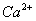 、
、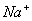 、
、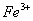 、
、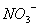 答案:B
答案:B
[例3] (1)向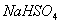 溶液中逐滴加入
溶液中逐滴加入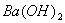 溶液显中性,请写出发生反应的离子方程式:
溶液显中性,请写出发生反应的离子方程式:
(2)在以上中性溶液中继续滴加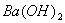 溶液,请写出此步反应的离子方程式 。
溶液,请写出此步反应的离子方程式 。
【模拟训练】
1. 能用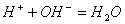 来表示的化学反应方程式的是( )
来表示的化学反应方程式的是( )
A. 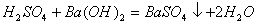
B. 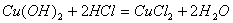
C. 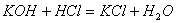
D. 
2. 下列离子在强碱性条件下,能大量共存的是( )
A. 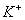 、
、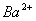 、
、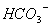 、
、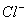 B.
B. 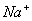 、
、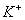 、
、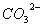 、
、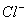
C. 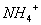 、
、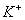 、
、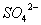 、
、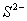 D.
D. 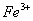 、
、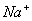 、
、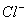 、
、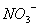
3. 下列反应的离子方程式正确的是( )
A. 碳酸氢钙溶液跟稀 反应
反应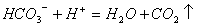
B. 饱和石灰水跟稀 反应
反应 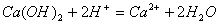
C. 向稀氨水中加入稀盐酸 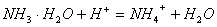
D. 碳酸钙溶于醋酸溶液 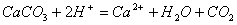
4. 下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A. 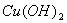 和盐酸;
和盐酸;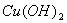 和
和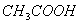
B. 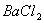 和
和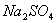 ;
;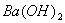 和
和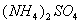
C. 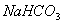 和
和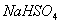 ;
;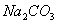 和
和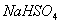
D. 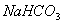 (过量)和
(过量)和 ;
;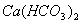 和
和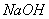 (过量)
(过量)
5. 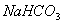 溶液和
溶液和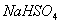 溶液混合后,实际参加反应的离子是( )
溶液混合后,实际参加反应的离子是( )
A. 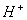 和
和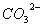 B.
B. 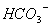 和
和 C.
C. 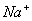 、
、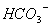 和
和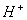 D.
D. 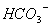 和
和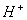
6. 下列各组离子在水溶液中能大量共存的是( )
A. 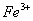 、
、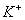 、
、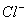 、
、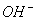 B.
B. 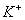 、
、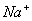 、
、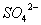 、
、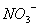
C. 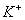 、
、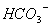 、
、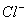 、
、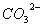 D.
D. 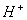 、
、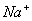 、
、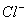 、
、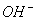
7. 下列各组离子中,在酸性溶液中能大量共存,并且溶液为无色透明的是( )
A. 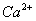 、
、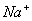 、
、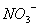 、
、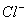 B.
B. 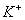 、
、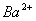 、
、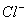 、
、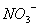
C. 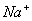 、
、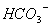 、
、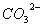 、
、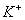 D.
D. 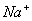 、
、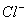 、
、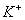 、
、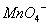
8. 用溶质的质量分数为 的盐酸作导电性实验,然后均匀通入氨气,随着氨气的通入,电流计的读数 ,其原因是 。用溶质的质量分数为
的盐酸作导电性实验,然后均匀通入氨气,随着氨气的通入,电流计的读数 ,其原因是 。用溶质的质量分数为 的氨水作导电性实验,然后均匀通入氯化氢气体,随
的氨水作导电性实验,然后均匀通入氯化氢气体,随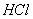 的通入,电流计读数 ,其原因是 。
的通入,电流计读数 ,其原因是 。
9. 用一种试剂除去下列各物质中的杂质(括号内物质)写出所用试剂及离子方程式。
(1)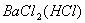 :试剂 ,离子方程式
:试剂 ,离子方程式
(2)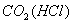 :试剂 ,离子方程式
:试剂 ,离子方程式
(3)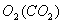 :试剂 ,离子方程式
:试剂 ,离子方程式
(4) 粉(
粉(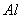 粉):试剂 ,离子方程式 (答案不唯一)
粉):试剂 ,离子方程式 (答案不唯一)
10. 某河边两旁有甲、乙两厂,它们排放的工业废水中,共含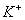 、
、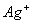 、
、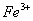 、
、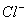 、
、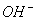 、
、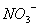 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲丁废水中所含的三种离子是
乙厂的废水中含有另外三种离子。如果加入一定量 (填“活性炭”、“硫酸亚铁”、“铁粉”)可以回收其中的金属 (填写金属元素符号)。
另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 可用来浇灌农田。
试题答案
1. C 2. B 3. AC 4. D 5. D 6. BC 7. AB
8. 基本不变;发生反应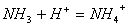 ,单位体积的溶液中离子数目不变、电荷数不变。增加;发生反应:
,单位体积的溶液中离子数目不变、电荷数不变。增加;发生反应: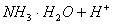
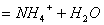 由弱电解质转变为可溶性强电解质,单位体积的溶液中离子数目增多。
由弱电解质转变为可溶性强电解质,单位体积的溶液中离子数目增多。
9. (1)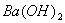 溶液
溶液 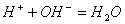
(2)饱和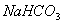 溶液
溶液 
(3)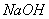 溶液
溶液 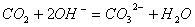
(4)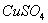 溶液
溶液 
10. 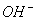 、
、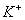 、
、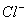 ;
;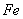 粉;
粉;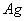 ;
;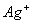 、
、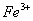 、
、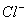 、
、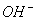 ;
;
第二篇:离子反应(知识点)
第4节 离子反应
核心知识点及知识点解读
一、离子反应发生的条件
如果离子之间结合能生成沉淀、弱电解质或气体(或挥发性物质),或者发生氧化还原反应;本质是使某种或某些离子浓度降低,就会发生离子反应。
二、离子反应能否进行的理论判据
1、焓变于熵变判据
利用ΔH-TΔS判断离子反应能否自发进行。ΔH-TΔS<0,则离子反应都能自发进行。 2、平衡常数判据
平衡常数越大,反应趋势越大,反应可自发进行,从Q和K之间的关系看,当Q<K时,正反应很容易自发进行。
三、离子反应的应用
1、用于物质检验与含量的测定
利用离子反应的特征可以检验一些离子在溶液中是否存在即定性检验。例如Fe与KSCN
3+2+2+2+2+++3+2-溶液生成血红色溶液来检验Fe,还可以检验Ba、Ca、Cu、Fe、NH4、Ag、Al、CO3、
2---SO4、Cl、Br等离子,还可以用于定量检验,例如,生成沉淀,测沉淀的质量,酸碱中和滴定,氧化还原滴定等。 3+
2、用于物质制备与纯化
离子反应可以用于制备一些酸、碱、盐、气体,如BaSO4、FeSO4、CO2、SO2、H2S等。 3、生活中的离子反应
在生活中,离子反应随处可见。如胃酸过多,服用适量的畏舒平;硬水的形成和软化;漂白粉的使用等。
四、中和滴定实验
1、中和滴定的原理
(1)定量分析:化学上把测定物质各组成成分的含量过程,称为定量分析过程。
中和滴定是定量分析的一种方法。
(2)中和滴定:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)
的方法就叫酸碱中和滴定。
—实质:H++OH=H2O即酸中的H+和碱中的OH-物质的量相等。
(3)计算原理:mHnR+nM(OH)m = MnRm+mnH2O
m n
C1·V1 C2·V2
则有:n·C1·V1 = m·C2·V2 其中C1、C2分别表示酸和碱的浓度,V1、V2 分别表示酸和碱的体积。
2、中和滴定的操作过程:
(1)仪器:酸式、碱式滴定管,移液管,滴定管夹,锥形瓶,烧杯,铁架台。酸式滴定管:玻璃活塞;碱式滴定管:不能用玻璃活塞。
注意:①酸式滴定管不能盛放碱液、氢氟酸以及Na2SiO3、Na2CO3等碱性溶液;碱式滴定管不能盛放酸性溶液和强氧化性溶液。②滴定管的刻度,O刻度在上,往下刻度标数越来越大,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度,不得一次滴定使用两滴定管酸(或碱),也不得中途向滴定管中添加。②滴定管可以读到小数点后两位
(2)药品:标准液;待测液;指示剂。
(3)准备过程:
准备:检漏、洗涤、润洗、装液、赶气泡、调液面。(洗涤:用洗液洗→检漏:滴定管是否漏水→用水洗→用标准液洗(或待测液洗)→装溶液→排气泡→调液面→记数据V(始) 注意:为什么用水洗后,还要用标准液洗? 但锥形瓶不能用待测液洗?
(4)滴定方法:手的姿势、速度先快后慢
注意:①手眼:左手操作活塞或小球,右手振荡锥形瓶,眼睛注视锥形瓶中溶液的颜色变化
②速度先快后慢
(5)终点确定:最后一滴刚好使指示剂颜色发生明显变化。30s内不恢复原色
(6)数据处理与误差分析:读数:两位小数。因一次实验误差较大,所以应取多次实验的平均值。
3、酸碱中和滴定的误差分析
误差分析:利用n酸c酸V酸=n碱c碱V碱进行分析
式中:n——酸或碱中氢原子或氢氧根离子数;c——酸或碱的物质的量浓度;
V——酸或碱溶液的体积。当用酸去滴定碱确定碱的浓度时,则:
c碱=n酸?c酸?V酸
n碱?V碱
上述公式在求算浓度时很方便,而在分析误差时起主要作用的是分子上的V酸的变化,因为在滴定过程中c酸为标准酸,其数值在理论上是不变的,若稀释了虽实际值变小,但体现的却是V酸的增大,导致c酸偏高;V碱同样也是一个定值,它是用标准的量器量好后注入锥形瓶中的,当在实际操作中碱液外溅,其实际值减小,但引起变化的却是标准酸用量的减少,即V酸减小,则c碱降低了;对于观察中出现的误差亦同样如此。综上所述,当用标准酸来测定碱的浓度时,c碱的误差与V酸的变化成正比,即当V酸的实测值大于理论值时,c碱偏高,反之偏低。
即:c碱=n酸?c酸?V酸
n碱?V碱=BV酸
同理,用标准碱来滴定未知浓度的酸时亦然,即c酸=BV碱。
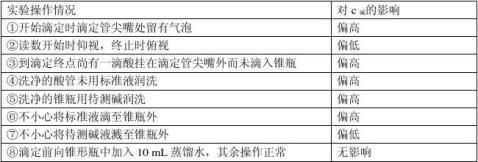
分析:对于表中①③④⑤⑥各项,标准液的实际用量V酸均超出其理论所需用量,即体积读数增大。V酸增大,根据c碱=BV酸,则所得待测碱液的浓度c碱的数据较其实际浓度偏高;对于第⑦项V酸实际用量减少,则c碱偏低;对于⑧项,向待测液中加水稀释,虽然稀释后原
-待测液的浓度减小了,但溶液中OH的物质的量并未发生变化,因而所需标准酸的体积亦
不发生变化,对待测碱液的浓度便不产生影响。
在读数时,应将滴定管放正,两眼平视,视线与溶液凹面最低处水平相切。但在实际操作中,可能会出现视线偏高(俯视)或视线偏低(仰视)的情况 ,从而使数据不准而造成误差。值得注意的是,这种情况在量筒、容量瓶和滴定管的读数时均有可能出现,只不过滴定管的零刻度与前两种不同,与量筒恰好相反,读数结果亦相反,先仰视后俯视则导致V酸数据偏小,c碱偏低。
