高中常见的原电池电极反应式的书写 一
1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)
-2++-负极: Zn–2e==Zn 正极: 2H+2e==H2↑
总反应离子方程式 Zn + 2H== H2↑+ Zn
2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)
负极: Fe–2e-==Fe2+ 正极:2H++2e-==H2↑
总反应离子方程式 Fe+2H+==H2↑+Fe2+
3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)
负极: 2Fe–4e-==2Fe2+ 正极:O2+2H2O+4e

-
总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2
4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O (铁锈的生成过程)
4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)
负极: 4Al–12e-==4Al3+ 正极:3O2+6H2O+12e-
总反应化学方程式: 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)
5、铝–空气–海水(负极--铝,正极--石墨、铂网等能导电的惰性材料,电解液--海水) 负极 :4Al-12e==4Al-+ 2+ 3+ 正极 :3O2+6H2O+12e==12OH --
总反应式为: 4Al+3O2+6H2O===4Al(OH)3 (铂网增大与氧气的接触面)(海洋灯标电池)
6、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物) 负极:Zn–2e-==Zn2+ 正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O 总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O
7、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)
负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH- 总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)
8、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )
负极:Zn+2OH-–2e-== ZnO+H2O 正极 :Ag2O + H2O + 2e-== 2Ag + 2OH- 总反应化学方程式: Zn + Ag2O == ZnO + 2Ag
9、镁铝电池:(负极--Al,正极--Mg,电解液KOH)
负极(Al): 2Al + 8OH-+6e- = 2AlO2-+4H2O 正极(Mg): 6H2O + 6e- = 3H2↑
+6OH– 总反应化学方程式: 2Al + 2OH- + 2H2O = 2AlO2-+ 3H2↑
10、一次性锂电池:(负极--金属锂,正极--石墨,电解液:LiAlCl4-SOCl2) 负极 :8Li -8e-=8 Li + 正极 :3SOCl2+8e-=SO32-+2S+6Cl-
总反应化学方程式 8Li+ 3SOCl+ 6LiCl + 2S
1、铅蓄电池:(负极—Pb 正极—PbO2 电解液— 稀硫酸)
-2--+2-放电时:负极: Pb-2e+SO4==PbSO4 正极: PbO2+2e+4H+SO4==PbSO4+2H2O
总化学方程式 Pb+PbO2 + 2H2SO4==2PbSO4+2H2O
2、镍镉电池(负极--Cd 、正极—NiOOH、电解液: KOH溶液)
Ni(OH)2+Cd(OH)2正极: 2NiOOH + 2e— + 2H2O == 2Ni(OH)2+ 2OH–
正极: 2NiOOH + 2e + 2H2O == 2Ni(OH)2+ 2OH—– 放电时 负极: Cd -2e— + 2 OH– == Cd(OH)2
总化学方程式 Cd + 2NiOOH + 2H2O===Cd(OH)2 + 2Ni(OH)2
二 电极,也可以用相同的两根电极。解决此类问题必须抓住一点:燃料电池反应实际上等同于燃料的燃烧反应,但要特别注意介质对产物的影响。电极反应式书写,先写正极,再写负极。
1、氢氧燃料电池
氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入 O2,总反应为:2H2 + O2 === 2H2O电极反应特别要注意电解质,有下列四种情况,但总反应式均相同:
(1)电解质是KOH溶液(碱性电解质)
负极:2H2 – 4e + 4OH === 4H2O 正极:O2 + 2H2O + 4e === 4OH
总反应方程式: 2H2 + O2 === 2H2O
(2)电解质是H2SO4溶液(酸性电解质)
负极:2H2 –4e- === 4H+ 正极:O2 + 4H+ + 4e- === 2H2O
总反应方程式 2H2 + O2 === 2H2O
(3)电解质是NaCl溶液(中性电解质)
负极:2H2 – 4e- === 4H+ 正极:O2 + 2H2O + 4e- === 4OH—
总反应方程式 2H2 + O2 === 2H2O
(4)电解质为熔融K2CO3(盐)
负极:2H2 – 4e-+2CO32- === 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32— 总反应方程式 2H2 + O2 === 2H2O
说明:1、碱性溶液反应物、生成物中均无H
3、中性溶液反应物中无H和OH+ + -—-— 2、水溶液中不能出现O -2--— 4、酸性溶液反应物、生成物中均无OH
2、甲醇燃料电池 (注:乙醇燃料电池与甲醇相似 )
(1)碱性电解质(铂为两极、电解液KOH溶液)
正极:3O2 + 12e- + 6H2O=== 12OH- 负极:2CH3OH – 12e- + 16OH— === 2CO32- +12H2O
总反应化学方程式:2CH3OH + 3O2 + 4KOH === 2K2CO3 + 6H2O
总反应离子方程式:2CH3OH + 3O2 + 4OH-=== 2CO32-+ 6H2O
(2)酸性电解质(铂为两极、电解液H2SO4溶液)
正极:3O2 + 12e- + 12H+ == 6H2O 负极:2CH3OH –12e- +2H2O==12H++2CO2 总反应式 2CH3OH + 3O2 === 2CO2 + 4H2O
3、CO燃料电池 (总反应方程式均为: 2CO + O2 = 2CO2)
(1)熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO入负极,空气与CO2的混合气入正极)
- 2-2-- 正极: O2 + 4e+ 2CO2 = 2CO3 负极: 2CO+2CO3 – 4e==4CO2
(2)酸性电解质(铂为两极、电解液H2SO4溶液)
正极: O2 + 4e- + 4H+ == 2H2O 负极: 2CO – 4e- + 2H2O== 2CO2 +4H+
4、甲烷燃料电池
1.碱性电解质(铂为两极、电解液KOH溶液)
正极: 2O2 + 2H2O + 8e- == 8OH— 负极: CH4 + 10OH— -8e- == CO32- + 7H2O 总反应方程式: CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O
2、酸性电解质(铂为两极、电解液H2SO4溶液)
正极: 2O2 + 8e+ 8H == 4H2O 负极: CH4 - 8e + 2H2O == 8H + CO2
总反应方程式 CH4 + 2O2 === CO2 + 2H2O - + -+
2
三、简单原理
首先我想让你明白,有些时候,深入知识的底层发掘出真理,是为了理解,方便你记忆。对于高中来说,是这样的,有些问题不能太死揪。
比如Zn和Cu形成的原电池,Zn比Cu更讨厌电子。或者说,Zn束缚电子的能力比Cu差。 Zn自然而然释放电子,形成Zn2+离子。
Zn棒和Cu棒形成等势体,在Zn上积累的电子,一半的电子自然而然会转移到了Cu这一边。
在Zn棒这边随着Zn2+积累,会排斥掉H+离子。所以Zn棒这一边的电子无法和H+反应。 而在Cu棒这边的H+会和Cu棒上积累的电子,发生反应2(H+)+2e-=H2产生氢气。
我再说一个例子给你对比。如果只有Zn棒,我们知道Zn也是可以和水反应,产生氢气的。 那既然刚才说到Zn2+把H+离子排斥掉了,那单独的Zn棒是如何产生氢气的呢。 Zn棒产生H2必须经过一下几个步骤:
1、Zn抛掉电子,形成Zn2+,Zn2+进入水溶液。
2、随着Zn棒积累的电子增多,Zn棒上的电子(负电)与Zn2+会形成很强的电场力,束缚Zn2+进入水溶液。
3、已经进入水溶液的Zn2+会在水溶液中扩散,使得H+离子有机会靠近Zn棒,进而和Zn棒上的电子反应产生氢气。
而Zn、Cu原电池最主要是,破坏了上面的第二步,因为Zn的电子会转移给Cu棒,而到了Cu棒这边又会和Cu棒那边的H+反应,使得Zn棒上的电子无法积累到达一定数量,无法形成一定的电场力,Zn棒进而会继续抛出Zn2+,新产生的Zn2+继续排斥掉水溶液中的H+,使得Zn棒这边无法产生H2,只有Cu棒这边产生H2。
第二篇:常见原电池电极反应式书写归纳
常见原电池电极反应式书写归纳
摘要:高一学生刚接触电化学知识,这部分内容比较抽象,理解起来比较难,而其中涉及的氧化还原反应知识属于高一必修1的知识,一部分学生不太记得了,所以关于原电池的电极反应式的书写把握不够扎实。对此从以下几个方面总结原电池电极反应方程式的书写,先判断原电池的正负极,然后分种三类型依次总结其电极反应方程式的书写。
关键字:原电池 电极 电极方程式
在高一化学必修2第二章第二节化学能与电能中,原电池是将化学能转化为电能的装置,利用氧化还原反应中电子的转移产生电流,比较的抽象,而原电池的电极的判断及电极反应的书写成为学生学习这一部分内容知识的最大难题,学好原电池的电极反应书写是学好化学能与电能这一节内容保障,更为以后学习电解池及其一些综合的电化学知识打下良好的基础。在总结了一些高考试题及教学上的反思后,对原电池的电极判断及电极反应的书写归纳如下:
1、 原电池正、负极的判断的原则是:电池总反应中,作还原剂的物质是负
极反应物,作氧化剂的物质是正极反应物。
(1) 依据电极的材料判断。负极是相对活泼的金属,在燃料电池中是燃料通入
的那一极;正经是相对不活泼的金属或是非金属,在燃料电池中是氧气通入的那一极。
(2) 依据电子的流向。负极是电子流出的的那一极;正经是电子流入的一级。
(3) 依据电极反应现象。负极一般是质量减少或者不断溶解的那一极;正经是
有气体生成或质量增加的一级。
例1:把A、B、C、D四块金属泡在稀硫酸中,用导线两两连接可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时 1
A极减轻;B、D相连时,B为正极。则这四种金属的活泼性顺序由大到小排列为: 解析:A与B相连时A为负极,说明活泼性A>B;C、D相连时,D有气泡,说明
D是正极,活泼性C>D;A与C相连时A极减轻,说明A极是负极;B、D相连时,
B为正极,活泼性D>B。所以总的A>C>D>B。
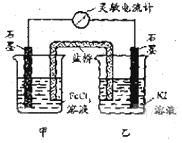
例2 :控制适合的条件,将反应2Fe3++2I-2Fe2++
I2设计成如右图所示的原电池。下列判断不正确的是...
( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
解析:本题解题的关键是判断正负极。由总反应2Fe3++2I-2Fe2++I2可
知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应,所以甲是负极,
乙是负极;当电流表读数为零时,反应达到平衡状态,此时加入FeCl2固体,反
应向逆反应方向移动,乙中I2中发生还原反应,则乙中的石墨电极为负极,故
选D。
2、 原电池正、负极电极反应式的书写技巧:
(1)先确定原电池的正负极上的反应物质,并标出相同电子数目的得失;
(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,
则该电解质溶液中的阴离子 应写入负极反应式;若正极上的反应物质是O2,
且电解质溶液为中性或碱性,则H2O必须写入正极反应式中,且O2生成OH-;
若电解质溶液为酸性,则H+必须写入正极反应式中,且O2生成H2O;若在熔
融盐电解质中反应,则O2可能得电子变成O2-。
(3)正负电极反应式相加得到电池反应的总方程式,若能写出已知电池反应的总
方程式,可以减去较易写出的电极反应式,从而得到比较难写的电极反应式。
3、 具体分类判断
(1)第一类原电池:①两个活泼性不同的电极(金属与金属、金属与石墨碳棒、
金属与难溶金属氧化物);②电解质溶液,至少要能与一个电极发生有电子转移
的氧化还原反应,一般是置换反应;③两电极插入电解质溶液中且用导线连接。
2
方法:先找出相应的正负极,此时负极材料一般本身放电被氧化,形成阳离子进入溶液中,正极材料不参与反应溶液中的阳离子在正极得电子被还原,析出金属或氢气。
如:Mg—Al—HCl溶液构成的原电池中,负极为Mg。 但Mg—Al—NaOH溶液构成的原电池中,负极为Al(Mg 与NaOH溶液不反应,Al是两性金属,可以与NaOH溶液反应)。再分析进入溶液的微粒能否在电解质环境中存在 (得失电子不能同时在同极上发生),不能
存在时应考虑其与电解质之间的后续反应。
如:Mg、Al 在碱性环境中构成的原电池
解析:在碱性环境中 Mg 不反应,其反实质为Al 与碱溶液的反应: 2Al+2OH-+6H2O=2AlO2-+3H2↑+4H2O
∴负极:2Al - 6e- + 8OH- = 2AlO2- + 4H2O
正极:6H2O + 6e- =3H2↑+ 6OH-
注意:Al-3e-=Al3+,此时Al3+在碱性环境不能稳定存在,会与OH-(过量)结合转化为AlO2-
(2)第二类原电池:① 两个活动性不同的电极; ②任何电解质溶液( 酸、碱、盐皆可);③ 形成回路。 这类原电池的特点是电极与电解质溶液不发生置换反应,电解质溶液只起导电作用。
正极一般是吸氧腐蚀的电极反应式:O2+2H2O+4e-=4OH-。
微电池即若干微小的原电池。合金或不纯的金属在潮湿空气中腐蚀就能形成微电池。电化学腐蚀即微电池腐蚀,依然是原电池原理。一般原电池和微电池的区别在于前者中两个电极不直接接触,故前者电流是在导线中流动,而后者电流是在金属体内部流过。微电池腐蚀分为析氢腐蚀(发生在酸性较强的溶液里,正极上H被还原)和吸氧腐蚀 (发生在中性、碱性或极弱酸性溶液里,正极上是氧气被还原:O2+2H2O+4e-=4OH-)
如铜绿形成的原理是:
负极(Cu):2Cu-4e-=2Cu2+
正极(杂质):2H2O+O2+4e-=4OH-
2Cu+2H2O+O2=2Cu(OH)2↓ +
3
2Cu(OH)2+CO2=Cu(OH)2CO3(铜绿)+H2O
(3)燃料电池:燃料电池的电极一般不参与反应,燃料电池的总反应往往相当于燃料的燃烧,此外还要看燃烧产物与电解质溶液是否发生反应,能反应的电解质离子参加反应,从而可得总反应。燃料电池中燃料在负极失电子,O2在正极得电
子。
燃料电池一般用酸性或碱性物质作电解质,在书写这类电池的电极反应时应注意:
①、 酸性环境中:H+能稳定存在,O2-会与H+结合成H2O
负极:2H2-4e-=4H+
正极:O2+4H++4e-=2H2O
②、碱性环境中:H+不能稳定存在会与OH-结合成水,而O2-也不能稳定存在会与水结合形成 OH-
负极:2H2-4e-+4OH-=4H2O
正极:O2+2H2O+4e-=4OH-
③、中性环境中:H+能稳定存在:O2-会与H2O结合成OH-
负极:2H2-4e-=4H+
正极:O2+2H2O+4e-=4OH-
总之,电化学部分是高中化学学习的难点之一,而高一接触了原电池部分的内容,比较难理解把握。电极方程式的书写又是电化学的难点。如何才能学好电化学知识?我想,还是要教育学生把握知识脉络,总结知识规律,增强分析能力,并将电化学的知识与日常生活紧密联系,做到活学活用。
【参考文献】
[1]冯雁. 原电池及电解池电极方程式的书写技巧[J],电大理工,2008(234):77-78.
[2]袁大国.浅议电极反应式的书写[J],专业视野,2009(11):66.
[3]刘树领. 电极反应式书写的基本流程[J],教学与管理,2011(7):75-76.
4
常见原电池电极反应式书写归纳

5
