必修1 第一章 第二节化学计量在实验中的应用 检测题
一:选择题(每题有1~2个正确选项)

1:从500mL1mol/L NaOH溶液中取出100mL溶液,对这100mL溶液的叙述中正确的是 ( )
A.物质的量浓度为1mol/L B.溶液中含1mol NaOH
C.溶液中含4gNaOH D.物质的量浓度为0.2 mol/L
2:.物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量浓度之比为 ( )
A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.3∶4∶3
3:设NA为阿伏加德罗常数,下列对0.3mol/LK2SO4溶液的不正确说法是 ( )。
A.1L溶液中含有0.3NA个K+离子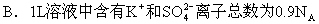
C.2L溶液中含K+的物质的量浓度为1.2mol/L
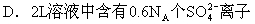
4:20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为( )
A.2.5mol/L B.5mol/L C.1.25 mol/L D.2mol/L
5:200mL0.3mmol/L的盐酸和100mL0.6 mol/L的盐酸相混,所得溶液的物质的量浓度约是 ( )
A.0.3 mol/L B.0.4 mol/L
C.0.5 mol/L D.0.6 mol/L
6:下列溶液中的Cl-离子的物质的量浓度与50mL1mol/LFeCl3溶液中的Cl-离子的物质的量浓度相同的是 ( )
A.150mL1 mol/L NaCl溶液 B.75mL2 mol/L NH4Cl溶液
C.150mL3 mol/L KCl溶液 D.75mL1 mol/L AlCl3溶液
7:20℃时,NaCl的溶解度36g,此时NaCl饱和溶液的密度为1.12g/cm3,在此温度下NaCl饱和溶液的物质的量浓度为( )
A.0.15mol/L B.1.36mol/L C.5.07mol/L D.6.15mol/L
8:0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比为( )
A.1∶3 B.3∶1 C.5∶2 D.15∶2
9:将30mL 0.5 mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为 ( )
A.0.03 mol/L B.0.3 mol/L C.0.05 mol/L D.0.04 mol/L
10:50mL H2SO4的质量分数为35%、密度为1.24g/cm3的硫酸中,H2SO4的物质的量浓度为 ( )
A.0.044 mol/L B.0.44 mol/L C.4.4mol/L D.44mol/L
11:配制2L1.5mol/LNa2SO4溶液,需要固体Na2SO4( )
A.213g B.284g C.400g D.426g
12:用10mL的0.1mol/LBaCl2溶液恰好使相同体积的硫酸铁,硫酸锌,和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是 ( )
A.3∶2∶2 B.1∶2∶3 C.1∶3∶3 D.3∶1∶1
13:下列说法中不正确的是 ( )
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C含有约6.02×1023个碳原子
C.1个氧原子的实际质量约为32/6.02×1023g
D.3molOH-的质量为51g
14:0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素可能是 ( )
A.Ca B.Na C.Al D.Mg
15:从1mol/LNaOH溶液2L中取出100mL,有关这100mL溶液的叙述中不正确的是 ( )
A.物质的量浓度为0.1mol/L B.物质的量浓度为1mol/L
C.含NaOH 40g D.含NaOH0.1mol
16:将7.45g氯化钾和11.1g氯化钙组成的混合物溶于水配成200mL溶液,此溶液中Cl-离子的物质的量浓度是 ( )
A.3mol/L B.1.5mol/L C.0.3mol/L D.0.2mol/L
17:下列各组物质中,两种物质分子数相同的是 ( )
A.1gH2和8gO2 B.18gH2O和22.4LCO2(标准状况)
C.1molHCl和11.2LCO(20℃101kPa时) D.6.02×1023个H2分子和0.5molN2
18:若以NA代表阿伏加德罗常数,下列说法中正确的是( )
A.2.3g金属钠变成Na+时共失去0.1NA个电子 B.18g水所含电子数为NA
C.32g氧气所含原子数为2NA D.11.2LN2所含原子数为NA
19:下列数量的各物质所含原子数按由大到小顺序排列是 ( )
①4℃时144mL水 ②34g氨气 ③标准状况下224L氢气 ④1.1mol硫酸
A.④③②① B.①②③④ C.③①④② D.①③②④
20:下列溶液中的Cl-的物质的量浓度与50mL1mol/L AlCl3溶液中Cl-物质的量浓度相等的是( )
A.150mL 1 mol/L氯化钠 B.75mL 2 mol/L氯化铵
C.150mL 3 mol/L氯化钾 D.75mL 1 mol/L氯化铁
二:填充题
1:欲配制1mol/L的Na2CO3溶液250mL,完成下列步骤:
(1)用天平称取NaOH固体____g,做法是先在托盘天平的两盘上各放__
,把天平调整好。在____盘上用_____放_____g砝码,并将游码移到适当的位置上,用_____取Na2CO3粉末 g放于___ __盘上。
(2)将称量好的NaOH固体放入__ __中加_ ___ 蒸馏水将其溶解,待__ _后,将溶液沿___ _移入__ __mL 的容量瓶中。
(3)用少量蒸馏水冲洗___ _次,将冲洗液移入_ ___中,在操作过程中不能损失点滴液体。否则会使溶液的浓度偏___ _(低或高)
(4)向容量瓶内加水至刻度线___ _时,改用__ __小心加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏__ __,应该___ _。
最后盖好瓶塞,倒转,振荡,摇匀。
2:1 mol CO2的质量约是1个CO2分子质量的__ ___倍,1mol CO2的质量与CO2的相对分子质量相比,两者__ ___相同,但前者以__ __为单位,后者以___ _为标准。某瓶CO2中含有1.204×1024个CO2分子,这些CO2的质量为__ __g。2molCO2中所含的氧原子数为__ __个。5mol CO32-质量为____g,它和___ _molMg2+质量相同,它和___ _gSO42-含有相同的离子数
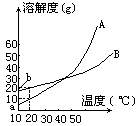
3:A、B两种化合物的溶解度曲线如下图所示,现要用结晶法从A、B混合物中提取A(不考虑A、B共存时,对各自溶解度的影响)
(1)取50g混合物,将它溶于100g热水,然后冷却至20℃。若要使A析出而B不析出,则混合物中B的质量分数(B%)最高不能超过多少?(写出推理及计算过程)
(2)取Wg混合物,将它溶于100g热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混合物中A的质量分数(A%)应满足什么关系式?(以W、a、b表示,只需将答案填写在下列横线的空白处。)
当w<a+b时__ __
当w>a+b时__ __
4:常温下A和B两种气体组成混合物气体(A的相对分子质量大于B的相对分子质量),经分析,混合气体中只含有氮和氢两种元素;而且,不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为_ ___,B为__ __。其理由是__ _
_ 。若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为___ _;A在混合气体中的体积分数为__ __%。
三;计算题
1:将4mL37%的浓盐酸(密度为1.19g/cm3)加水稀释至200mL求稀释后盐酸的物质的量浓度。
2:为15%、密度为1.2g/cm3的硫酸250mL(不含铁化合物或其它酸)跟过量的铁屑充分反应,计算:
(1)这种硫酸的物质的量浓度。
(2)制得氢气(标准状况)的体积。
(3)把生成的硫酸亚铁配制成400mL溶液,这溶液的物质的量浓度是多少。
3:常温下,将20.0g14.0%的NaCl溶液跟30.0g24%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。试计算:
(1)该混合溶液中溶质的质量分数。
(2)该溶液的物质的量浓度。
(3)在1000g水中需溶入多少摩NaCl,才能使其浓度与上述混合溶液的浓度相同。
一:选择题

二:填充题:
1:(1)10 、一张等重的纸,右,镊子、10、左(2)烧杯,少量,冷却,玻璃棒,250 (3)2~3,容量瓶,低 (4)2~3cm,胶头滴管,低,重新配制 (5)摇匀,试剂瓶
2:6.02×1023;数值;g;碳-12 质量的1/12;88;2.408×1024;300g;12.5;480
3:(1)在20℃时,若要B不析出,该溶液中B的质量不能超过20g,由于A、B质量共50g,所以这时A的质量超过30g,大于它的溶解度,A析出,符合题意。即50g×B%≤20g,B%≤40%。
(2)当W<a+b时,A%>a/w;当W>a+b时,A%≥W-b/W;
4:NH3 N2 纯NH3气体中氮和氢的质量比为14/3,在纯NH3中混入任何比例的N2都将使氮和氢的质量比大于14/3 4∶1 80%。
三:计算题
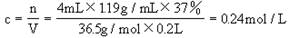 1:
1:
2:
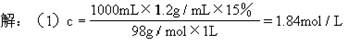
(2)因铁屑过量,故制得H2的量以H2SO4来计算
H2SO4 ~ H2
1mol 22.4L
1.84mol/L×0.25L x
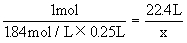
解得x=10.3L
故标况下制得H210.3L。
(3)生成FeSO4的物质的量等于H2SO4的物质的量。
故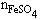 =
=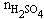 =1.84mol/L×0.25L
=1.84mol/L×0.25L
=0.46mol
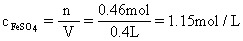
3:解(1)混合溶液中溶质的质量分数为:
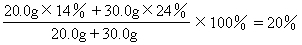
(2)混合溶液的物质的量的浓度为:

(3)设1000g水中需加入NaCl的物质的量为x。

解得:x=4.27mol
第二篇:必修一第1章 化学计量在实验中的应用 自测阶段达标检测
第一章 化学计量在实验中的应用

(时间90分钟,满分100分)
一、选择题(本题包括16个小题,每小题3分,共48分)
1.(2010·安庆模拟)设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,3.2 g O3所含电子数为1.2 NA
B.标准状况下,2.24 L CCl4中含有的C—Cl键的数目为0.4 NA
C.标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2NA
D.将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+
解析:3.2 g O3含0.2 NA个氧原子,所含电子数为1.6 NA,A不正确;标准状况下,CCl4是液体,B不正确;NO、O2都是双原子分子,二者物质的量和为1 mol,故所含原子数为2NA,C正确;因Fe3+水解,Fe3+的数目应小于0.1 NA,D不正确.
答案:C
2.(2009·浙江高考)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
B.1 mol乙烷分子含有8NA个共价键
C.58.5 g的氯化钠固体中含有NA个氯化钠分子
D.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1NA
解析:A项,0.25 mol NO与0.25 mol O2将反应生成0.25 mol NO2,剩余O2 0.125 mol,不考虑NO2转化N2O4,分子总数应为0.375NA;B项,乙烷的结构式为,

1 mol分子中含7NA个共价键;C项,NaCl为离子晶体,
无分子;D项正确,因CO水解使得阴离子数增加.
答案:D
3.(2010·汕头二模)只给出下列甲和乙中对应的量,不能求出物质的量的是 ( )
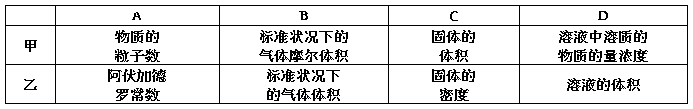
解析:根据n=、n=、nB=cBV可知,A、B、D中都能求出物质的量.
答案:C
4.某氯化镁溶液的密度为1.18 g/cm3,其中镁离子的质量分数为5.1%,300 mL该溶液中氯离子的物质的量约等于 ( )
A.0.37 mol B.0.63 mol
C.0.74 mol D.1.5 mol
解析:n(Mg2+)==0.75 mol,
在MgCl2溶液中,Mg2+与Cl-的物质的量之比为1∶2,则n(Cl-)=2n(Mg2+)=2×0.75 mol=1.5 mol.
答案:D
5.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol/L和b mol/L.则a与b的关系为
( )
A.a=b B.a=2b
C.2a=b D.a=5b
解析:n(CuO)∶n(MgO)=∶=∶=1∶2,体积相同时,物质的量的比等于物质的量浓度的比,所以==,即2a=b,故选C.
答案:C
6.某溶液中大量存在以下五种离子:NO、SO、Fe3+、H+、M,其物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为 ( )
A.Fe2+ B.Mg2+
C.CO D.Ba2+
解析:根据电荷守恒可知M为+2价的阳离子,排除CO,由于原溶液中存在SO,根据离子共存知,其中不可能含有Ba2+,又因原溶液中含有NO和H+,使溶液具有强氧化性,所以原溶液中不可能存在Fe2+.
答案:B
7.有一真空瓶的质量为W1 g,向该瓶充入氧气后的质量为W2 g,在相同条件下充入某一单质气体,其质量为W3 g,则此单质气体的摩尔质量为 ( )
A.×32 B.×32
C.×32 g/mol D.×32 g/mol
解析:根据题意,该气体物质的量与氧气相同,有如下关系:=,即可确定答案.
答案:C
8.在标准状况下,若V L甲烷中含有的氢原子个数为n,则阿伏加德罗常数的数值可表示为 ( )
A.Vn/22.4 B.22.4n/V
C.Vn/5.6 D.5.6n/V
解析:设阿伏加德罗常数为NA,则依题意,可得×4NA=n,即NA=
mol-1.
答案:D
9.若以w1和w2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列判断正确的是(氨水的密度比纯水的小) ( )
A.2w1=w2 B.2w2=w1
C.w2>2w1 D.w1<w2<2w1
解析:设溶液的体积为V L,密度为ρ g/mL,溶质的摩尔质量为M g/mol,物质的量浓度为c mol/L,由c=得:a=1000ρ1w1/17,b=1000ρ2w2/17,因为2a=b,所以有2ρ1w1=ρ2w2,又氨水的密度比纯水小,且浓度越大,密度越小,所以ρ1>ρ2,代入上式得:2w1<w2.
答案:C
10.300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO的物质的量浓度为 ( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
解析:n(Al3+)==0.06 mol,则n(SO)=0.09 mol.加入的Ba(OH)2溶液中含Ba2+ 0.03 mol,反应后剩余SO 0.06 mol,此时溶液的体积为600 mL,因此c(SO)=0.1 mol/L.
答案:D
11.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9 g/cm3,这种氨水的物质的量浓度和质量分数分别为 ( )
A.18.4 mol/L 34.7% B.20.4 mol/L 38.5%
C.18.4 mol/L 38.5% D.20.4 mol/L 34.7%
解析:NH3溶于水后虽然大部分生成NH3·H2O,但在计算时,仍以NH3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积.设水的体积为1 L,则有:
w=×100%
=34.7%
氨水的体积为:
V==1.7 L
故c==18.4 mol/L.
答案:A
12.以下仪器,用蒸馏水洗净后便可立即使用而不会对实验结果造成误差的是 ( )
①中和滴定用的锥形瓶 ②中和滴定用的滴定管
③容量瓶 ④配制一定体积、一定物质的量浓度的NaOH溶液,用于称量的小烧杯 ⑤量筒(量取浓H2SO4用)
A.①②⑤ B.①③
C.②④⑤ D.①⑤
解析:中和滴定时锥形瓶中有蒸馏水不会对实验结果产生误差,容量瓶定容时仍会加水至刻度线.
答案:B
13.某学生配制了100 mL 1 mol/L的硫酸溶液.然后,对溶液浓度做精确测定,且测定过程中一切操作都正确.结果测得溶液的物质的量浓度低于1 mol/L.那么,在配制过程中,下列操作可能导致溶液浓度偏低的是 ( )
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
A.②③④ B.③④
C.①②③ D.①②③④
解析:①量筒用蒸馏水洗净后量取,浓H2SO4被稀释,所取溶质H2SO4偏少,会导致浓度降低.②未洗涤烧杯,溶质H2SO4损失,会导致浓度偏低.③少量溶液流到容量瓶外面,溶质H2SO4损失,会导致浓度偏低.④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低.
答案:D
14.下列叙述正确的是 ( )
A.与28 g CO具有相同分子数的CO2的质量一定是44 g
B.与V L CO具有相同分子数的CO2的体积一定是V L
C.所含原子数相等的CO与CO2的密度之比为7∶11
D.所含原子数相等的CO与CO2的密度之比为21∶22
解析:A项:根据公式=n=,可列式:=,可判断A项正确.B、C、D都未指明两种气体所处的温度和压强是否相同,所以说法都不正确.
答案:A

15.(2010·深圳一调)右图是某硫酸试剂瓶的标签上的部分文字.据
此,下列说法正确的是 ( )
A.该试剂应保存在玻璃试剂瓶中,并用橡胶塞塞紧
B.1 mol Zn与足量的该硫酸反应生成2 g 氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2
mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,
被还原的硫酸的物质的量小于0.46 mol
解析:浓硫酸有腐蚀性,不能用橡胶塞,应用玻璃塞,A错误.浓硫酸具有强氧化性,其还原产物为SO2,B错误.C项设硫酸与水的体积分别为1 mL,混合后浓度为(1.84 g/cm3×1 mL×98%÷98 g/mol)÷0.002 L=9.2 mol/L,但实际混合后溶液密度有变化,其浓度不等于9.2 mol/L,C错误.D中随反应进行,浓硫酸变为稀硫酸时反应停止,被还原的硫酸小于×0.05 L×18.4 mol/L,即小于0.46 mol.
答案:D
16.对于1 mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化) ( )
A.将标准状况下22.4 L氨气溶于1 L水中配成溶液,即可得1 mol/L的氨水
B.1 mol/L的氨水的质量分数小于1.7%
C.将1 mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol/L
D.将1 mol/L的氨水与3 mol/L的氨水等质量混合后,所得氨水的物质的量浓度为2 mol/L
解析:A项,因氨水以起始溶入的氨为溶质,故将1 mol氨溶于水配成1 L溶液,其物质的量浓度为1 mol/L;B项,由物质的量浓度与质量分数的关系,可有以下表达式:=1 mol/L,又由于氨水的密度ρ<1 g/cm3,故w>1.7%;C项,若将1 mol/L的氨水与水等体积混合,所得氨水的浓度为0.5 mol/L,由于氨水密度比水小,则相同质量的氨水的体积比水大,故等质量混合后所得氨水的物质的量浓度大于0.5 mol/L;D项,因氨水的浓度越大,其密度越小,则等质量混合时,3 mol/L的氨水所占体积比1 mol/L的氨水大,故所得氨水的物质的量浓度大于2 mol/L.
答案:C
二、非选择题(本题包括6个小题,共52分)
17.(7分)(1)将40 g NaOH溶于水,配成250 mL溶液甲,甲的浓度为 mol/L(将正确选项的标号填入空格,下同).将50 mL甲加水稀释至100 mL后,得溶液乙,乙的浓度为 mol/L.将10 mL乙溶液与质量分数为9%、密度为1.11 g/cm3的NaOH溶液10 mL混合,该混合溶液丙的浓度为 mol/L(忽略溶液体积变化).混合溶液丙能与 mL 0.5 mol/L的盐酸恰好完全中和.

(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是 ,X的相对原子质量是 .
解析:(1)n(NaOH)==1 mol,
c(甲)==4 mol/L;
c(乙)==2 mol/L;
c(丙)=
=2.25mol/L,丙中NaOH的物质的量等于HCl的物质的量,n(HCl)=2.25 mol/L×0.02 L=0.045 mol,
V[HCl(aq)]==0.09 L(即90 mL).
(2)n(Na2X)=n(Na+)=×0.4 mol=0.2 mol,M(Na2X)==62 g/mol,M(X)=62 g/mol-2×23 g/mol=16 g/mol,
因此,X的相对原子质量为16.
答案:(1)A C H D (2)62 g/mol 16
18.(12分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
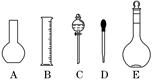
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 0.1 mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
.
解析:(1)五种仪器分别为烧瓶、量筒、分液漏斗、胶头滴管、容量瓶,配制上述溶液肯定不需要烧瓶和分液漏斗,还需要烧杯、玻璃棒.
(2)容量瓶不能用于贮存、加热溶液,它只有一个刻度线,也不能测量容量瓶规格以下的任意体积的液体.
(3)因无450 mL的容量瓶,配制NaOH溶液只能用500 mL的容量瓶,m(NaOH)=c·V·M=0.1 mol/L×0.5 L×40 g/mol=2.0 g,定容仰视刻度线,造成加水较多,浓度偏低,洒落溶液会造成溶液浓度偏低.
(4)由稀释前后物质的量相等,V(浓)==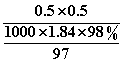 L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻
L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻
璃棒不断搅拌.
答案:(1)A、C 烧杯、玻璃棒 (2)B、C、E、F
(3)2.0 小于 小于
(4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
19.(6分)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液.
(1)该混合溶液中NaCl的质量分数为 .
(2)该混合溶液中NaCl的物质的量浓度 mol/L.
(3)在1000 g水中需加入 mol氯化钠,才能使其浓度恰好与上述混合溶液浓度相等(保留1位小数).
解析:(1)混合溶液的质量为:20.0 g+30.0 g=50.0 g,混合溶液中溶质的质量为:20.0 g×14%+30.0 g×24%=10.0 g,混合溶液中溶质的质量分数为:×100%=20%.
(2)n(NaCl)=
V(溶液)=
c(NaCl)=
=×
=4.0 mol/L.
(3)×100%=20%
n(NaCl)=4.3 mol.
答案:(1)20% (2)4.0 (3)4.3
20.(10分)配制一定物质的量浓度的溶液是一个重要的定量实验.请回答以下问题:
(1)配制浓度为 2 mol/L的NaOH溶液100 mL,用托盘天平称取NaOH固体时,天平读数将 (填写代号,下同).
A.等于8.0 g B.等于8.00 g
C.大于8.0 g D.等于0.2 g
(2)要配制浓度约为2 mol/L的NaOH溶液100 mL,下面的操作正确的是 .
A.称取8 g NaOH固体,放入250 mL烧杯中,用量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,边搅拌边慢慢倒入烧杯中
(3)下列操作会使配制的BaCl2溶液浓度偏低的是 .
A.配制1 L 0.1 mol/L的BaCl2溶液时,将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(4)某实验中需2 mol/L的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格为 ,称取Na2CO3的质量为 .
解析:(1)称量NaOH固体时需用小烧杯盛放,故天平读数等于(8.0 g +烧杯质量).(2)注意NaOH溶液的浓度约为2 mol/L,并不是精确配制浓度为2 mol/L的溶液.(3)配制一定物质的量浓度溶液的误差分析要紧扣c=,分析错误操作对n、V的影响.(4)根据容量瓶的常用规格可知,应配制2 mol/L的Na2CO3溶液1000 mL,所需Na2CO3的质量为:1 L×2 mol/L×106 g/mol=212 g.
答案:(1)C (2)AD (3)AC (4)1000 mL 212 g
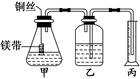 21.(9分)某研究性学习小组为证明在同温同压下,相同浓度、
21.(9分)某研究性学习小组为证明在同温同压下,相同浓度、
相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气
的体积相同而反应速率不同,同时测定实验室条件下的气体摩
尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤
如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液.
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端.
④检查装置的气密性,在广口瓶中装满水,按图连接好装置.
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 .
⑥反应结束后,读取量筒内水的体积为y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管.
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 .
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 .
(4)简述速率不等的原因 ,铜丝不与酸接触的原因是
.
解析:Ⅰ.②根据量取溶液体积的精确度要求可知使用酸式滴定管;⑤比较H2SO4、H2C2O4反应速率可通过观察气泡或完全反应所用时间长短.Ⅱ.(1)配制溶液需要使用特定的仪器(250 mL的容量瓶),定容时需用到胶头滴管.(2)为保证测量数据的准确,应该先将气体冷却到室温,所以应该先进行操作②,然后调整液面使气体压强等于外界大气压,最后正确读数.(3)如丙(量筒)中的液面高于乙的液面,应将丙向下移动.(4)因为H2SO4是强酸、H2C2O4是弱酸,故同浓度的两溶液H2SO4中含氢离子浓度大,反应速率快.若铜丝接触溶液,则构成原电池,使反应速率加快,影响实验结果.
答案:Ⅰ.酸式滴定管 反应所需时间
Ⅱ.(1)250 mL的容量瓶 胶头滴管
(2)②①③ (3)下移丙
(4)氢离子浓度不同 易形成原电池加快反应速率,干扰实验的测定
22.(8分)(2010·南京模拟)将10 g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中,加热;生成的氨用100 mL 0.5 mol/L硫酸全部吸收,多余的硫酸用2 mol/L NaOH溶液中和,用去NaOH溶液25 mL.已知复盐中SO的质量分数为48%,则x= ,y= .
解析:解答时可根据题意首先求得铵根离子的物质的量,根据10 g复盐中SO的质量分数为48%,可求SO的物质的量.根据复盐中阴阳离子所带正、负电荷数相等,可求出Cu2+的物质的量,再根据总质量和已知各部分的物质的量,求出水的物质的量,进而求得各部分物质的量之比.
10 g复盐中n(NH)=2×(0.5 mol/L×0.1 L-2 mol/L×0.025 L×)=0.05 mol
n(SO)==0.05 mol
n(Cu2+)=0.05 mol-0.05 mol×=0.025 mol
n(H2O)=
=0.15 mol
n(CuSO4)∶n[(NH4)2SO4]∶n(H2O)
=0.025∶0.025∶0.15=1∶x∶y
得x=1,y=6
答案:1 6
